谷子SiPRR73基因的光温调控模式 及非生物胁迫响应特性
闫留延,李剑峰,张世文,张 博,王永芳,张小梅,祖超凡,王振山, 桑璐曼,何占祥,贾小平,董志平
(1.河南科技大学 农学院,河南 洛阳 471023;2.河北省农林科学院 谷子研究所,国家谷子改良中心,河北 石家庄 050035)
PRRs(Pseudo-response regulators)家族基因广泛参与植物花期调控、生物量积累及对逆境胁迫的抵御作用[1-4]。作为PRR家族的重要成员,PRR73是拟南芥(Arabidopsisthaliana)PRR7的直系同源基因,目前在C4作物中报道较少,只在玉米(Zeamays)中利用图位克隆法获得了该基因[5]。作为我国重要的杂粮作物,谷子(Setariaitalica)遗传资源丰富,地理分布广泛,存在较多的光温敏感自然变异类型,是C4禾谷类作物光温敏感调控机制研究的理想模型[6-9]。研究谷子PRR73基因对光温及非生物胁迫的响应特点,可以了解光周期和温度如何共同调控PRR73基因表达来实现谷子对不同光温环境的适应性调节,揭示PRR73基因参与非生物胁迫调节的可能机制,具有重要意义。
PRRs家族蛋白质包含3个区域:PRR结构域、CCT结构域和可变域,分别位于蛋白质的N端、C端和中部[10-13]。被子植物PRRs基因的PRR、CCT结构域高度保守,但PRR结构域中个别氨基酸变化可以导致基因功能改变[14-15]。对玉米ZmPRR73的研究表明,在不保守的可变域中氨基酸的变化可能也影响光周期敏感性[5]。拟南芥PRR7通过CONSTANS依赖途径控制开花时间,可以阻遏CCA1和LHY启动子的活性,调节CCA1和LHY响应环境温度和调节细胞内活性氧的水平[12-13,16-20]。此外,PRR7能够负调控抗冷基因CBF和调节ABA来响应冷胁迫和干旱胁迫,参与植物对铁过量的适应性反应[20-24]。谷子和其他禾本科作物一样,光周期调控开花研究已经有所报道,但光周期和温度如何共同调控生长发育的研究则极少涉及[25-33]。事实上光周期和温度通过复杂的互作效应影响谷子生长发育,一些光周期途径的关键基因如SiCCT参与了谷子光温互作调控[34]。
作为光周期调控途径的另一个关键基因,PRR73在C4作物光温互作调节以及应对非生物胁迫中是否起到一定作用是值得研究的一个问题。本研究从谷子中克隆SiPRR73基因,系统分析其对光周期、光温组合以及5种非生物胁迫的响应特性,以揭示光周期和温度对SiPRR73基因的调控模式以及这种调控对谷子适应不同光温环境的潜在意义,并揭示SiPRR73基因参与抵抗非生物胁迫的调节机制。
1 材料和方法
1.1 试验材料
所用的谷子品种延谷11号来自陕西,是对光温较敏感的春谷品种。
1.2 材料种植及样品采集
采用盆栽种植,所用塑料盆规格为10 cm×10 cm,盆内装有营养土,种植120盆,每盆播种5~8粒种子,置于25 ℃、14 h光/10 h暗的培养室长至三叶期定苗,其中部分植株在五叶期采集嫩叶用于克隆SiPRR73基因;另有部分植株继续培养,抽穗后采集根、茎秆、次顶叶、顶叶、穗颈、幼穗于液氮中保存。设置长日照(25 ℃、15 h光/9 h暗,LD)、短日照(25 ℃、9 h光/15 h暗,SD)2个不同光周期处理,每个处理24盆,其中,长日照设定21:00—6:00为黑暗, 6:00—21:00为光照;短日照设定15:00—6:00为黑暗, 6:00—15:00为光照(下同)。在六叶期时于6:00开始取样,取顶端嫩叶,每隔2 h取样一次,连续48 h取样,此外从三叶期开始于9:00取样,每隔3 d取样一次,短日照取至八叶期(抽穗),长日照取至十二叶期,所有样品于液氮保存。设置4种光温组合处理:低温长日照(温度22 ℃、光周期15 h光/9 h暗,LTLD)、低温短日照(温度22 ℃、光周期9 h光/15 h暗,LTSD)、高温长日照(温度27 ℃、光周期15 h光/9 h暗,HTLD)、高温短日照(温度27 ℃、光周期9 h光/15 h暗,HTSD);每个处理16盆,培养至六叶期从6:00开始取样,每隔3 h取样一次,连续24 h取样,所采顶端嫩叶于液氮中保存。
用于非生物胁迫处理的谷苗种植条件同上,每个胁迫处理和对照处理均8盆谷苗,在培养室(温度为25 ℃,光照条件为14 h光/10 h暗)培养21 d,随后进行胁迫处理,NaCl、ABA、EDTA-Fe、PEG6000的处理浓度分别为200 mmol/L、100 μmol/L、600 μmol/L、20%,低温处理温度为15 ℃。对照组(温度为25 ℃,光照条件为14 h光/10 h暗,CK)和每个处理组取样时间均为处理前(0 h),胁迫处理后0.5,1,2,4,8,16,24 h,所取的顶端嫩叶于液氮中保存。
1.3 SiPRR73的克隆及生物信息学分析
叶片总RNA的提取及反转录分别用康为世纪RNA提取试剂盒及宝生物公司第一链cDNA合成试剂盒完成,基因特异引物信息见表1。基因扩增体系为20 μL,包括cDNA模板1 μL,2×Es Taq MasterMix(Dye)10 μL,引物(正向与反向混合)0.5 μL,剩余体积用ddH2O补足。扩增循环程序: 94 ℃预变性4 min;变性(94 ℃/30 s)、退火(58 ℃/30 s)、延伸(72 ℃/90 s),循环35次;最后72 ℃延伸 8 min。PCR产物用全式金的胶回收试剂盒纯化回收,回收产物连入pBM16A载体,转化DH5α感受态细胞,挑选阳性克隆进行测序。
利用NCBI的BlastP程序(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastp&PAGE_TYPE=BlastSearch&LINK_LOC=blasthome)搜索保守结构域;从公共数据库下载其他物种的43个PRR73蛋白序列,利用 ClustalW 1.8软件对包含谷子SiPRR73蛋白的44条PRR73蛋白序列进行多序列比对,系统进化树构建采用MEGA 6.05软件。
1.4 谷子SiPRR73基因的表达分析
按照1.3步骤完成样品RNA的提取及第一链cDNA的反转录合成,谷子内参基因SiActin和SiPRR73基因分别用表1中对应的特异引物(SiActin-FQ、SiPRR73-FQ)进行扩增。扩增体系按照TB GreenTM 试剂盒(宝生物公司)说明书准备,使用罗氏荧光定量PCR仪扩增,两步法扩增程序:预变性(95 ℃/30 s);40个循环包括变性(95 ℃/30 s)、退火(58 ℃/30 s)。基因相对表达量的计算用2-ΔΔCt方法。

表1 基因扩增及荧光定量PCR引物Tab.1 Primers used for gene amplification and fluorescence quantitative PCR
2 结果与分析
2.1 SiPRR73基因结构域、进化关系分析
从谷子叶片提取高质量总RNA(图1-A),反转录合成第一链cDNA,利用RT-PCR技术分2段扩增SiPRR73基因,扩增产物SiPRR73-G1、SiPRR73-G2经电泳检测与目标片段相符(图1-B)。回收片段经测序后拼接得到2 928 bp的cDNA序列,其中CDS长度为2 283 bp,推定的蛋白质氨基酸数量为760个。SiPRR73 蛋白含有REC、CCT等2个结构域(图2)。系统进化分析表明,C4作物家族的谷子、高粱(Sorghumbicolor)、糜子(Panicummiliaceum)、玉米(Zeamays)、哈氏黍(Panicumhallii)PRR73蛋白具有较近的进化关系(图3)。

A.谷子总RNA电泳:1,2.两管RNA。B.SiPRR73基因的RT-PCR产物电泳:1.DL2000 Marker;2,3.分段扩增产物SiPRR73-G1、SiPRR73-G2。
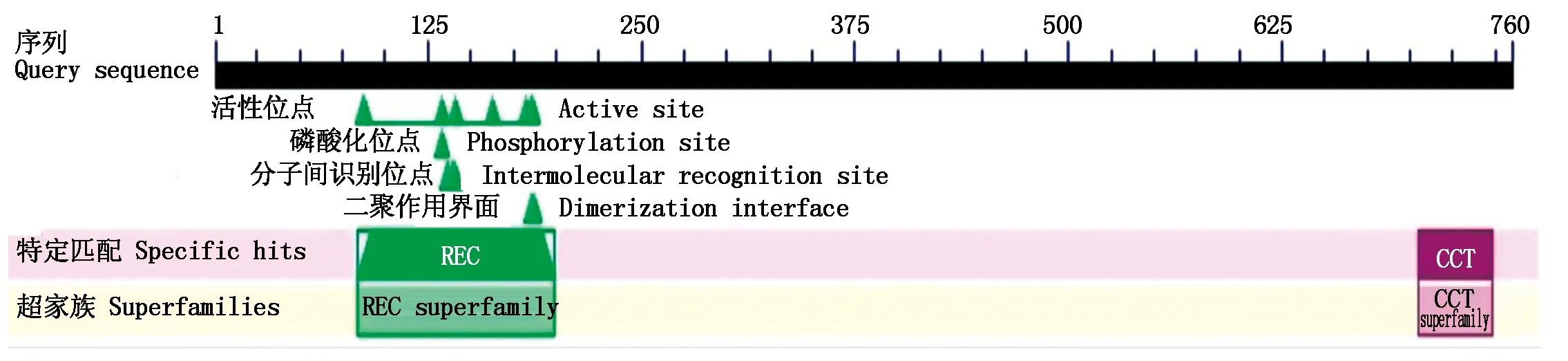
图2 SiPRR73蛋白所包含的结构域Fig.2 The domains contained in SiPRR73 protein

图3 PRR73蛋白的分子系统进化树Fig.3 Molecular phylogenetic tree of PRR73 proteins
2.2 谷子不同组织部位SiPRR73基因的表达特性
SiPRR73基因具有明显的组织表达特异性,在次顶叶表达水平最高,其次为顶叶,随后依次为穗颈、幼穗、茎秆、根(图4)。
2.3 SiPRR73基因对光周期的响应特点
两昼夜基因表达模式一致,因此,图5-A中只展示24 h表达模式。短日照条件下,SiPRR73基因在光照8 h后(14:00)表达量达到峰值,随后开始下降,在整个昼夜中呈节律性表达,只出现一个表达峰。长日照条件下,SiPRR73基因在8:00表达量迅速升高,在10:00和14:00出现表达峰值,14:00后表达量缓慢下降。总之,SiPRR73基因呈现出光依赖性昼夜节律表达模式,短日照下只有一个表达峰,长日照下有2个表达峰,且无论长日照还是短日照光照期表达水平总体高于黑暗期。从图5-B可以看出,总体上短日照条件下从三叶期到八叶期(抽穗)SiPRR73基因的表达水平要低于长日照,长日照条件下八到十二叶期仍维持营养生长,SiPRR73在十一、十二叶期表达量升至较高水平。

不同小写字母表示处理间差异显著(P<0.05)。图5—7同。 Different lowercase letters indicate significant differences between treatments at P<0.05. The same as Fig.5—7.

A.昼夜表达规律;B.不同叶期表达规律。 A. Diurnal expression pattern;B. Expression pattern at different leaf stages.
2.4 光周期和温度对SiPRR73基因表达的调控作用
温度对SiPRR73基因表达峰的数目有明显影响,在高温(27 ℃)条件下的光照期SiPRR73出现2个表达峰,而在低温(22 ℃)条件下的光照期只出现1个表达峰,光周期的改变并不影响高、低温间表达峰数目的差异;光周期控制SiPRR73表达峰出现的早晚,温度的改变并不影响SiPRR73在短日照条件下的表达峰比长日照下提前的特点。此外,SiPRR73表现出一定光诱导表达特性,黑暗期表达水平相对较低(图6)。
2.5 非生物胁迫条件下SiPRR73基因的表达模式
NaCl处理1 h内SiPRR73基因受诱导表达,随后的时间除了8 h诱导表达,其余时间点基因表达均处于抑制状态(图7-A)。SiPRR73基因在ABA处理1,8 h受诱导表达,其余时间点表达基本处于抑制状态(图7-B)。PEG模拟干旱胁迫除了胁迫0.5,24 hSiPRR73表达受到抑制,其余时间点均处于诱导表达状态,特别是处理8,12 h,基因表达最强(图7-C)。SiPRR73在低温(15 ℃)处理24 h内均受诱导表达,4,8 h表达最强,说明SiPRR73在应对低温胁迫中可能发挥功能(图7-D)。在EDTA-Fe 处理下,SiPRR73在早期(2 h内)表达受到抑制,4~18 h均处于诱导表达状态,24 h表达再次受到抑制,推测其在铁胁迫过程中发挥特定作用(图7-E)。5种非生物胁迫中,PEG和低温总体上诱导SiPRR73表达,而NaCl在胁迫早期诱导基因表达,后期总体表现为抑制状态,Fe胁迫则早期抑制基因表达,后期总体诱导基因表达。SiPRR73对ABA胁迫的响应特点接近NaCl,主要差异在于胁迫0.5 h NaCl诱导基因表达而ABA抑制基因表达。

图6 光温互作对SiPRR73基因昼夜表达模式的影响Fig.6 The effect of photo-thermal interaction on diurnal expression pattern of SiPRR73

图7 非生物胁迫条件下SiPRR73基因的表达模式Fig.7 Expression pattern of SiPRR73 under abiotic stress conditions
3 结论与讨论
通过对拟南芥、水稻、高粱、玉米4种植物CCT结构域基因进化分析,发现水稻OsPRR73基因划分到第4组,该组包括拟南芥2号、5号染色体上的一些CCT结构域基因[35]。本研究发现,谷子SiPRR73与水稻、玉米、小麦、高粱等禾本科家族PRR73基因聚为1组,但在组内又分为3个亚组,谷子与玉米、糜子、高粱等C4作物PRR73基因聚为1个亚组,水稻、小麦PRR73基因分别聚为另外2个亚组。组织特异性表达分析发现,谷子SiPRR73和玉米ZmPRR73、水稻OsPRR73一样,均在叶片中的表达量最高,受光调控,而小麦TaPRR73基因则在根部表达量较高,说明PRR73基因在禾本科家族内部进化过程中功能发生了分化[4-5,36]。谷子SiPRR73在长、短日照条件下的昼夜表达模式与水稻OsPRR73、小麦TaPRR73相似,即在温度不变的情况下,长日照有2个表达峰,短日照有1个表达峰,与玉米ZmPRR73长短日照下均只有1个表达峰存在差异[4-5,37],说明尽管同为C4作物,谷子和玉米PRR73基因对光周期的响应模式存在一定差异。温度是光周期外影响植物生长的另一个重要环境因子,二者存在复杂的互作效应。对拟南芥的研究发现,提高温度能抵消短日照对开花的抑制作用[38];而大麦和大豆都是在诱导开花的光周期条件下高温促进开花,抑制开花的光周期条件下高温抑制开花[39-42]。谷子光温互作模式与大豆相似,短日照和高温对抽穗具有正向作用,长日照和高温对抽穗具有负向效应[34]。本研究发现,光周期和温度均对SiPRR73的表达模式产生了影响,但影响方式不同,光周期主要影响了基因表达峰出现时间的早晚,温度主要影响了表达峰的数目,而这种影响会导致基因功能发生改变,从而影响谷子抽穗开花,这表明SiPRR73可能参与谷子对不同光周期和温度环境的适应性调节过程。
PRRs家族基因与植物对非生物胁迫的抵御也有密切关系[43]。CBF与拟南芥对低温胁迫的抵御能力有关,PRR9通过调节CBF的表达参与抵御低温胁迫[44-45]。本研究发现,低温(15 ℃)胁迫的整个过程SiPRR73基因呈现强诱导表达模式,说明该基因可能参与谷子对低温胁迫的抵抗作用。PRRs家族基因与ABA调控基因有部分重叠,ABAR、ABI3通过ABA调控表达参与植物抗逆性,这些基因也受PRRs家族基因TOC1的负向调节,同时对TOC1有反向调节作用,通过这种调节环的方式参与ABA信号传导[46]。SiPRR73基因表达明显受到ABA调节,且在ABA处理不同时间表达模式不同,表明SiPRR73可能参与ABA介导的信号传递途径。拟南芥PRR5基因参与盐胁迫调节[47],本研究发现,SiPRR73对NaCl胁迫的响应特点接近ABA,因此可能与盐胁迫应答有关。水稻OsPRR73的表达受到干旱抑制[2],而本研究发现,谷子SiPRR73基因明显被PEG模拟的干旱胁迫所诱导,说明水稻与谷子PRR73基因存在不同的干旱胁迫应对机制。植物铁蛋白具有储铁功能,可以缓解铁过量,拟南芥PRR7抑制铁蛋白基因的表达,与铁胁迫应答有关[20,24]。本研究发现,铁胁迫初期SiPRR73基因的表达受到抑制,说明铁胁迫需要大量铁蛋白发挥储铁功能,胁迫信号传递给SiPRR73基因,使其表达减弱,有利于铁蛋白基因的表达,而后期SiPRR73表达增强说明随着胁迫减弱,铁蛋白需求减少,SiPRR73开始抑制基因表达,因此,推测SiPRR73和拟南芥PRR7一样,参与了作物抵御铁胁迫。
本研究首次克隆得到谷子SiPRR73基因包含完整编码区的cDNA序列,该基因CDS长度2 283 bp,编码760个氨基酸;SiPRR73基因在谷子次顶叶表达水平最高,受光诱导和光周期调控;光周期和温度共同调节SiPRR73基因表达,通过改变表达峰出现时间、表达峰数目影响基因表达模式,从而可能参与了谷子对不同光温环境的适应性调节;SiPRR73基因也参与了谷子对盐胁迫、低温胁迫、ABA胁迫、干旱胁迫和铁胁迫的应答反应。

