基于LncRNA MIAT/miR-384-5p研究九龙藤黄酮抑制自噬抗心肌缺氧损伤的作用机制
苏文晓,卢 珺,甘晓雯,陈卉彬,简 洁
• 药理与临床 •
基于/研究九龙藤黄酮抑制自噬抗心肌缺氧损伤的作用机制
苏文晓,卢 珺,甘晓雯,陈卉彬,简 洁*
广西糖尿病系统医学重点实验室,广西 桂林 541199
基于长链非编码RNA(long non coding RNA,LncRNA)心肌梗死相关转录本(myocardial infarction associated transcript,)/探讨九龙藤黄酮(flavones,BCF)抑制自噬抗心肌缺氧损伤的作用及机制。培养H9c2心肌细胞及敲低稳转株,建立心肌细胞氧糖剥夺(oxygen-glucose deprivation,OGD)模型模拟心肌缺血缺氧,给予BCF预处理;选取SD雄性大鼠,沉默基因,建立急性心肌梗死(acute myocardial infarction,AMI)模型,给予BCF预处理。以qRT-PCR法检测、及自噬相关基因表达;采用双荧光素酶报告基因实验及RNA反义纯化(RNA antisense purification,RAP)实验验证与的靶向关系;采用ELISA法检测细胞上清液及大鼠血清中肌钙蛋白-I(cardiac troponin-I,cTn-Ⅰ)水平;采用CCK-8法检测细胞活力;采用透射电镜观察自噬小体数量;以自噬双标腺病毒Ad-mRFP-GFP-LC3感染细胞检测自噬流;采用TTC染色法检测大鼠心肌梗死面积;采用Western blotting法检测自噬相关蛋白表达。与OGD组比较,BCF能够下调并上调基因表达(<0.05、0.01),提高心肌细胞活力(<0.01),降低cTn-I水平(<0.001),下调、、基因及蛋白表达(<0.05、0.01),减少自噬小体数量(<0.01),减轻自噬流(<0.01)。双荧光素酶报告基因及RAP实验结果显示,靶向负调控表达。敲低可抑制自噬,减轻心肌缺氧损伤;与单纯BCF预处理相比,敲低可显著增强BCF抑制自噬和保护心肌的作用(<0.05、0.01、0.001)。与AMI+BCF组比较,沉默后给予BCF处理,大鼠心肌梗死面积显著增加(<0.01),血清中cTn-I水平显著升高(<0.01),心脏组织中自噬相关基因及蛋白表达均显著上调(<0.01),心肌缺血损伤加重。BCF通过/抑制自噬,从而减轻心肌缺氧损伤。
九龙藤黄酮;;;心肌缺氧损伤;自噬
急性心肌梗死(acute myocardial infarction,AMI)以心肌缺血和缺氧为特征,其发病率和死亡率高,严重危害人类健康[1]。诱发心肌缺血损伤的因素有多种,包括氧化应激、钙超载、炎症反应、凋亡、自噬和坏死等,其中自噬在心肌缺血的发生发展中起重要作用。自噬是长寿蛋白和胞质细胞器降解和再循环的重要过程[2],在心肌细胞缺血缺氧时抑制自噬有利于心肌细胞的存活,并减轻心肌损伤[3]。
九龙藤黄酮(flavones,BCF)是广西民族特色草药九龙藤(Benth.) Benth.的主要活性成分,本课题组前期研究表明,BCF具有抗炎、抗氧化的作用,能够通过激活磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路,抑制细胞凋亡及过度自噬,抗心肌缺氧损伤[4-6];细胞实验发现上调能增强BCF抑制自噬的作用[4],但在整体动物水平,对BCF的作用尚不明确。
研究表明,长链非编码RNA(long non coding RNA,LncRNA)能够发挥微小RNA(microRNA,miRNA)海绵作用,竞争性结合miRNA的反应元件,进而对其靶基因进行负向调控[7]。心肌梗死相关转录本(myocardial infarction associated transcript,)参与了心肌梗死、动脉粥样硬化等多种疾病过程[8],如结合部分增强心肌肥厚,结合抗动脉粥样硬化[9-10],但参与心肌梗死的分子机制仍有待深入研究。能否通过“分子海绵吸附”作用结合影响自噬,参与心肌缺血损伤尚无相关报道,其对BCF的心肌保护作用也未阐明。本研究基于/信号轴探究BCF对心肌缺氧损伤的作用及机制,为临床治疗心肌缺血损伤提供实验依据。
1 材料
1.1 细胞
大鼠心肌H9c2细胞购自上海中科院细胞库,敲低基因及空载对照的H9c2稳转细胞株购自武汉金凯瑞生物工程有限公司。
1.2 动物
SPF级雄性SD大鼠,体质量220~240 g,7周龄,购自湖南斯莱克景达动物有限公司,许可证号SCKX(湘)2019-0004。动物于温度(24±2)℃、相对湿度(50±10)%、12 h光照/黑暗交替的环境下适应性饲养7 d,自由进食饮水。动物实验经桂林医学院动物伦理委员会批准(批准号GLMC201703031)。
1.3 药品与试剂
BCF由本课题组分离纯化,总黄酮质量分数以芦丁计为82%[11];胎牛血清(批号SN201909)、高糖及无糖DMEM(批号8121382)购自Gibco公司;mRFP-GFP-LC3腺病毒(批号133F082)、CCK-8试剂盒(批号20210323)购自Hanbio Biotechnology;引物购自武汉金凯瑞生物工程有限公司;电镜固定液(批号20210911)、TTC染色液(批号415F031)购自北京索莱宝科技有限公司;TRNzol Universal Reagent(批号W9830)、TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix(批号O11208)、PerfectStart Green qPCR SuperMix(批号P30726)购自上海全式金生物有限公司;Luciferase Reporter Assay Kit(批号E2920)、pmirGLO载体(批号E1330)购自购自美国Promega公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号60004-1-Ig)购自Proteintech Group;组织蛋白酶D(Cathepsin D)抗体(批号DF6486)购自Affinity Biosciences;微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)抗体(批号ab192890)、Beclin1抗体(批号ab207612)、p62抗体(批号ab12484)、HRP标记的山羊抗兔IgG抗体(批号ab6721)购自英国Abcam公司;过表达质粒、antagomir和空载pcDNA由上海吉凯基因医学科技股份有限公司合成;大鼠肌钙蛋白-I(cardiac troponin-I,cTn-Ⅰ)ELISA试剂盒(批号20210415)购自美国Elabscience公司。
1.4 仪器
CCL-170B-8型CO2培养箱(ESCO公司);LAI3T型厌氧培养箱(上海龙跃仪器设备有限公司);荧光显微镜、ELx800型酶标仪(美国Bio Tek公司);NanoDrop One型超微量核酸蛋白测定仪(美国Thermo Fisher Scientific公司);MyGo Pro型小型荧光定量PCR仪(英国IT-IS公司);化学发光成像系统(Gene公司);JEM1200EX型钨灯丝透射电子显微镜(TEM,日本JEOL公司);SAR-1000型小动物呼吸机(美国CEW公司)。
2 方法
2.1 细胞实验
2.1.1 转染及稳转株筛选 常规复苏H9c2细胞,接种至24孔板中。配制1 mg/mL的嘌呤霉素母液,用完全培养基分别稀释至0.1、0.4、0.8、1.0、1.4、1.8、2.0 μg/mL,加入24孔板中,放入培养箱中培养,观察细胞生长状况,后续以2.0 μg/mL的嘌呤霉素筛选稳转株。
取出敲低基因的慢病毒液,冰浴融化待用。将病毒液用培养基稀释,以1×107/孔加入24孔板中,病毒感染6 h后,更换成2 mL完全培养基。继续培养48 h后,将完全培养基更换为含2.0 μg/mL嘌呤霉素的完全培养基(即筛选培养基),每2天更换1次筛选培养基,继续培养,每日观察。15 d后收集细胞,采用qRT-PCR检测目的基因表达。稳定细胞株冻存,得到敲低基因的稳转株细胞,同时设置未感染对照细胞(negative control,sh-NC)。
2.1.2 细胞培养与模型建立 H9c2细胞和敲低及空载对照的稳转株细胞用含10%胎牛血清、1%青霉素-链霉素的高糖DMEM培养基,于37 ℃、5% CO2的培养箱中培养。待细胞融合度达到80%时,将含血清的高糖DMEM换为不含血清的无糖DMEM培养基,放入5% CO2、1% O2、94% N2的厌氧箱中培养24 h,建立氧糖剥夺(oxygen and glucose deprivation,OGD)模型[12]。
2.1.3 分组与给药 设置对照组、OGD(模型)组、sh-NC组、sh-MIAT组、BCF组、BCF+sh-NC组和BCF+sh-MIAT组,每组设5个复孔。对照组、OGD组及BCF组为H9c2细胞,其余组使用稳转株细胞。实验时根据分组同时培养H9c2细胞和敲低及空载对照的稳转株细胞。除对照组外,其余各组按“2.1.2”项下方法造模,各给药组造模前加入BCF(6 μg/mL)预孵育4 h,造模时各给药组培养基换成含有BCF的无糖无血清DMEM培养基。
2.1.4 qRT-PCR法检测、和自噬相关基因表达 取造模后各组细胞,按照试剂盒说明书提取细胞总RNA并合成cDNA,进行qRT-PCR分析。引物序列见表1,将作为内参,将作为其他基因内参。
2.1.5 双荧光素酶报告基因和RNA反义纯化(RNA antisense purification,RAP)实验验证和的靶向关系
(1)双荧光素酶报告基因实验检测和结合关系:分别构建含野生型和突变型3’-UTR的荧光素酶报告基因质粒,质粒同共转染,以PBS清洗2次,加入Passive Lysis Buffer裂解后离心,吸取上清液至黑色96孔板中,按照试剂盒说明书检测萤火虫荧光素和海肾荧光素的荧光强度。
表1 引物序列
Table 1 Primer sequences
基因序列 (5’-3’) LC3F: ACCCTCTACGATGCTGGTGAR: GCTGTCCTCAATGTCCTTCTG LncRNA MIATF: AGGTCAGGCAGAGGAAGTCAR: CTCCCGATACAACAATCACG Beclin1F: GCCTCTGAAACTGGACACGR: CCTCTTCCTCCTGGCTCTCT GAPDHF: GACATGCCGCCTGGAGAAACR: AGCCCAGGATGCCCTTTAGT U6F: CAAATTCGTGAAGCGTTR: TGGTGTCGTGGAGTCG miR-384-5pF: CTCAACTGGTGTCGTGGAGTR: ACACTCCAGCTGGGTGTAAA Cathepsin DF: CCGCAGTGTCACAGTCGTR: CGTGCCGTCTTCACATAGG
(2)RAP实验检测和结合关系:取2×107个H9c2细胞,去除培养基后用PBS洗涤1次,进行紫外交联,交联后DNA超声破碎。将生物素化的反义探针加入到LncRNA-RAP系统中,探针在65 ℃变性10 min,室温杂交2 h,然后加入200 µL链霉亲和素包被的磁珠,提取RNA后荧光定量验证与间的相互作用。
2.1.6 CCK-8法检测细胞活力 H9c2细胞以8×103个/孔接种于96孔板,培养24 h。按“2.1.2”项下方法进行分组和处理,造模结束后每孔加入10 μL CCK-8溶液,孵育3 h,采用酶标仪测定450 nm处的吸光度()值。
2.1.7 ELISA法检测cTn-I水平 取造模后各组细胞上清液,按试剂盒说明书测定上清液cTn-I水平。
2.1.8 TEM观察自噬小体数量 取造模后各组细胞,4 ℃、1000 r/min离心5 min,吸除上清液,加入PBS重悬10 min,离心后吸除上清液,加入电镜固定液后重悬,4 ℃固定过夜,将样品装载在200目铜网上,用TEM观察自噬小体产生情况。
2.1.9 自噬双标腺病毒(Ad-mRFP-GFP-LC3)感染H9c2细胞检测自噬流 H9c2细胞以5×104个/孔接种于24孔板,板中预先铺被细胞爬片,培养24 h。每孔加入5 μL腺病毒培养6 h,换液,继续培养12 h后建立OGD模型。造模结束,取出24孔板,PBS洗涤2次,加入组织固定液固定10 min,以DAPI染色后取出细胞爬片,倒扣在滴加抗荧光淬灭剂的载玻片上,于荧光显微镜下观察。
2.1.10 Western blotting法检测自噬相关蛋白表达 取造模后各组细胞,加入裂解液裂解细胞,4 ℃、12 000 r/min离心15 min,取上清液,采用BCA蛋白定量试剂盒测定蛋白质量浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,于5%牛血清白蛋白中封闭2 h,TBST洗涤3次,分别加入Beclin1、Cathepsin D、LC3、p62抗体(1∶5000),4 ℃孵育过夜;TBST洗涤3次,加入二抗孵育1 h,洗膜后采用凝胶成像系统拍照。
2.2 动物实验
2.2.1 敲低对大鼠心脏基因表达的影响 大鼠随机分为对照组、AMI(模型)组、AMI+si-NC组及AMI+si-MIAT组,每组5只。按文献方法[6]开胸后用6-0带线缝合针结扎冠状动脉前左降支,建立AMI模型,缺血24 h。在大鼠左心房注射10 μL si-MIAT或si-NC(滴度为1×108T),取各组大鼠心肌组织,按“2.1.4”项下方法检测基因表达。
2.2.2 沉默基因表达逆转BCF的抗心肌缺血损伤作用 动物随机分为sh miRNA-384-5p组、AMI+sh miRNA-384-5p组、AMI+BCF组和AMI+BCF+sh miRNA-384-5p组,每组5只。通过在体转染技术[9]在大鼠左心室注射10 μL抑制剂(滴度为1×108T),转染24 h。按文献方法[6]建立AMI模型,缺血24 h。术前30 min舌下静脉给予BCF(20 mg/kg)预处理。造模结束后,取血,放入4 ℃冰箱过夜后,4 ℃、10 000 r/min离心20 min,收集血清,按“2.1.7”项下方法测定血清中cTn-I水平;迅速取出大鼠心脏,切成2 mm薄片,加入1% TTC溶液避光孵育20 min,染色后用4%多聚甲醛固定过夜,于显微镜下观察心肌梗死情况;取心脏组织,按“2.1.4”项下方法检测自噬相关基因表达,按“2.1.10”项下方法检测自噬相关蛋白表达。
2.3 统计学分析
应用SPSS 25.0统计软件对数据进行分析,计量资料以表示,检验法用于两组之间比较,单因素方差分析法用于多组间比较。
3 结果
3.1 BCF下调LncRNA MIAT并上调miR-384-5p基因表达
如图1所示,与对照组比较,OGD组细胞中基因表达显著上调(<0.01),基因表达显著下调(<0.01);与OGD组比较,BCF组细胞中基因表达显著下调(<0.01),基因表达显著上调(<0.05)。
3.2 LncRNA MIAT靶向调控miR-384-5p
双荧光素酶报告基因实验结果显示(图2),共转和-WT后荧光素酶活性显著降低(<0.001),说明与互作。RAP实验进一步验证两者的作用关系(图2-C),被探针富集,表明与存在相互作用。如图2-D、E所示,与sh-NC组比较,敲低后基因表达降低(<0.001),而基因表达升高(<0.05)。上述结果表明是的靶基因,并受到的负调控。

与对照组比较:**P<0.01;与OGD组比较:#P<0.05 ##P<0.01

A-LncRNA MIAT和miR-384-5p的潜在结合序列 B-双荧光素酶报告基因实验验证LncRNA MIAT和miR-384-5p的靶向关系 C-RAP实验验证LncRNA MIAT和miR-384-5p的靶向关系 D-qRT-PCR检测敲低LncRNA MIAT后LncRNA MIAT基因表达 E-qRT-PCR检测敲低LncRNA MIAT后miR-384-5p基因表达 与pcDNA3.1+MIAT-WT组比较:***P<0.001;与sh-NC组比较:#P<0.05 ###P<0.001
3.3 敲低LncRNA MIAT抑制自噬减轻心肌缺氧损伤
如图3-A、B所示,与对照组比较,OGD组细胞存活率显著降低(<0.001),心肌缺血损伤标志物cTn-I水平显著升高(<0.001);敲低能够提高H9c2细胞存活率(<0.01),降低cTn-I水平(<0.01),提示下调能减轻OGD诱导的心肌缺氧损伤。
进一步验证对OGD诱导的H9c2细胞自噬的影响,如图3-C~E所示,与对照组比较,OGD组自噬小体及自噬溶酶体数量增多(<0.01),Beclin1蛋白表达水平及LC3-Ⅱ/LC3-I值升高(<0.001),p62蛋白表达水平降低(<0.001);与sh-NC组比较,敲低后自噬小体及自噬溶酶体数量减少(<0.01),Beclin1蛋白表达水平及LC3-Ⅱ/LC3-I值降低(<0.01、0.001),p62蛋白表达水平升高(<0.001),表明敲低能抑制OGD诱导的心肌细胞自噬。

A-敲低LncRNA MIAT对H9c2细胞存活率的影响 B-敲低LncRNA MIAT对H9c2细胞上清液中cTn-I水平的影响 C-敲低LncRNA MIAT对自噬流的影响 D-敲低LncRNA MIAT对自噬相关蛋白表达的影响 E-敲低LncRNA MIAT对自噬小体产生的影响(箭头为自噬小体) 与对照组比较:**P<0.01 ***P<0.001;与sh-NC组比较:##P<0.01 ###P<0.001
3.4 BCF对OGD诱导的H9c2细胞存活率和上清液中cTn-I水平的影响
如图4所示,与OGD组比较,BCF组细胞存活率显著升高(<0.01),上清液中cTn-I水平显著降低(<0.001);敲低可增强BCF的作用(<0.01、0.001)。
3.5 BCF对OGD诱导的H9c2细胞自噬小体的影响
如图5所示,与OGD组比较,BCF组自噬小体数量显著减少(<0.01);敲低可增强BCF的作用(<0.01)。
3.6 BCF对OGD诱导的H9c2细胞自噬相关基因及蛋白表达的影响
如图6所示,与OGD组比较,BCF组细胞中、及基因表达水平均显著降低(<0.05、0.01),Beclin1和Cathepsin D蛋白表达水平均显著降低(<0.01),LC3-Ⅱ/LC3-I值显著降低(<0.01);敲低可增强BCF对OGD诱导的H9c2细胞自噬的抑制作用(<0.05、0.01)。
3.7 BCF对OGD诱导的H9c2细胞自噬流的影响
如图7所示,与OGD组比较,BCF组细胞中自噬体和自噬溶酶体数量均显著减少(<0.01);敲低后自噬体和自噬溶酶体数量进一步减少(<0.05),表明BCF通过下调抑制自噬体和自噬溶酶体的形成,从而阻滞自噬流。

与对照组比较:*P<0.05 **P<0.01 ***P<0.001;与OGD组比较:#P<0.05 ##P<0.01 ###P<0.001;与BCF+sh-NC组相比:∆P<0.05 ∆∆P<0.01 ∆∆∆P<0.001,图5~7同
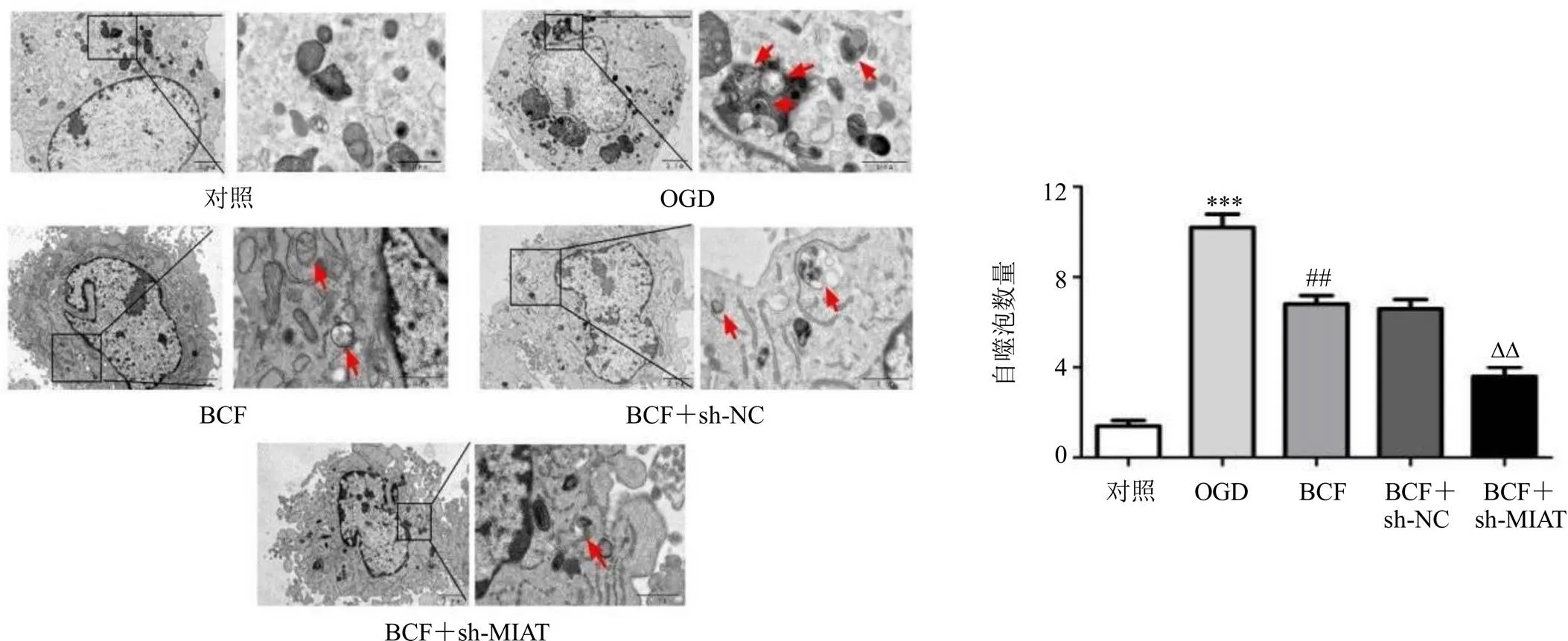
箭头所示为自噬小体

图6 BCF对OGD诱导的H9c2细胞自噬相关基因(A) 及蛋白表达(B) 的影响(, n = 5)

图7 BCF对OGD诱导的H9c2细胞自噬流的影响(, n = 3)
3.8 敲低LncRNA MIAT对大鼠心脏miR-384-5p基因表达的影响
如图8所示,与对照组比较,AMI组大鼠心脏中基因表达显著下调(<0.001);敲低显著增加心脏中基因表达(<0.05)。
3.9 沉默miR-384-5p基因表达逆转BCF的抗心肌缺血损伤作用
如图9所示,与AMI+BCF组比较,沉默后给予BCF处理,大鼠心肌梗死面积增加,梗死率显著升高(<0.01);血清中cTn-I水平显著升高(<0.01),心脏组织中自噬相关基因及蛋白表达均显著上调(<0.01),心肌缺血损伤加重。

与对照组比较:***P<0.001;与AMI+si-NC组相比:△P<0.05

A-各组大鼠心肌梗死面积(黑色箭头为心肌梗死区) B-各组大鼠血清中cTn-I水平 C-各组大鼠心脏组织中自噬相关基因表达 D-各组大鼠心脏组织中自噬相关蛋白表达 与sh miRNA-384-5p组比较:##P<0.01;与AMI+BCF组比较:**P<0.01
4 讨论
AMI是一种严重的致命性疾病,由冠状动脉阻塞引起的心肌缺血损伤是造成患者死亡的原因之一[13]。目前,临床治疗AMI的主要方法为经皮冠状动脉介入(percutaneous coronary intervention,PCI),PCI能够较快且安全地恢复血流再灌注,但其发病血管仍有急性再闭塞的可能性[14]。一些活血化瘀中药具有防治心血管疾病的作用,深入研究其作用机制,有望为开发防治AMI的药物提供依据。
自噬在AMI中的发生机制、调控因素及药物干预为近年研究热点[2]。自噬是一个动态的过程,包括自噬体形成(一般以Beclin1、LC3II为标志)、自噬体与溶酶体融合(一般以Cathepsin D为标志)和自噬体的降解(一般以p62作为标志)3个连续的步骤。细胞在正常情况下很少发生自噬,而内质网应激、缺血缺氧等常诱导自噬[3]。九龙藤是一种传统的中草药和功能性食品,性平低毒,BCF是其茎提取物的主要活性成分,研究发现BCF可抗氧化、抑制细胞凋亡和自噬、减轻心肌缺血缺氧损伤[5-6],但其具体的分子机制尚不清楚。本课题组前期研究表明负调控Beclin1表达抑制自噬,过表达可增强BCF的心肌保护作用[4]。本研究亦发现ODG诱导的H9c2细胞给予BCF预处理后,基因表达上调,提示可能参与了BCF抑制自噬的作用。
以双荧光素酶报告基因实验和RAP实验探析的上游靶点,结果显示,负靶向调控。作为AMI的危险等位基因,在AMI患者和小鼠血浆中高表达[15-16],但在OGD诱导的H9c2细胞中的作用尚未见报道。本研究发现,OGD诱导的H9c2细胞中表达上调,敲低可提高心肌细胞活力、降低cTn-I水平、减少自噬小体和自噬溶酶体数量、降低Beclin1蛋白表达及LC3-Ⅱ/LC3-I值、增加p62蛋白表达、抑制心肌缺氧损伤。为进一步验证BCF是否通过影响发挥心肌保护作用,在敲低基因的心肌细胞稳转株中给予BCF预处理,结果显示,与单纯BCF预处理相比,合并敲低后,BCF抑制自噬和减轻心肌缺氧损伤的作用显著增强,说明可能是BCF发挥心肌保护作用的重要靶点。
为进一步验证对BCF作用的影响,构建AMI动物模型,并通过在体转染方式,沉默大鼠基因表达。结果显示,沉默逆转了BCF抑制自噬的作用,加重了大鼠心肌缺血损伤,提示BCF抗心肌缺血损伤作用可能与上调基因表达有关。
综上所述,本研究发现BCF通过/抑制自噬减轻心肌缺氧损伤(图10)。由于全长序列为8474 bp,序列太长,过表达后极有可能造成细胞死亡,因此本研究未对过表达情况进行分析。后续将进一步在体内验证BCF下调抑制自噬减轻心肌缺血损伤的作用。

机制图在BioRender网站绘制
利益冲突 所有作者均声明不存在利益冲突
[1] Su Q, Liu Y, Lv X W,. Inhibition of lncRNA TUG1 upregulatesto ameliorate myocardial injury during ischemia and reperfusion via targeting HMGB1- and Rac1-induced autophagy [J]., 2019, 133: 12-25.
[2] Liu C Y, Zhang Y H, Li R B,. LncRNA CAIF inhibits autophagy and attenuates myocardial infarction by blocking p53-mediated myocardin transcription [J]., 2018, 9(1): 29.
[3] Zhang C, Liang R G, Gan X W,./beclin-1 as potential indicators for epigallocatechin gallate against cardiomyocytes ischemia reperfusion injury by inhibiting autophagy via PI3K/Akt pathway [J]., 2019, 13: 3607-3623.
[4] 杨秀芳. 基于/Beclin 1信号轴探讨九龙藤总黄酮抑制自噬抗心肌缺血损伤的作用 [D]. 桂林: 桂林医学院, 2020.
[5] 方瑜. 九龙藤总黄酮对垂体后叶素致大鼠急性心肌缺血的保护作用及机制研究 [D]. 桂林: 桂林医学院, 2014.
[6] 禤霏霏. 九龙藤总黄酮对心肌缺血再灌注损伤大鼠PI3K/Akt信号通路的调控作用及机制研究 [D]. 南宁: 广西医科大学, 2016.
[7] Long Y, Wang L, Li Z. SP1-induced SNHG14 aggravates hypertrophic response inmodel of cardiac hypertrophy via up-regulation of PCDH17 [J]., 2020, 24(13): 7115-7126.
[8] Ye Z M, Yang S, Xia Y P,. LncRNA MIAT spongesto inhibit efferocytosis in advanced atherosclerosis through CD47 upregulation [J]., 2019, 10(2): 138.
[9] Zeng Z C, Pan Y, Wu W,. Myocardial hypertrophy is improved with berberine treatment via long non-coding RNA MIAT-mediated autophagy [J]., 2019, 71(12): 1822-1831.
[10] Tian S G, Yuan Y, Li Z,. LncRNA UCA1 spongesto regulate the migration and proliferation of vascular smooth muscle cells [J]., 2018, 673: 159-166.
[11] Xuan F F, Jian J, Qin F Z,.flavone inhibits apoptosis and autophagy via the PI3K/Akt pathway in myocardial ischemia/reperfusion injury in rats [J]., 2015, 9: 5933-5945.
[12] 齐献忠, 邢英瀛, 张小林, 等. 葛根素通过circ-TLK1//TLR4抑制SK-N-SH细胞氧糖剥夺损伤 [J]. 中草药, 2021, 52(11): 3286-3295.
[13] Mao Q, Liang X L, Zhang C L,. LncRNA KLF3-AS1 in human mesenchymal stem cell-derived exosomes ameliorates pyroptosis of cardiomyocytes and myocardial infarction through/Sirt1 axis [J]., 2019, 10(1): 393.
[14] Giannini F, Candilio L, Mitomo S,. A practical approach to the management of complications during percutaneous coronary intervention [J]., 2018, 11(18): 1797-1810.
[15] Azat M, Huojiahemaiti X, Gao R R,. Long noncoding RNA MIAT: A potential role in the diagnosis and mediation of acute myocardial infarction [J]., 2019, 20(6): 5216-5222.
[16] Zhou J, Zhou Y, Wang C X.regulates fibrosis in hypertrophic cardiomyopathy (HCM) by mediating the expression of[J]., 2018, 11: 7265-7275.
Anti-myocardial hypoxia injury effect offlavones by inhibiting autophagy based on/
SU Wen-xiao, LU Jun, GAN Xiao-wen, CHEN Hui-bin, JIAN Jie
Guangxi Key Laboratory of Diabetic Systems Medicine, Guilin 541199, China
To investigate the effect offlavones(BCF) on myocardial hypoxia injury by inhibiting autophagy based on long non-coding RNA (LncRNA) myocardial infarction associated transcript ()/.H9c2 cardiomyocytes and stableknockdown strain were cultured, and cardiomyocyte oxygen-glucose deprivation (OGD) model was established to simulate myocardial ischemia and hypoxia, cells were pretreated with BCF. Male SD rats were selected to establish acute myocardial infarction (AMI) model by silencinggene expression, and were pretreated with BCF. qRT-PCR was used to detect the expressions of,and autophagy-related genes; Dual luciferase reporter gene experiment and RNA antisense purification (RAP) experiment were used to verify thatandtargeting relationship; ELISA method was used to detect cardiac troponin-I (cTn-I) levels in supernatant of cells and serum of rats; CCK-8 method was used to detect cell viability; Transmission electron microscopy (TEM) was used to observe the number of phagosomes; Autophagy flux was detected by infecting cells with autophagy double-labeled adenovirus Ad-mRFP-GFP-LC3; Myocardial infarction size was detected by TTC staining; Expressions of autophagy-related proteins was detected by Western blotting.Compared with OGD group, BCF down-regulatedand up-regulatedgene expressions (< 0.05, 0.01), increased myocardial cells viability (< 0.01), decreased cTn-I level (< 0.001), down-regulated,,gene and protein expressions (< 0.05, 0.01), decreased the number of autophagosomes (< 0.01), and reduced autophagic flux (< 0.01). The results of dual-luciferase reporter gene and RAP assay showed thattargeted and negatively regulated the expression of. Knockdown ofcould inhibit autophagy and alleviate myocardial hypoxia injury; Compared with BCF pretreatment, knockdown ofsignificantly enhanced the effect of BCF on autophagy inhibition and myocardial protection (< 0.05, 0.01, 0.001). Compared with AMI + BCF group, after silencingand then giving BCF treatment, myocardial infarction area of rats was significantly increased (< 0.01), cTn-I level in serum was significantly increased (< 0.01), autophagy-related gene and protein expressions in cardiac tissue were significantly up-regulated (< 0.01), and myocardial ischemia injury was aggravated.BCF alleviates myocardial hypoxic injury by inhibits autophagy through LncRNA MIAT/miR-384-5p.
flavones;;; myocardial hypoxia injury; autophagy
R285.5
A
0253 - 2670(2022)18 - 5701 - 11
10.7501/j.issn.0253-2670.2022.18.013
2022-03-03
国家自然科学基金资助项目(81760726);国家自然科学基金资助项目(82060659)
苏文晓,女,在读硕士研究生,研究方向为心肌缺血损伤的药物干预及分子机制。E-mail: 1063013501@qq.com
简 洁,女,博士,教授,硕士生导师,研究方向为心肌缺血损伤的药物干预及分子机制。E-mail: 251181281@qq.com
[责任编辑 李亚楠]

