番茄黄化曲叶病毒与番茄褪绿病毒复合侵染对番茄黄化曲叶病毒传播的影响
罗瑞雪, 赵 丹, 潘求一, 曾 颖, 张战泓,史晓斌, 张德咏, 史彩华, 刘 勇*
(1. 长江大学农学院, 荆州 434000; 2. 湖南省农业科学院植物保护研究所, 长沙 410125;3. 双峰县农业农村局, 娄底 417700; 4. 安乡县植保植检站, 常德 415600;5. 湖南省农业科学院蔬菜研究所, 长沙 410125)
番茄黄化曲叶病毒(tomato yellow leaf curl virus, TYLCV),隶属于双生病毒科Geminiviridae,菜豆金色花叶病毒属Begomovirus[1],具有单链(ss)环状DNA基因组[2-3],大小约2.8 kb。TYLCV于1964年在以色列被首次报道[4],随后在全球各地迅速传播,中国于2006年在上海被首次报道[1]。TYLCV由烟粉虱Bemisiatabaci以持久性方式传播[5],在田间造成的损失高达80%~100%[6]。感染TYLCV后,植株发育迟缓并向上卷曲、黄化,植株叶片会变少、变小[7-8]。番茄褪绿病毒(tomato chlorosis virus, ToCV)隶属于长线形病毒科Closteroviridae,毛形病毒属Crinivirus,于20世纪90年代中期在美国佛罗里达州被首次报道,中国于2004年在台湾被首次报道[10],迄今已在35个国家和地区发生[9]。ToCV是由烟粉虱传播的半持久性RNA病毒。带毒烟粉虱取食健康植株后,可造成植株100%的发病率[9]。与大多数植物病毒不同,感染ToCV的植株表现为老叶先发病,叶脉间黄化褪绿、变厚变脆且边缘向内卷曲[7-8],一般要3~4周才表现症状[7-8]。
TYLCV与ToCV复合侵染自2013年在山东寿光被首次报道以来,在江苏和云南等地相继被报道,且TYLCV和ToCV的发病率都在逐年上升[11-13]。复合侵染的番茄植株中,TYLCV的带毒量比ToCV高262~436倍[14],且复合侵染会给番茄造成10%以上的减产,严重时甚至绝收[8,15-16]。已有研究表明,植株发生复合侵染时会产生协生作用,发病症状更为严重,加速寄主植物死亡[17-19]。复合侵染还会提高病毒的基因重组概率,导致病毒的侵染能力和扩散速度增加[20-22]。TYLCV和ToCV复合侵染番茄植株后,显著提高烟粉虱获取和传播ToCV的效率[23],但是复合侵染对TYLCV传播的影响,缺乏研究。针对这一问题,本文研究了TYLCV和ToCV复合侵染番茄植株后烟粉虱获取和传播TYLCV效率的变化,以及TYLCV在烟粉虱和番茄体内积累量的变化,并进一步明确了复合侵染是否影响烟粉虱对TYLCV的传播,为研究TYLCV和ToCV复合侵染后二者产生的协生作用及分子机制奠定基础。
1 材料与方法
1.1 试验材料
供试植株:番茄品种为‘钻红美娜’,该品种不抗TYLCV。
供试昆虫:Q型烟粉虱,由中国农业科学院蔬菜花卉研究所张友军研究员馈赠,之后放在45 cm×50 cm×60 cm的养虫笼内,(26±1)℃、RH (70±5)%、光周期L∥D=16 h∥8 h条件下,用健康番茄饲养,定期做生物型的鉴定[24]。
供试菌液:含TYLCV的农杆菌菌液由中国农业科学院植物保护研究所周雪平团队馈赠。
1.2 试验方法
1.2.1番茄中TYLCV的鉴定
用CTAB法提取番茄的总DNA。特异性引物TYLCV-F/TYLCV-R(表1)扩增片段长度为190 bp[23],退火温度为58℃。经验证该引物特异性及扩增效率良好。使用南京诺维赞(Vazyme)生物公司2×TaqPlus Master Mix Ⅱ (Dye Plus)试剂盒,按照说明书步骤进行PCR扩增。PCR产物用1.5%琼脂糖电泳凝胶进行检测,紫外灯下观察并记录结果,将条带正确的PCR产物纯化回收后送生工生物工程(上海)股份有限公司测序,比对序列是否正确。
1.2.2烟粉虱中TYLCV的鉴定
单头烟粉虱DNA的提取:用蛋白酶K和树脂提取单头烟粉虱的DNA,后续鉴定步骤参照1.2.1。用CTAB法提取多头烟粉虱的总DNA,后续鉴定步骤参照1.2.1。
1.2.3番茄和烟粉虱中ToCV的鉴定
用TRIzol法提取番茄或烟粉虱的总RNA后用南京诺维赞(Vazyme)生物公司的cDNA试剂盒,按照说明书合成cDNA。以cDNA为模板,采用特异性引物ToCV-F/ToCV-R(表1)扩增,目的片段长度为439 bp[22],退火温度为60℃,后续步骤参照1.2.1。
1.2.4侵染性克隆与虫传毒株
将TYLCV病毒侵染性克隆接种在含有卡那霉素(50 mg/L)和利福平(50 mg/L)的LB固体培养基上,28℃恒温培养箱中过夜培养。将活化后的农杆菌菌体溶解在去离子水中,浓度为OD600=2。使用1 mL医用注射器,在健康番茄长出3~4片真叶时,将农杆菌菌液注射到番茄茎秆上,每株番茄接种0.5 mL菌液。接种后放置温室内45 cm×50 cm×60 cm的养虫笼中,于(26±1)℃、RH (70±5)%、光周期L∥D=16 h∥8 h条件下培育。15 d后用1.2.1的方法进行检测,将100头健康烟粉虱转移到感染了TYLCV的毒株上饲毒48 h后,取出全部烟粉虱将其转移到健康番茄(3~4片真叶期)上取食48 h,15 d后用1.2.1的方法进行检测。
复合侵染的番茄采自田间,经过PCR以及小RNA测序确定无其他病毒复合侵染,放入温室内45 cm×50 cm×60 cm的养虫笼中,(26±1)℃、RH (70±5)%、光周期L∥D=16 h∥8 h条件下培养。将100头健康烟粉虱放到TYLCV和ToCV复合侵染的病株上取食48 h后,取出全部的烟粉虱将其放到健康番茄(3~4片真叶)上取食48 h,15 d后用1.2.1的方法检测TYLCV,30 d后用1.2.3的方法检测ToCV。选择TYLCV的病毒量一致的复合侵染与单独侵染的番茄进行后续试验。

表1 番茄与烟粉虱带毒情况检测所用引物信息
1.3 番茄黄化曲叶病毒实时荧光定量PCR体系建立
1.3.1标准曲线的建立
以TYLCV的DNA为模板,以TYLCV-qF和TYLCV-qR(表1)为特异性引物,该引物根据TYLCV 的AV2 gene (Gene ID: 949226)进行设计[25],目的片段长度为100 bp,退火温度为58℃,经验证该引物特异性及扩增效率良好。使用2×TaqPlus Master Mix Ⅱ (Dye Plus)试剂盒进行PCR扩增,纯化回收目的片段后,连接至pMD18-T 载体,并转化感受态细胞TreliefTM5α Chemically Competent Cell(北京擎科生物有限公司),在37℃恒温箱中培养12~16 h后,以TYLCV-qF和TYLCV-qR为引物进行菌落PCR检测,将阳性克隆送生工生物工程(上海)股份有限公司测序。
选择测序序列完全正确的阳性克隆接种于含有氨苄青霉素(100 mg/L Amp+)的LB液体培养基,37℃,250 r/min振荡培养12~16 h,用质粒小提试剂盒提取质粒,用紫外分光光度计检测质粒浓度和OD值后,运用公式计算质粒浓度拷贝数:C=[(A×10-9)×(6.02×1 023)]/(B×660 dalton/bp),其中A为质粒浓度(ng/μL),B为分子碱基数,C为质粒浓度拷贝数(拷贝/μL),将其作为TYLCV质粒标准品使用。
用DNase/RNase free water将质粒标准品按照10倍梯度进行稀释,获得终浓度为5.15×108~5.15×1012拷贝/μL的5个质粒样品作为模板,使用南京诺维赞(Vazyme)生物公司的ChamQ Universal SYBR qPCR Master Mix试剂盒在实时荧光定量PCR仪上进行qPCR,每个浓度进行4次技术重复,得到Ct平均值后制作标准曲线。
1.3.2实时荧光PCR绝对定量
用CTAB法提取番茄或烟粉虱的总DNA,用NanoDrop测定所提DNA的OD260/OD280以及浓度,将DNA浓度统一定量到500 ng/μL作为模板DNA,进行qPCR检测,将所得Ct值代入回归方程y=-3.072x+37.568计算得出TYLCV的拷贝数,其中x为质粒浓度拷贝数对数,y为循环阈值(Ct),每个处理重复5次。
1.4 ToCV与TYLCV复合侵染对烟粉虱获取TYLCV效率以及积累量的影响
取400头健康的烟粉虱进行2 h的饥饿处理,分别在两种病毒复合侵染和TYLCV单独侵染15 d后的番茄上放入200头烟粉虱饲毒48 h。
随机取10头烟粉虱,使用1.2.2的方法提取单头烟粉虱DNA,根据琼脂糖凝胶电泳的结果计算10头烟粉虱的带毒率,每个处理重复5次。
随机取10头烟粉虱参照1.2.2方法提取烟粉虱的总DNA,DNA浓度统一定量到500 ng/μL,按照试剂盒说明书进行qPCR检测,将Ct值代入回归方程计算得出TYLCV的拷贝数,每个处理重复5次。
1.5 ToCV与TYLCV复合侵染对TYLCV传毒率以及积累量的影响
取适量健康的烟粉虱进行2 h的饥饿处理后,分别转移到两种病毒复合侵染和TYLCV单独侵染15 d后的番茄植株上饲毒48 h。
将50头带毒烟粉虱饥饿处理2 h后,一起转移到10株含3~4片真叶的健康番茄上取食48 h,随后用吸虫管移除烟粉虱。在10、15、20、25、30 d后取番茄顶部叶片,采用1.2.1所述方法提取番茄的总DNA,先检测番茄植株的带毒情况计算带毒率,然后将DNA含量统一定量到500 ng/μL,按照试剂盒说明书进行qPCR检测,得到的Ct值代入回归方程算出TYLCV的拷贝数,每处理重复5次。
分别取5、10、25、50头的带毒烟粉虱进行2 h的饥饿处理后,分别转移到10株3~4片真叶期的健康番茄上取食48 h并移除烟粉虱,15 d后采用1.2.1所述方法检测番茄植株的带毒情况,并计算带毒率以此来反映烟粉虱的传毒率。传毒率=带毒率=检测到TYLCV植株数/接种植株数。每处理重复5次。
1.6 ToCV与TYLCV复合侵染和TYLCV单独侵染对番茄叶片内叶绿素含量的影响
取适量健康的烟粉虱进行2 h的饥饿处理后,分别转移到复合侵染和TYLCV单独侵染15 d后的番茄植株上饲毒48 h,分别取50头带毒烟粉虱进行2 h的饥饿处理后,转移到10株3~4片真叶期的健康番茄上取食48 h并移除烟粉虱,在15 d后取番茄顶部叶片,用叶绿素测定仪检测叶片的叶绿素含量。每处理重复5次。
1.7 数据处理
采用Microsoft Excel 2012软件整理试验数据,IBM SPSS Statistics 21进行数据分析。复合侵染对烟粉虱获取TYLCV效率以及积累量的影响、在烟粉虱数量相同时,复合侵染对TYLCV传毒率的影响、在传毒后天数相同时,复合侵染对TYLCV传毒率和积累量的影响、复合侵染和TYLCV单独侵染对番茄叶片内叶绿素含量的影响均采用独立样本t测验(t-test)进行方差分析和差异显著性检验;在侵染方式相同的条件下,不同数量的烟粉虱对TYLCV传毒率的影响、相同数量烟粉虱传毒后不同天数对TYLCV的传毒率以及积累量的影响采用单因素方差分析(one-way analysis of variance, ANOVA)进行方差分析和差异显著性检验。
2 结果与分析
2.1 番茄黄化曲叶病毒SYBR Green I实时荧光定量PCR体系建立
质粒标准品浓度在5.15×108~5.15×1012拷贝/μL时,质粒标准品浓度和Ct值两者之间呈良好的线性关系(图1)。该标准曲线将用于后续TYLCV含量的测定。

图1 TYLCV含量的实时荧光定量PCR的标准曲线Fig.1 The standard curve of TYLCV amount by real-time quantitative PCR
2.2 ToCV与TYLCV复合侵染对烟粉虱获取TYLCV效率以及积累量的影响
试验结果表明,烟粉虱在TYLCV和ToCV复合侵染、TYLCV单独侵染的番茄植株上饲毒48 h后,单头烟粉虱的TYLCV获毒率分别为88%和74%(图2a)。烟粉虱体内TYLCV病毒的拷贝数分别为1.58×1010拷贝/μL和0.49×1010拷贝/μL(图2b)。在复合侵染的番茄上取食的烟粉虱的带毒率和病毒拷贝数都显著高于在TYLCV单独侵染的番茄上取食的烟粉虱。

图2 烟粉虱取食复合感染和单独感染TYLCV 植株后的获毒率和带毒量Fig.2 Acquisition rate and accumulation of TYLCV by Bemisia tabaci feeding on co-infected and single-infected tomato
2.3 ToCV与TYLCV复合侵染对TYLCV传毒率以及积累量的影响
试验结果表明,对TYLCV的传毒率与烟粉虱数量呈正相关,且同等数量的烟粉虱中取食ToCV与TYLCV复合侵染的番茄植株的烟粉虱对TYLCV的传毒率明显高于取食TYLCV单独侵染的番茄植株的烟粉虱。分别将25头取食复合侵染和单独侵染番茄的烟粉虱接种至健康番茄上,15 d后对TYLCV的传毒率分别为90%和74%。50头分别取食复合侵染和单独侵染番茄的烟粉虱对TYLCV的传毒率均达到100%(图3)。
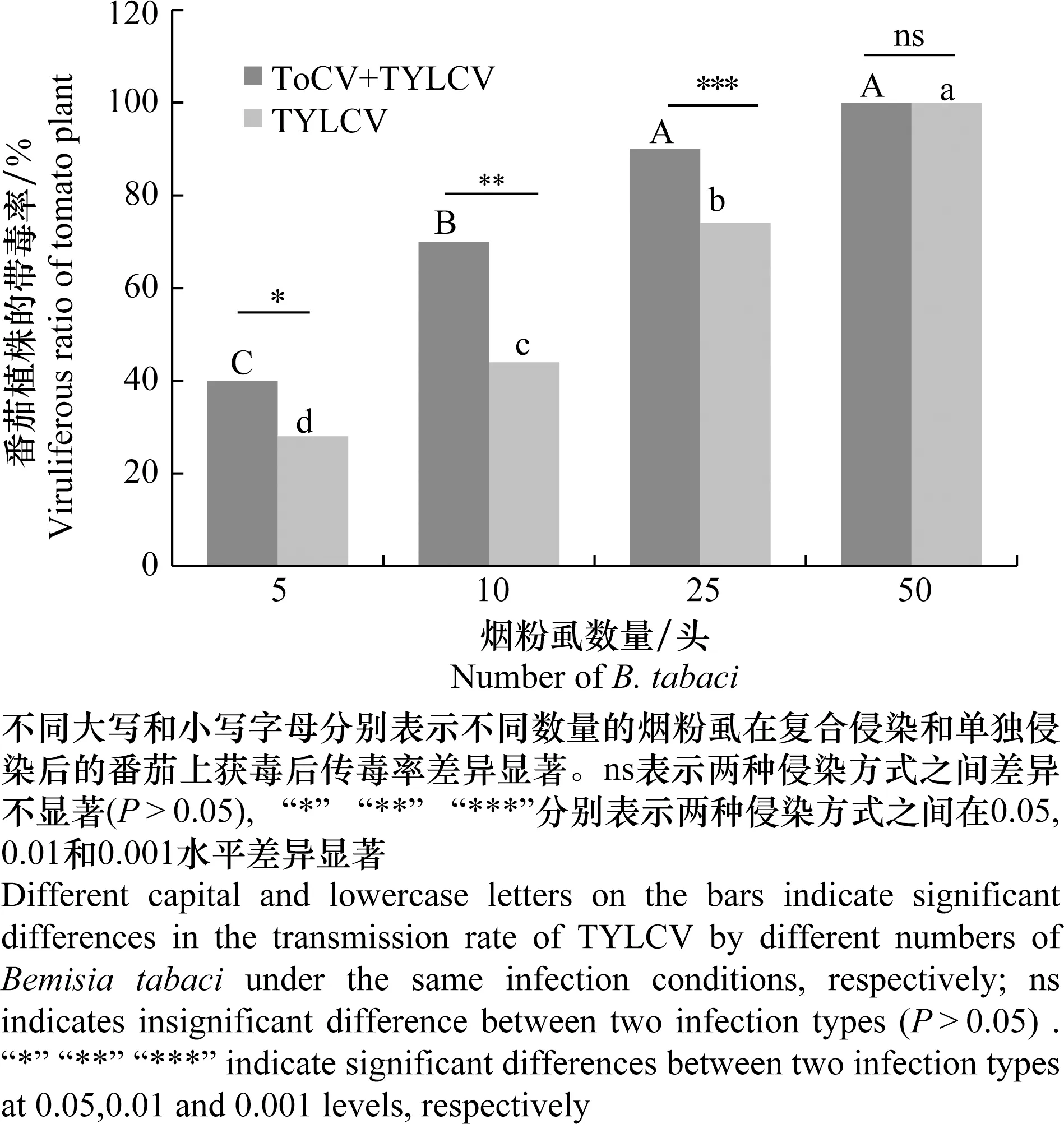
图3 复合侵染和单一侵染条件下不同数量烟粉虱对TYLCV的传毒率Fig.3 Transmission rate of TYLCV by different numbers of Bemisia tabaci on co-infected and single-infected tomato
取食复合侵染和TYLCV单独侵染番茄的烟粉虱传毒后10 d,番茄植株带毒率分别为80%和60%,传毒后15 d番茄植株的带毒率均达到100%(图4a)。
TYLCV的病毒积累量与烟粉虱传毒后的天数不相关,取食复合侵染和TYLCV单独侵染番茄后,烟粉虱传毒的番茄植株体内TYLCV的累积量分别为2.03×1011拷贝/μL和0.67×1011拷贝/μL(图4b)。
2.4 ToCV与TYLCV复合侵染和TYLCV单独侵染对番茄叶片内叶绿素含量的影响
试验结果表明,烟粉虱传毒后15 d,ToCV与TYLCV复合侵染和TYLCV单独侵染的番茄植株其叶片叶绿素含量都显著低于健康番茄植株(图5),但两者之间没有明显的差异。

图5 复合感染、单独感染和健康的番茄叶片内叶绿素含量Fig.5 Contents of chlorophyll in co-infected, single TYLCV-infected and healthy tomato leaves
3 结论与讨论
TYLCV目前是菜豆金色花叶病毒属中研究的最为全面的单组分病毒之一[26-27]。TYLCV与其他病毒在田间容易发生复合侵染,2014年在我国山东首次发现TYLCV和ToCV的复合侵染,之后复合侵染在我国呈逐年上升的趋势[10-12]。本试验主要研究了TYLCV和ToCV复合侵染与TYLCV单独侵染对介体昆虫Q型烟粉虱的获毒率、传毒率、番茄植株体内病毒量积累的影响。结果表明,取食复合侵染番茄植株的烟粉虱的获毒率要高于取食TYLCV单独侵染番茄植株的烟粉虱,分别为88%和74%。取食复合侵染和单独侵染番茄植株后的烟粉虱传毒率随烟粉虱数量的增加而显著升高,25头烟粉虱的传毒率分别为90%和74%,50头烟粉虱的传毒率均为100%,说明TYLCV和ToCV复合侵染提高了烟粉虱对TYLCV的获取和传播,这一现象需要引起重视和提前防范,以减少病毒侵染所造成的损失。
本试验结果显示,TYLCV和ToCV复合侵染促进了烟粉虱对TYLCV的传播,TYLCV和ToCV复合侵染的番茄体内TYLCV的积累量大约是TYLCV单独侵染的3倍。造成差异的原因可能与植物防御反应降低有关。因为TYLCV侵染可以抑制植物的JA防御途径[28],而ToCV侵染也可以降低植物的JA防御反应以及萜类挥发物的释放[29],推测二者复合侵染后更大程度地降低了植物的防御反应。该推测还有待于进一步验证。
复合侵染也促进了烟粉虱对ToCV的传播,并且复合侵染的烟粉虱和番茄体内ToCV的积累量大约是ToCV单独侵染的4倍[22],说明两种病毒复合侵染促进了烟粉虱对两种病毒的传播,可能是由于两种病毒共同起作用时,引起了介体昆虫与传毒相关特性的改变[30]。对于TYLCV和ToCV复合侵染番茄后,番茄植株体内及其与烟粉虱的互作机制还有待研究,可能是由于复合侵染与单独侵染相比,改变了烟粉虱体内防御和代谢相关的酶。前期研究发现,随着烟粉虱体内ToCV含量的升高,α-葡糖苷酶活性也逐渐升高[31],推测α-葡糖苷酶能够促进烟粉虱对病毒的获取,而复合侵染情况下烟粉虱体内的α-葡糖苷酶也可能进一步被激活,从而促进了烟粉虱对病毒的获取。这需要后期进一步试验验证。
本研究发现,TYLCV和ToCV复合侵染促进了烟粉虱对TYLCV的传播,因此,探明复合侵染下病毒-媒介昆虫-植物三者之间的协同机制对于植物病毒的防治和治理具有重要意义。

