一类新型[60]富勒烯二氢吲哚衍生物的合成反应研究
彭倩娜,王兴宇,柴明顶,霍靖文,牟欢,李法宝
(湖北大学化学化工学院, 湖北 武汉 430062)
0 引言
1985年,Kroto等[1]在氦气流中以激光蒸发石墨法制备出了毫克级的[60]富勒烯(C60).这是C60的初次报道.而在1990年,Krätschmer和Huffman通过电弧法[2]实现了C60的常量合成,极大地推动了富勒烯的发展.富勒烯独特的三维全碳中空分子结构获得了科学界的广泛关注,其在材料化学、生物医学、纳米技术等各个领域展现了越来越广泛的应用[3-6].但富勒烯在常见有机溶剂中的溶解度极其有限,限制了它在各个领域的发展,因此通过化学修饰的方法在富勒烯骨架上引入不同官能团以制备结构和功能多样的富勒烯衍生物是富勒烯化学研究的一个重要领域[7-8].但是,富勒烯的反应难以直接进行,并容易生成副产物.因此,为促进反应的进行,各类促进剂开始加入到富勒烯的反应中.通过促进剂的促进作用能够制备直接合成法不能合成的新型富勒烯衍生物,且产物更为单一.例如,TEMPO促进的富勒烯四氢吡啶衍生物的合成[9],对甲苯磺酸促进的酮/芳基硼酸的胺甲基化反应合成N-烷基化富勒烯吡咯烷[10].除此之外,还有不少过渡金属盐,例如醋酸锰(Mn(OAc)3·2H2O)[11]、醋酸铅(Pb(OAc)4)[12]及醋酸铜(Cu(OAc)2·H2O)[13],也成功地应用到富勒烯化学的反应历程中.高氯酸铁(Fe(ClO4)3·xH2O)[14]作为一种便宜、高效的金属盐促进剂,也常用于富勒烯化学反应中,得到结构新颖的富勒烯衍生物.近年来,在各种促进剂的参与下,已经合成出了不同结构的富勒烯衍生物[15-16].在已合成的富勒烯衍生物中,富勒烯二氢吲哚化合物具有一定的生物活性,在生物医学领域具有一定应用价值,因此备受关注,但已报道的富勒烯二氢吲哚多为N-取代富勒烯二氢吲哚衍生物[17-18],针对N-未取代富勒烯二氢吲哚衍生物的系统性合成研究至今鲜有报道.因此,我们进行N-未取代富勒烯二氢吲哚的合成探索,以期拓展富勒烯反应及其相关应用领域.
本工作利用[60]富勒烯与芳香醛、芳香胺在高氯酸铁/三氯化铝促进体系下的反应合成出N-未取代的富勒烯二氢吲哚衍生物,通过改变反应温度、反应物当量等,找到制备N-未取代的富勒烯二氢吲哚的最佳反应条件,并且在最佳条件下进行底物拓展,合成出一系列的N-未取代富勒烯二氢吲哚衍生物.并采用核磁共振谱(1H NMR和13C NMR)、傅里叶变换红外光谱(FT-IR)、紫外光谱(UV-vis)等波谱手段对目标化合物进行结构表征和确认.
1 实验部分
1.1 试剂与仪器仪器:中国武汉物理与数学研究所WIPM400/500(400/500 MHz)核磁共振仪,BX FI-IR型傅里叶转换红外光谱仪(美国Perkin-Elmet公司生产,KBr压片),恒温加热磁力搅拌器,AL-206型电子天平(上海,梅特勒-拖利多公司),SHZ-Ⅲ型循环水式真空泵(上海荣生化学仪器厂),旋转蒸发仪,氮气保护装置.试剂:所用试剂均为市售,试剂纯度均为AR.
1.2 合成表征所有产物都已通过核磁共振谱(1H NMR和13C NMR)进行表征,确认了结构,在所得的所有产物1H NMR谱中,我们都可以清楚地观察到全部氢质子的预期化学位移和裂分方式.以N-未取代富勒烯二氢吲哚3a为例(图1),我们可以清楚地看到化学位移在8.0以上区域,存在一个N—H质子的单峰,而化学位移在6.5~8.0范围内有2个双重峰、2个三重峰,分别代表着苯环上的4个氢质子,每个峰形与积分值均符合理论预期情况.可以推断其结构与预期产物一致.
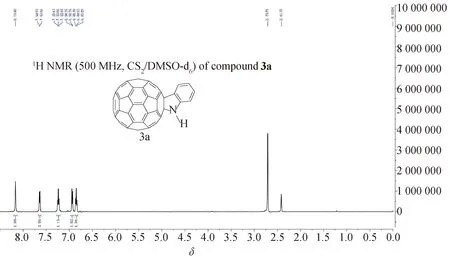
图1 N-未取代富勒烯二氢吲哚3a 1H NMR 图
在13C NMR谱中,依然以N-未取代富勒烯二氢吲哚3a为例(图2),C60骨架中的58个sp2碳出现了27个峰,其中一些峰重叠在了一起,C60剩余的两个sp3碳出现两个单峰,它们的分子结构符合Cs对称性,为预期产物结构.
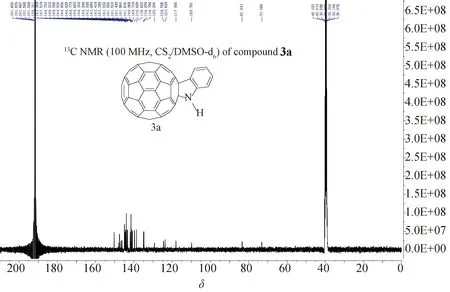
图2 N-未取代富勒烯二氢吲哚3a 13C NMR 图
对于N-未取代富勒烯二氢吲哚3a,我们知道其分子式为C66H5N,理论分子量应为811.042 2,而在其高分辨质谱(MALDI-TOF MS)谱中(图3),可以看到所测得其实际分子量为811.041 7,误差在合理范围内,因此可以推断其符合为预期产物结构.
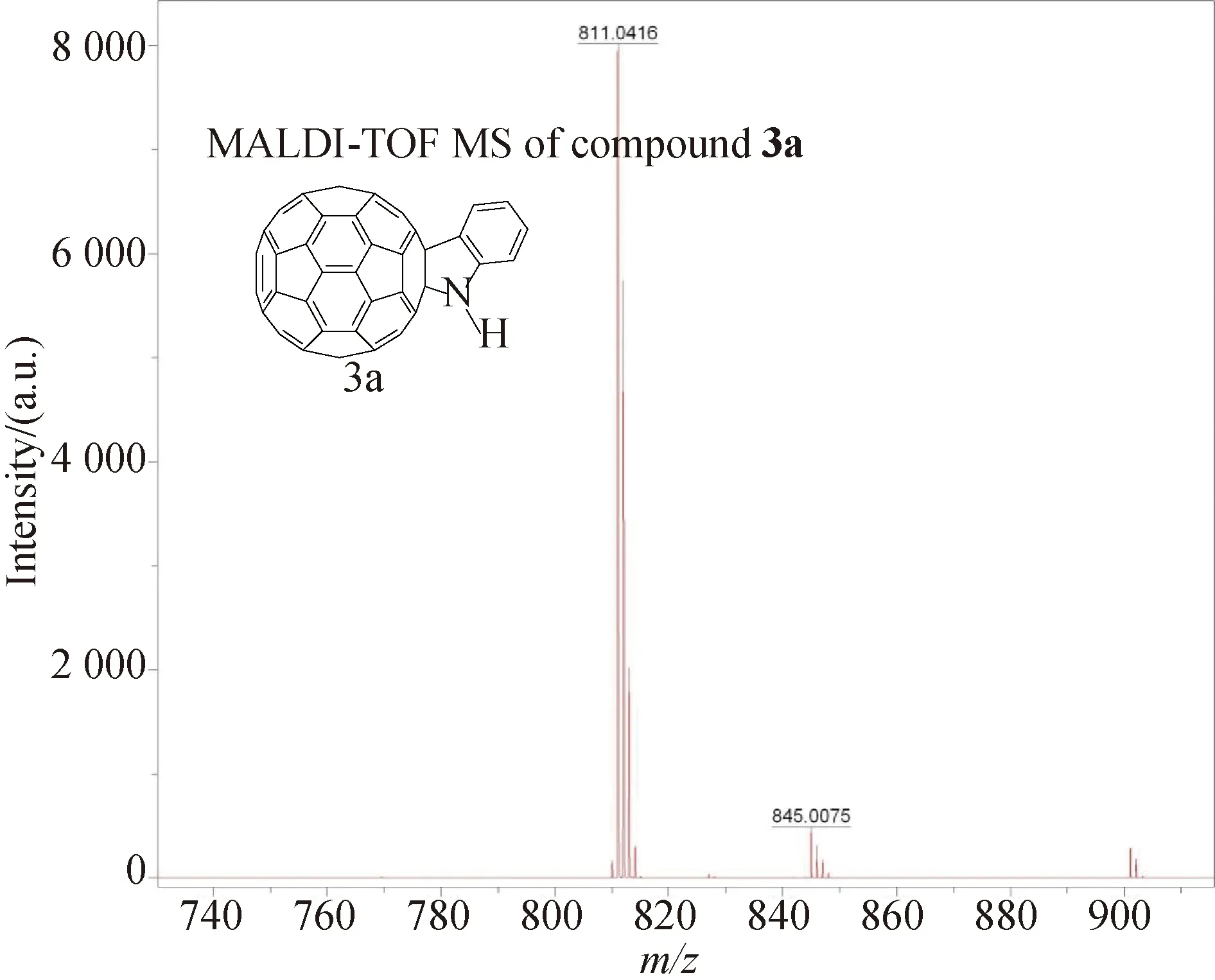
图3 N-未取代富勒烯二氢吲哚3a MALDI-TOF MS 图
2 结果与讨论
2.1 合成条件优化表1展示了合成N-未取代[60]富勒烯二氢吲哚的条件优化过程.以C60与苯甲醛(1a)以及苯胺(2a)的反应为例.最初在空气条件下,将Pb(OAc)4作为促进剂,并以C60/苯甲醛(1a)/苯胺(2a)/促进剂为1∶10∶10∶2的比例,在180 ℃的温度下进行反应,并没有产物生成 (序号1,表1).随后用Mg(ClO4)2替代Pb(OAc)4参与反应,其他条件不变的情况下,明显有产物的生成 (序号2, 表1),但产率较低. 继续探索条件,发现在以相同比例加入Fe(ClO4)3·xH2O,产物产率有所增加 (序号3,表1),并在此条件下,改变促进剂的量,无论增加还是减少,均产生微量的产物 (序号4和5,表1). 而促进剂的量不变的情况下,将参与反应的苯甲醛和苯胺的量增加到20倍当量后,产率有所增加(序号6,表1),但继续增加,产率不增反降 (序号7,表1),由此确定了苯胺与苯甲醛的最佳反应当量.随后加入与Fe(ClO4)3·xH2O相同当量的促进剂AlCl3,产率明显增加 (序号8,表1).在此基础上探索促进剂的当量对反应的影响,发现将促进剂的量减少后,产率下降 (序号9,表1). 而将促进剂的量增加,产率不变,但转化率明显下降 (序号10,表1),因此只有当促进剂的量都为两倍当量时,反应效果最佳.在确定了反应物的比例之后,降低反应温度,产率大大减少 (序号11,表1),因此当反应温度为180 ℃时,反应效果最佳. 紧接着,在反应体系中通入氮气,发现产率有所降低 (序号12,表1),可知空气中的氧气对反应有促进作用.随后分别探究了在没有苯甲醛以及没有促进剂的情况下的反应,均不能生成预期产物 (序号13和14,表1),说明苯甲醛与促进剂的存在至关重要. 接着在相同条件下,将AlCl3分别换成GaCl3、BHT、TEMPO以及TsOH·H2O,反应效果均不理想 (序号15-18,表1). 当反应条件为空气,180 ℃条件下,将C60/苯甲醛/苯胺/Fe(ClO4)3·xH2O/AlCl3以1∶20∶20∶2∶2的比例溶在6 mL的邻二氯苯(ODCB)中搅拌反应时,可以得到最优产率的N-未取代的富勒烯二氢吲哚 (序号8,表1).
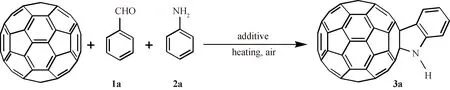
表1 C60与苯甲醛及苯胺反应条件的筛选a
在最优条件下,我们研究了C60与各种芳香醛以及芳香胺的反应,代表性的芳香醛包括苯甲醛(1a)、对氯苯甲醛(1b)、对溴苯甲醛(1c)、对甲基苯甲醛(1d),典型的芳香胺包括苯胺(2a)、对氯苯胺(2b)、对溴苯胺(2c)、对甲基苯胺(2d),上述反应均生成了一定产率的N-未取代富勒烯二氢吲哚衍生物 (3a-d). 图4列出了C60与芳香醛(1a-d)和芳香胺(2a-d)的反应条件和产率.
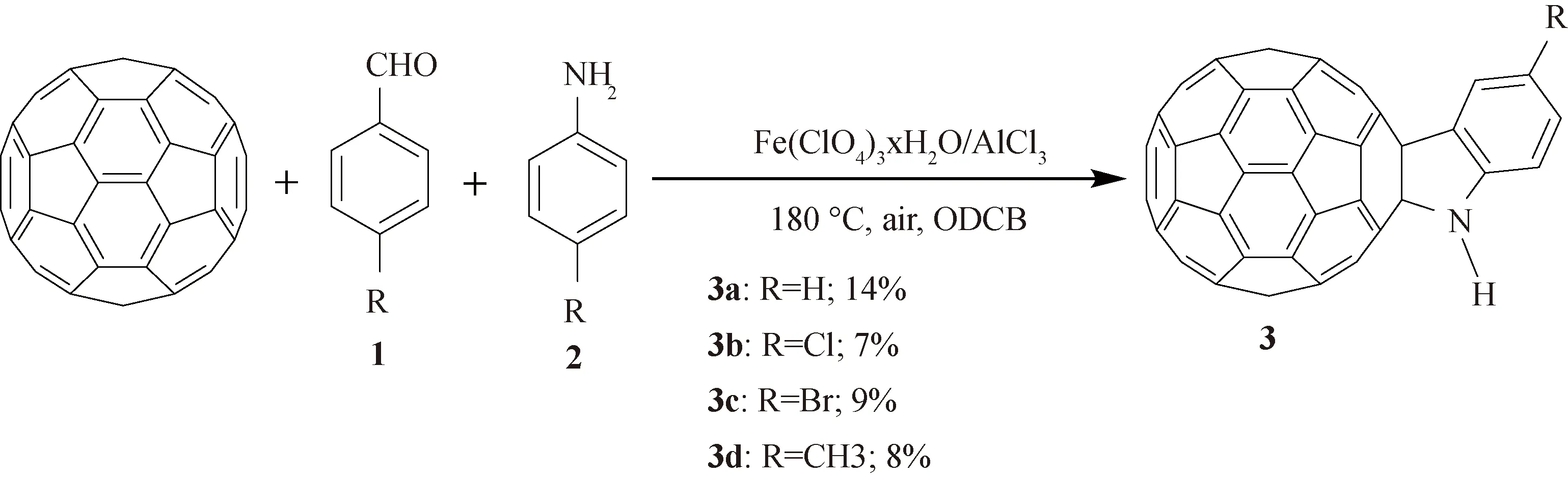
图4 N-未取代富勒烯二氢吲哚的合成路线
值得注意的是,当氟代苯甲醛(1e)与氟代苯胺(2e)反应时,可以代替预期的富勒烯二氢吲哚得到另一种结构新颖的2,3-双(4-氟苯基)富勒烯恶唑烷衍生物(4)(图5),具体原因需要进一步研究.需要特别说明一点,尽管本研究报道的N-未取代富勒烯二氢吲哚(3a-d)与2,3-双(4-氟苯基)富勒烯恶唑烷(4)产率均在10%左右,但在富勒烯化学修饰领域这是可接受的产率数据.
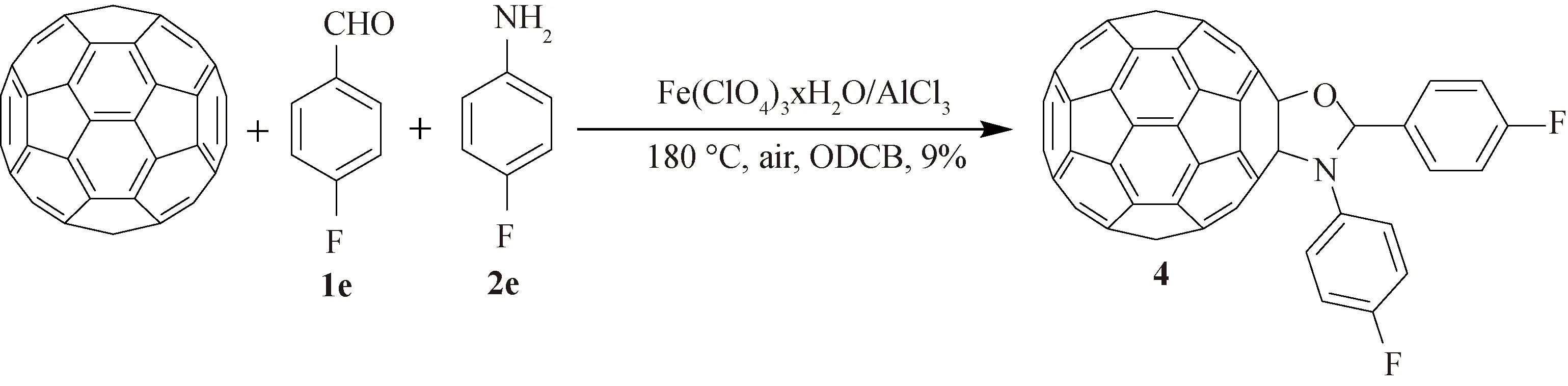
图5 富勒烯恶唑烷的合成路线
2.2 目标化合物的合成与表征
2.2.1 富勒烯二氢吲哚3a的合成 将C60(36.0 mg, 0.05 mmol)、Fe(ClO4)3·xH2O (37.2 mg, 0.10 mmol)和AlCl3(13.3 mg, 0.10 mmol)加入到50 mL三颈烧瓶中,再将6 mL的ODCB加入到上述体系中,使其充分溶解,再加入苯甲醛 (102 μL, 1.0 mmol)、苯胺 (91 μL, 1.0 mmol),随后在180 ℃时空气条件下搅拌,采用薄层色谱法(TCL)监测反应进程,当产物不再增加时将反应停止(共25 min). 停止反应后,先采用较短的硅胶层析柱将反应中不溶的物质过滤,过滤下来的液体利用旋转蒸发仪除去所有溶剂后,得到粗产物,然后利用柱层析法对粗产物进行分离纯化,用纯的CS2作为洗脱剂,首先过下来的是极性较小的未反应的C60(29.5 mg, 82%),继续分离得到目标产物N-未取代富勒烯二氢吲哚3a(5.7 mg, 14%, Rf= 0.7), 熔点>300 ℃;3a:1H NMR (500 MHz, CS2/DMSO-d6)δ8.16 (s, 1H), 7.64 (d,J= 7.4 Hz, 1H), 7.24 (t,J= 7.6 Hz, 1H), 6.94 (d,J= 8.0 Hz, 1H), 6.85 (t,J=7.8 Hz, 1H);13C NMR (100 MHz, CS2/DMSO-d6) (all 2C unless indicated)δ=147.96 (1C, aryl C), 147.52, 146.75 (1C), 146.22 (1C), 144.96, 144.94, 144.86, 144.83, 144.77, 144.60, 144.35, 144.25, 143.93, 143.90 (6C), 143.41, 143.31, 141.93, 141.59, 141.55, 141.49 (4C), 141.08, 141.03, 140.98, 140.72, 139.06, 138.63, 134.88, 134.70, 129.20 (1C, aryl C), 124.51 (1C, aryl C), 123.63 (1C, aryl C), 118.00 (1C, aryl C), 109.79 (1C, aryl C), 83.44 (1C, sp3-Cof C60), 73.07 (1C, sp3-Cof C60); FT-IRν/cm-1(KBr)分别为3 393, 2 923, 1 595, 1 476, 1 427, 1 313, 1 261, 1 183, 1 037, 910, 737, 674, 574, 527; UV-vis (CHCl3)λmax/nm 256, 310, 428; HRMS (MALDI-TOF)m/z: [M]-Calcd for C66H5N 811.042 2; Found 811.041 7.
2.2.2 富勒烯二氢吲哚3b的合成 采用与化合物3a相同的合成方法,取C60(36.0 mg, 0.05 mmol)、Fe(ClO4)3·xH2O (37.2 mg, 0.10 mmol)与AlCl3(13.3 mg, 0.10 mmol)和对氯苯甲醛 (140.6 mg, 1.0 mmol)、对氯苯胺 (127.6 mg, 1.0 mmol)溶于6 mL的ODCB中,于180 ℃下反应25 min. 柱层析色谱法分离纯化,用纯的CS2作为洗脱剂,首先过下来的是极性较小的未反应的C60(32.0 mg, 89%),继续分离得到目标产物N-未取代富勒烯二氢吲哚3b(3.0 mg, 7%,Rf= 0.7), 熔点>300 ℃;3b:1H NMR (500 MHz, CS2/DMSO-d6)δ=8.36 (s, 1H), 7.62 (s, 1H), 7.19 (d,J= 8.4 Hz, 1H), 6.91 (d,J=8.4 Hz, 1H);13C NMR (125 MHz, CS2/DMSO-d6) (all 2C unless indicated)δ=149.78, 147.11, 146.89 (1C), 146.81 (1C), 146.36 (1C), 145.11, 145.08, 144.96, 144.91 (4C), 144.50, 144.48, 144.19, 144.13, 144.09, 144.02, 143.50, 143.40, 142.04, 141.68, 141.66, 141.62, 141.49, 141.21, 141.14, 141.09, 140.86, 139.83, 138.77, 134.96, 134.94, 129.07 (1C, aryl C), 125.80 (1C, aryl C), 124.65 (1C, aryl C), 121.98 (1C, aryl C), 110.51 (1C, aryl C), 83.92 (1C, sp3-Cof C60), 72.68 (1C, sp3-Cof C60); FT-IR ν/cm-1(KBr)分别为3 435, 2 920, 2 866, 1 474, 1 435, 1 373, 1 251, 1 171, 1 037, 811, 677, 574, 525; UV-vis (CHCl3)λmax/nm 256, 313, 428; HRMS (MALDI-TOF)m/z: [M]-Calcd for C66H4NCl 845.003 2; Found 845.002 8.
2.2.3 富勒烯二氢吲哚3c的合成 采用与化合物3a相同的合成方法,取C60(36.0 mg, 0.05 mmol)、Fe(ClO4)3·xH2O (37.2 mg, 0.10 mmol)与AlCl3(13.3 mg, 0.10 mmol)和对溴苯甲醛 (185.0 mg, 1.0 mmol)、对溴苯胺 (172.0 mg, 1.0 mmol)溶于6 mL的ODCB中,于180 ℃下反应35 min. 柱层析色谱法分离纯化,用纯的CS2作为洗脱剂,首先过下来的是极性较小的未反应的C60(30.0 mg, 83%),继续分离得到目标产物N-未取代富勒烯二氢吲哚3c(4.0 mg, 9%,Rf= 0.8), 熔点>300 ℃;3c:1H NMR (500 MHz, CS2/DMSO-d6)δ=8.29 (s, 1H), 7.75 (s, 1H), 7.31 (d,J= 8.4 Hz, 1H), 6.86 (d,J= 8.4 Hz, 1H);13C NMR (125 MHz, CS2/DMSO-d6) (all 2C unless indicated)δ=149.76, 147.19 (1C), 146.98, 146.88 (1C), 146.34 (1C), 145.09, 145.07, 144.95, 144.91, 144.88, 144.49, 144.44, 144.14, 144.13, 144.07, 144.01, 143.49, 143.37, 142.03, 141.67, 141.63, 141.62, 141.48, 141.21, 141.12, 141.07, 140.86, 139.83, 138.76, 134.96, 134.93, 131.84 (1C, aryl C), 127.47 (1C, aryl C), 126.25 (1C, aryl C), 110.99 (1C, aryl C), 108.98 (1C, aryl C), 83.82 (1C, sp3-C of C60), 72.61 (1C, sp3-C of C60); FT-IRν/cm-1(KBr)分别为3 393, 2 917, 2 852, 1 593, 1 471, 1 427, 1 376, 1 269, 1 183, 1 040, 870, 805, 671, 573, 526; UV-vis (CHCl3)λmax/nm 255, 309, 427; HRMS (MALDI-TOF)m/z: [M]-Calcd for C66H4NBr 888.952 7; Found 888.952 1.
2.2.4 富勒烯二氢吲哚3d的合成 采用与化合物3a相同的合成方法,取C60(36.0 mg, 0.05 mmol)、Fe(ClO4)3·xH2O (37.2 mg, 0.10 mmol)与AlCl3(13.3 mg, 0.10 mmol)和对甲基苯甲醛 (118 μL, 1.0 mmol)、对甲基苯胺 (107.2 mg, 1.0 mmol)溶于6 mL的ODCB中,于180 ℃下反应30 min. 柱层析色谱法分离纯化,用纯的CS2作为洗脱剂,首先过下来的是极性较小的未反应的C60(30.2 mg, 84%),继续分离得到目标产物N-未取代富勒烯二氢吲哚3d(3.3 mg, 8%,Rf= 0.7), 熔点>300 ℃:3d:1H NMR (500 MHz, CS2/DMSO-d6)δ=7.88 (s, 1H), 7.48 (s, 1H), 7.05 (d,J= 7.9 Hz, 1H), 6.85 (d,J= 7.9 Hz, 1H), 2.37 (s, 3H);13C NMR (125 MHz, CS2/DMSO-d6) (all 2C unless indicated)δ=150.32, 147.88, 146.73 (1C), 146.18 (1C), 145.56 (1C), 144.93, 144.89, 144.83, 144.79, 144.74, 144.61, 144.31, 144.22, 143.90, 143.85 (4C), 143.38, 143.29, 141.90, 141.57, 141.52, 141.47, 141.46, 141.05, 141.00, 140.97, 140.66, 139.61, 138.59, 134.79, 134.65, 129.71 (1C, aryl C), 126.89 (1C, aryl C), 125.08 (1C, aryl C), 123.96 (1C, aryl C), 109.96 (1C, aryl C), 83.62 (1C, sp3-C of C60), 73.12 (1C, sp3-C of C60); FT-IRν/cm-1(KBr)分别为3 438, 2 920, 2 858, 1 495, 1 462, 1 427, 1 263, 1 183, 1 043, 802, 677, 574, 525; UV-vis (CHCl3)λmax/nm 256, 308, 428; HRMS (MALDI-TOF)m/z: [M]-Calcd for C67H7N 825.057 9; Found 825.057 6.
2.2.5 2,3-双(4-氟苯基)富勒烯恶唑烷4的合成 采用与化合物3a相同的合成方法,取C60(36.0 mg, 0.05 mmol)、Fe(ClO4)3·xH2O (37.2 mg, 0.10 mmol)与AlCl3(13.3 mg, 0.10 mmol)和对氟苯甲醛 (107 μL, 1.0 mmol)、对氟苯胺 (95 μL, 1.0 mmol)溶于6 mL的ODCB中,于180 ℃下反应30 min. 柱层析色谱法分离纯化,用纯的CS2作为洗脱剂,首先过下来的是极性较小的未反应的C60(32.0 mg, 89%),继续分离得到非预期2,3-双(4-氟苯基)富勒烯恶唑烷衍生物4(4.1 mg, 9%,Rf= 0.8), 熔点>300 ℃;4:1H NMR (500 MHz, CS2/DMSO-d6)δ=8.00 (t,J= 6.1 Hz, 2H), 7.59 (t,J= 6.1 Hz, 2H), 7.28 (s, 1H), 7.11 (t,J= 8.0 Hz, 2H), 6.93 (t,J= 8.0 Hz, 2H);13C NMR (100 MHz, CS2/DMSO-d6) (all 1C unless indicated)δ=164.51 (q,JC-F= 244.8 Hz, aryl C), 159.56 (q,JC-F= 246.0 Hz, aryl C), 149.55, 148.35, 148.17, 147.71, 147.09, 146.85, 145.39, 145.37, 145.29, 145.24 (2C), 145.04 (2C), 144.99 (2C), 144.95, 144.81, 144.74, 144.33, 144.29, 144.23, 144.15, 144.00 (3C),143.89, 143.77, 143.76, 143.55, 143.54 (2C), 143.45, 141.69 (3C), 141.61 (3C), 141.57, 141.32, 141.21 (2C), 141.11, 141.10, 141.06, 140.97, 140.76, 140.74, 140.72, 140.33, 138.69, 138.62, 138.41, 138.06, 137.85 (arylC), 137.50, 137.29, 137.26, 136.48, 130.51 (q,JC-F= 7.4 Hz, 2C, aryl C), 130.36 (aryl C), 128.53 (q,JC-F= 6.9 Hz, 2C, aryl C), 115.09 (q,JC-F= 20.8 Hz, 2C, aryl C), 114.59 (q,JC-F= 20.4 Hz, 2C, aryl C), 95.26, 90.58, 83.18; FT-IRν/cm-1(KBr) 2 919, 1 560, 1 506, 1 457, 1 428, 1 224, 1 180, 1 150, 1 078, 940, 833, 804, 747, 673, 572, 526; UV-vis (CHCl3)λmax/nm 256, 317, 417; HRMS (MALDI-TOF)m/z: [M]-Calcd for C73H9F2NO 953.065 2; Found 953.064 8.
3 结论
本研究以C60与芳香醛和芳香胺为原料,在Fe(ClO4)3·xH2O/AlCl3促进体系下通过加热合成了新型的N-未取代富勒烯二氢吲哚衍生物.采用核磁共振谱(1H NMR和13C NMR)、傅里叶变换红外光谱(FT-IR)、紫外光谱(UV-vis)等波谱手段对目标化合物进行了结构表征,确认了结构.与传统的合成方法相比,本方法具有反应原料便宜易得、操作简便、产物结构新颖等优点. 该化合物在医学和材料方面有很大的应用前景.

