旋毛虫HSP70蛋白诱导大鼠心肌细胞线粒体凋亡机制的研究
王姗姗,刁子洋,郭 琨,王雪莹,侯嘉明,薄禄琪,王 爽,宋铭忻
(东北农业大学动物源性人兽共患病黑龙江省重点实验室,黑龙江 哈尔滨 150030)
旋毛虫病是由旋毛虫引起的一种严重的人兽共患线虫病,在食肉哺乳动物之间广泛传播,人因食用含活旋毛虫的猪、犬及其肉制品等而感染[1]。旋毛虫感染过程中虫体释放的抗原作用于TLR4 受体,引起其表达量的变化,进而通过TLR4/MyD88/NF-κB通路的激活引起炎性因子分泌发生变化[2]。旋毛虫重度感染者可因心肌炎、脑炎、肺炎等死亡,其中心肌炎是最多见的旋毛虫致死病因之一[3-4]。研究认为,旋毛虫感染导致的心肌炎有两种可能,一是旋毛虫幼虫从心肌一过性游走导致的直接性心肌炎,一是旋毛虫所分泌的毒素导致的间接性心肌炎[5]。
热休克蛋白(Heat shock proteins,HSP)也称为应激蛋白,在寄生虫感染过程中,宿主机体与虫体均处于应激状态,各自产生的HSP 相互抵抗,寄生虫产生的HSP 参与其分化、致病力及侵入过程[6]。研究发现,旋毛虫HSP70 重组蛋白(Ts-Hsp70)通过与细菌脂多糖(Lipopolysaccharide,LPS)相似的路径刺激和活化树突状细胞,且大剂量的Ts-Hsp70 对树突状细胞有毒性作用,而LPS 可刺激机体产生一系列反应并对心肌产生直接损伤,导致心肌细胞的凋亡[7],但旋毛虫HSP70 对心肌细胞功能的影响研究甚少[8]。因此,本研究通过将Ts-Hsp70 体外作用于H9c2 细胞,检测H9c2细胞损伤标志性因子,分析线粒体凋亡通路中相关凋亡蛋白与抗凋亡蛋白的表达,研究旋毛虫致宿主心肌炎发生的机制,解析旋毛虫感染与宿主心肌细胞凋亡的关系,研究结果将对研究旋毛虫的发病机制和提供防治对策具有重要意义。
1 材料与方法
1.1 虫种、细胞系及主要试剂旋毛形线虫(Trichinella spiralis)分离自黑龙江逊克猪,由东北农业大学动物医学学院兽医寄生虫学教研室保种;大鼠心肌细胞H9c2 由内蒙古大学提供。Ts-Hsp70 由本实验室表达并保存。
LPS 购自北京博奥拓达科技有限公司;CCK-8 细胞活性检测试剂盒、BCA 蛋白定量试剂盒及活性氧(Reactive oxygen species,ROS)检测试剂盒,均购自大连美仑生物公司;乳酸脱氢酶(Lactic dehydrogenase,LDH)检测试剂盒及肌酸激酶(Creatinekinase,CK)检测试剂盒,购自南京建成生物科技有限公司;SYBR Premix ExTaqⅡ购自宝生物工程(大连)有限公司;鼠源GAPDH 多克隆抗体(PcAb)、鼠源Bax PcAb、鼠源Bcl-2 PcAb、鼠源Cytochrome C PcAb、鼠源Pro-Caspase-9 PcAb、鼠源cl-Caspase-9 PcAb、鼠源Pro-Caspase-3 PcAb、鼠源cl-Caspase-3 PcAb、羊抗鼠IgG-HRP(二抗),均购自中国Abmart公司。
1.2 Ts-Hsp70 刺激H9c2 细胞最适浓度的优化取对数生长期的H9c2 细胞铺于96 孔板,待细胞贴壁后分别加入5 μg/mL、10 μg/mL、15 μg/mL、25 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL 的Ts-Hsp70,以10 μg/mL LPS 刺激的H9c2 细胞作为阳性对照,以不做处理的细胞为空白对照。于5% CO2、37 ℃孵育12 h 后弃上清,按每孔培养基总体积的10%加入CCK-8 溶液,孵育4 h 后,经酶标仪检测OD450nm值,利用CCK-8 试剂盒检测细胞得相对活性,筛送Ts-Hsp70 最适浓度。以上实验重复3 次。
1.3 Ts-Hsp70 刺激H9c2 细胞后 的LDH 含 量 测定取对数生长期的H9c2 细胞以1×105个/孔铺于24孔板中培养至贴壁后,加入1.2 确定的最适浓度的Ts-Hsp70,于5%CO2、37 ℃孵育6 h、12 h、18 h 后取细胞培养上清液,经酶标仪检测OD450nm值,利用LDH 试剂盒检测各组细胞的LDH 含量,以上试验重复3 次。试验以LPS 刺激的H9c2 细胞为阳性对照,以不做处理的细胞为空白对照。
1.4 Ts-Hsp70 刺激H9c2 细胞后的CK 含量测定取1.3 中共孵育后各时间点细胞培养上清液加入比色皿中,采用CK 试剂盒检测各组细胞的CK 含量,以上试验重复3 次。
1.5 Ts-Hsp70 刺 激H9c2 细 胞 后释放ROS 的 检测于1.3 中共孵育后各时间点细胞培养孔中分别加入无血清培养液稀释后的荧光探针(DCFH-DA)(1∶1 000,终浓度为10 mol/L),孵育30 min后,用无血清培养基洗涤3 次,经荧光显微镜检测荧光信号,分析Ts-Hsp70 刺激H9c2 细胞后对其ROS 释放的影响,以上试验重复3 次。试验设在检测前30 min 时加入无血清培养液稀释后的Rosup(1∶1 000,终浓度为50 μg/mL)作为阳性对照,以不做处理的细胞为空白对照。
1.6 Ts-Hsp70 刺激H9c2 细胞后细胞凋亡基因Bax、Bcl-2 转录及表达水平的检测取对数生长期的H9c2 细胞铺于12 孔板中培养,按照1.3 中方法加入Ts-Hsp70 后,分别于共孵育6 h、12 h、18 h 时收获H9c2 细胞,利用TRIzol 试剂提取细胞中的总RNA,反转录为cDNA 后作为模板,采用表1 中的引物,经荧光定量PCR(qPCR)分别检测H9c2 细胞中Bax、Bcl-2 mRNA 的转录水平,采用2-ΔΔCt方法[9]分析检测结果,以上试验重复3 次。试验同样以LPS刺激的H9c2 细胞为阳性对照,以不做处理的细胞为空白对照。另外,分别以鼠源Bax、Bcl-2 的PcAb(1∶500)为一抗,羊抗鼠IgG-HRP(1∶5 000)为二抗,经western blot 检测凋亡基因Bax、Bcl-2 的表达水平。
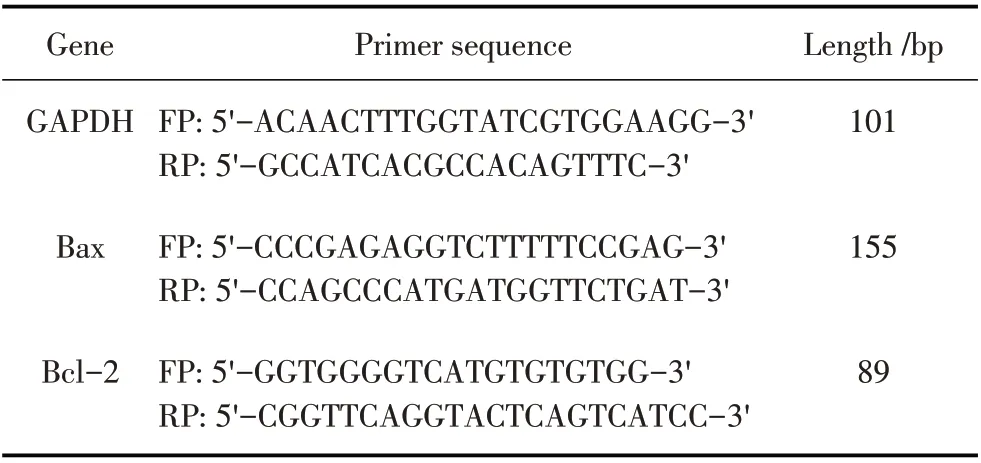
表1 荧光定量PCR引物序列Table 1 Sequence of qPCR primers
1.7 Ts-Hsp70 刺激H9c2 细胞后凋亡相关蛋白表达水平的检测取对数生长期的H9c2 细胞铺于6 孔板中培养,按照1.3 方法加入Ts-Hsp70 后于共孵育6 h、12 h、18 h 时分别加入适量的RIPA 蛋白裂解液,通过BCA 蛋白定量试剂盒测定各组上清液蛋白浓度,根据测量结果,将各组蛋白稀释至同一浓度后分别加入5×SDS-PAGE 上样缓冲液,煮沸8 min 后经SDSPAGE 检测,用5%脱脂乳封闭2 h 后分别以鼠源Cytochrome C、Pro-Caspase-9(Pro-CASP-9)、cl-Caspase-9(cl-CASP-9)、Pro-Caspase-3(Pro-CASP-3)及cl-Caspase-3(cl-CASP-9)(1∶500)的PcAb 为一抗,羊抗鼠IgG-HRP(1∶5 000)为二抗,以ECL 发光试剂显影,进行western blot 检测,利用Image-J 软件检测条带灰度值,分析凋亡相关蛋白表达水平。试验同样设LPS刺激的H9c2 细胞为阳性对照,以不做处理的细胞为空白对照。
1.8 数据统计学分析所有的数据均采用SPSS软件进行统计学分析,并通过Graphpad Prism 7.0 软件对数据作图,所有数值均采用平均值±标准差(即-x±s)表示,两组数据之间比较使用独立样本t检验;实验数据均值比较采用单因素方差分析(*代表P<0.05 表示差异显著,**代表P<0.01 表示差异极显著)。
2 结 果
2.1 Ts-Hsp70 刺激H9c2 细胞最适浓度的优化结果H9c2 细胞经不同浓度Ts-Hsp70 作用12 h,采用CCK-8 法检测细胞活性。结果显示,与空白对照细胞 相 比,浓 度 为5 μg/mL~25 μg/mL 的Ts-Hsp70 对H9c2 细胞活性均无显著影响,而40 μg/mL~100 μg/mL的Ts-Hsp70 极显著降低了H9c2 细胞活性(P<0.01),且呈浓度依赖性,进一步分析显示40 μg/mL Ts-Hsp70 对H9c2 细胞活力影响较弱,不利于凋亡基因的检测,而60 μg/mL Ts-Hsp70 对细胞活力影响适中,细胞活力可达到70%,因此选取60 μg/mL 浓度的Ts-Hsp70用于后续试验(图1)。
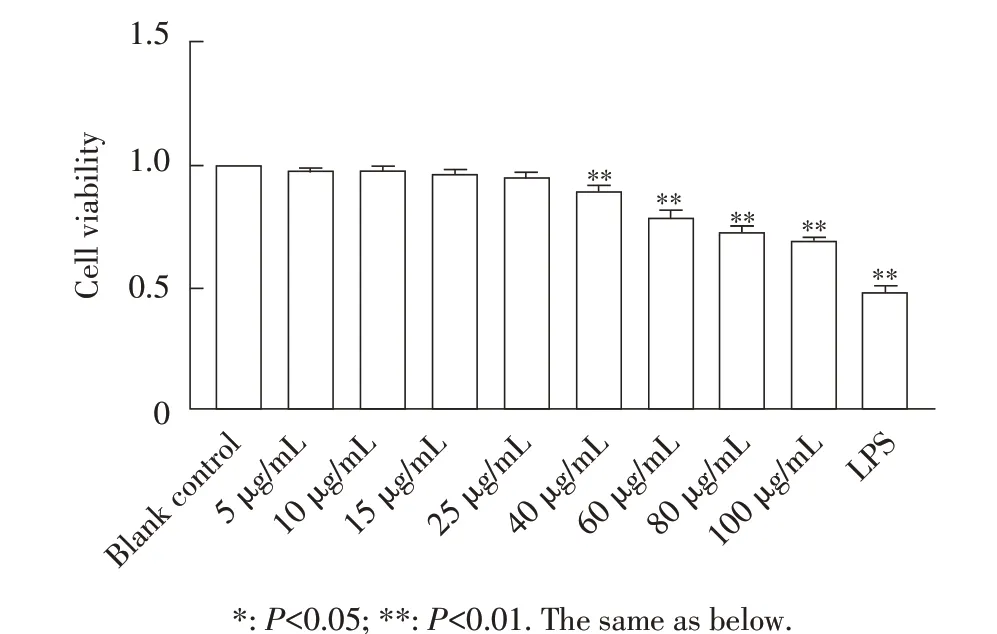
图1 Ts-Hsp70刺激H9c2细胞浓度优化Fig.1 Optimization of H9c2 cell concentration stimulated by Ts-HSP70
2.2 Ts-Hsp70 刺激H9c2 细胞后的LDH 含量测定结果H9c2 细胞经60 μg/mL Ts-Hsp70 分别作用6 h、12 h 和18 h 后,采用LDH 试剂盒检测培养基中LDH含量。结果显示,随着作用时间的延长,LDH 含量总体呈上升趋势,与空白对照细胞相比,H9c2 细胞在受到Ts-Hsp70 蛋白刺激6 h 后LDH 含量极显著增加(P<0.01),在作用12 h 后LDH 含量达到峰值,约为空白对照组的3 倍(P<0.01),而LPS 阳性对照组中LDH 含量约为空白对照组的4 倍(图2)。表明Ts-Hsp70 对细胞有毒性作用。
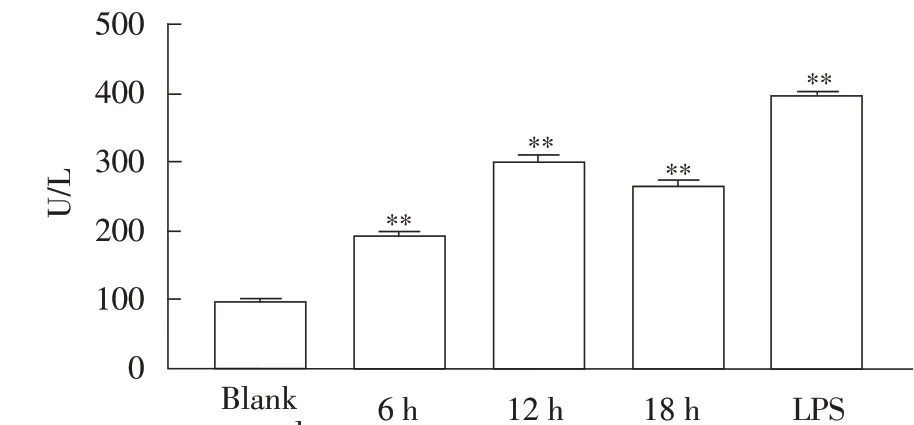
图2 Ts-Hsp70刺激H9c2细胞后的LDH含量测定结果Fig.2 Test results of LDH content in H9c2 cells stimulated by Ts-Hsp70
2.3 Ts-Hsp70 刺激H9c2 细胞后的CK 含量测定结果H9c2 细胞经60 μg/mL Ts-Hsp70 分别作用6 h、12 h 和18 h 后,采用CK 试剂盒检测培养基中CK 含量。结果显示,随着刺激时间的延长,CK 含量总体呈上升趋势,与空白对照组相比,H9c2 心肌细胞在受到Ts-Hsp70 作用6 h 后CK 含量极显著增加(P<0.01),在作用12 h 后CK 含量达到峰值(P<0.01),约为空白对照组的3.5 倍,LPS 阳性对照组中CK 含量约为空白对照组的4.5 倍(图3)。表明Ts-Hsp70 对细胞有损伤作用。

图3 Ts-Hsp70刺激H9c2细胞后的CK含量测定结果Fig.3 The results of CK content determination after TS-Hsp70 stimulation on H9c2 cells
2.4 Ts-Hsp70 刺激H9c2 细胞后ROS 的检测结果H9c2 细胞经60 μg/mL Ts-Hsp70 分别作用6 h、12 h 和18 h 后,采用ROS 试剂盒检测H9c2 细胞中ROS 的释放量。结果显示,与空白对照细胞相比,Ts-Hsp70作用后的H9c2 细胞内ROS 的荧光强度随着作用时间逐渐加强,LPS阳性对照组中荧光最强(图4)。表明Ts-Hsp70能够引起H9c2细胞中ROS的含量升高。

图4 Ts-Hsp70刺激H9c2细胞后释放ROS的荧光检测结果Fig.4 Immunofluorescence detection results of ROS release after TS-Hsp70 stimulation of H9c2 cells
2.5 Ts-Hsp70 刺激H9c2 细胞后细胞凋亡基因Bax、Bcl-2 转录及表达水平的检测结果采用qPCR 和western blot 两种方法检测Ts-Hsp70 对H9c2 细胞中Bax 和Bcl-2 产生的影响。结果显示,与空白对照细胞相比, Bax 转录水平随Ts-Hsp70 作用时间延长而增加,于作用12 h 达到峰值;而Bcl-2 含量随作用时间延长而减少,在作用12 h 时其转录水平极显著降低(P<0.01)。其中尤其以Bax/Bcl-2 的比值变化更为显著,呈极显著升高(P<0.01)(图5A)。从western blot 结果显示,与空白对照组相比,在作用后6 h 开始,细胞中Bax 的含量极显著升高(P<0.01),在刺激12 h 达峰值。LPS 阳性对照组中Bax 的含量约为对照组的3.6 倍(图5C);而Bcl-2 的含量整体呈下降趋势(图5B),与空白对照细胞相比,在刺激后6 h 开始,细胞中Bcl-2 的含量极显著降低(P<0.01),在刺激12 h 达到谷值,于刺激18 h 有所上升(图5C)。表明Ts-Hsp70 可通过线粒体凋亡途径诱导H9c2 细胞发生凋亡。

图5 Ts-Hsp70对H9c2细胞Bax和Bcl-2影响的检测结果Fig.5 Effects of Ts-Hsp70 on Bax and Bcl-2 in H9c2 cell
2.6 Ts-Hsp70 刺激H9c2 细胞后凋亡相关蛋白表达水平的检测结果Ts-Hsp70 刺激H9c2 细胞后,经western blot 检 测Cytochrome C、Pro-CASP-9、cl-CASP-9、Pro-CASP-3 及cl-CASP-3 蛋白水平表达,结果显示,与空白对照组相比,在刺激后6 h 开始,Cytochrome C 的含量极显著升高(P<0.01),在刺激12 h 达峰值,约为空白对照组的3.5 倍(图6B)。与空白对照细胞相比,在刺激后6 h 开始,Pro-CASP-9的含量极显著降低(P<0.01),于刺激12 h 达谷值(图6C);而cl-CASP-9 的含量在刺激后6 h 开始极显著升高(P<0.01),于刺激12 h 达峰值,约为对照组的2.8 倍(图6D)。与空白对照组相比,在刺激后6 h开始,Pro-CASP-3 的含量极显著降低(P<0.01),于刺激12 h达谷值(图6E);而cl-CASP-3的含量在刺激后6 h开始极显著升高(P<0.01),于刺激12 h达峰值,约为空白对照组的2.9 倍(图6F)。表明Ts-Hsp70 刺激H9c2 细胞后Cytochrome C 明显增加,激活了线粒体通路凋亡执行分子Caspase-9,引发下游凋亡因子Caspase-3 的激活,即激活了细胞线粒体的凋亡通路从而诱导细胞凋亡。

图6 Western blot检测线粒体凋亡相关基因的蛋白表达水平结果Fig.6 Western blot was used to detect the protein expression of mitochondrial apoptosis-related genes
3 讨 论
心肌炎是旋毛虫感染导致宿主死亡的最主要原因之一,旋毛虫幼虫在移行过程中可直接或间接引起宿主心肌损伤,旋毛虫分泌的有毒物质可随血液或淋巴液到达心脏并引起心脏病理改变,寄生虫感染过程中,机体与虫体皆处于应激状态,各自产生的HSP 相互抵抗,寄生虫产生的HSP 参与其分化、致病力及侵入过程[6],HSP70 是多种热应激蛋白中研究最多的一种蛋白,目前对于Ts-Hsp70 已有初步研究进展,Ts-Hsp70 为分泌型抗原,其在排泄分泌性抗原(Excretory-secretory antigen,ES)中存在。
研究表明,低浓度的Ts-Hsp70 通过与细菌LPS相似的TLR4/TLR2 路径刺激和活化树突状细胞引发抗旋毛虫感染的保护性免疫[10],高浓度的Ts-Hsp70对树突状细胞有毒性作用,也有研究显示弓形虫HSP70 可直接刺激肝脏诱发肝脏组织的氧化应激,致肝细胞坏死或凋亡[11]。CK 和LDH 是传统的心肌酶谱,CK 主要存在于细胞质和线粒体中,其活性测定可以在一定程度上反映心肌损伤的严重程度[12];LDH释放常被作为评估细胞毒性和检测细胞膜完整性的指标;ROS 升高可产生氧化应激,大量的活性氧不仅可以攻击细胞膜、各种细胞器,还可以破坏蛋白质、核酸等,最终导致细胞坏死或凋亡[13]。本研究发现高浓度的Ts-Hsp70 刺激大鼠H9c2 细胞后细胞上清液中CK、LDH 含量显著升高,于12 h 达峰值,表明Ts-Hsp70 可导致H9c2 细胞损伤,破坏H9c2 细胞膜完整性而释放LDH,促使心肌损伤标志性因子CK升高,其作用H9c2 细胞12 h 时对H9c2 细胞造成的损伤最大,细胞内的ROS含量也显著增加,大量的ROS可以破坏细胞膜、各种细胞器,进一步表明Ts-Hsp70 可导致H9c2 细胞损伤。
本研究还发现高浓度的Ts-Hsp70 可诱导大鼠H9c2 细胞发生凋亡。本研究结果显示,无论从基因转录水平还是蛋白表达水平来看,Bax 的含量均随着刺激时间增加整体呈上升趋势,而Bcl-2 的含量随着刺激时间增加整体呈下降趋势,Bax/Bcl-2 的比值则显著升高。Bax 分散于基质中,在受到凋亡刺激时,Bax 会快速迁移到线粒体膜上,发挥促凋亡作用,当Bax的表达量过高时可以破坏Bcl-2对细胞的保护促进细胞死亡,所以Bax与Bcl-2的比值对线粒体凋亡途径起重要调控作用[14-15]。因此,本研究结果表明Ts-Hsp70 可导致H9c2 细胞发生损伤,促使H9c2 细胞线粒体功能发生障碍。而线粒体功能发生障碍可导致细胞内的Cytochrome C 释放到细胞质中,释放到细胞质中的Cytochrome C 可激活Caspase-9、Caspase-3,最终促使细胞凋亡[16]。本研究发现经高浓度的Ts-Hsp70 作用大鼠H9c2 细胞12 h 后,Cytochrome C 的含量及Caspase-9、Caspase-3 的激活最为显著,该结果表明Ts-Hsp70 作用H9c2 细胞12 h 时对H9c2 细胞造成的损伤最大,且诱导H9c2 细胞发生内源性凋亡。Rui 等的研究表明Ts-Hsp70 是一种潜在的疫苗抗原,将其注射小鼠后,肌肉组织中肌肉幼虫数量减少了38.4%,并且诱导小鼠对旋毛虫感染产生了保护性免疫[17],出现这种情况极可能与其采用的HSP70浓度不一样,本研究也发现低浓度的Ts-Hsp70 对大鼠H9c2 细胞无损伤作用。
综上所述,本研究首次通过体外实验证明Ts-Hsp70 可引起大鼠心肌细胞损伤,并通过线粒体途径促进Caspase 级联反应,从而激活诱导H9c2 细胞发生内源性凋亡,该结果为下一步深入研究旋毛虫致心肌损伤分子机制提供了基础数据。

