雨生红球藻油柔性纳米脂质体冻干粉的制备与评价
张雨凝, 郑茗冉, 贾海强, 吴振, 刘智阳, 王立强
(1. 华侨大学 医学院, 福建 泉州 362021;2. 厦门大学 药学院, 福建 厦门361100;3. 贵州中铭生物科技有限公司, 贵州 贵阳 550001)
雨生红球藻油(haematococcus pluvialis oil,Hpo)是通过对雨生红球藻生物精炼除杂后得到的富含虾青素(Astaxanthin, ASTA)的深红色油状液体,不仅含有丰富的ASTA,而且还含有叶黄素[1]、生育酚[2]、植物甾醇[3]、大量的不饱和脂肪酸[4],是一种强效的抗氧化剂,具有丰富的生物活性,如抗癌、抗糖尿病、抗炎,以及保护神经、心血管、眼睛和皮肤等[5],可应用于化妆品、功能性食品、医药制剂、饲料等领域中,营养与药用价值极高.然而,Hpo及其有效成分ASTA不溶于水、稳定性[6]与皮肤渗透性差、生物利用度低等,严重限制了它的应用.
药物纳米载体不仅具有通过口服输送难溶性药物的潜力,而且在皮肤给药领域同样也具有很强的优势[7],特别是基于脂质的药物纳米载体[8].柔性纳米脂质体(flexible nano liposomes,FNL)指的是在普通脂质体磷脂双分子层的基础上加入不同的膜柔软剂,获得高度变形能力的一种新型脂质体[9].FNL作为一种生物相容纳米载体,本身安全无毒,不仅可以提高难溶性药物的溶解度,达到药物控释缓释的目的,促进药物的吸收,提高口服生物利用度,还可以利用其变形性,提高药物在皮肤角质层的透过率,可作为不同药物的透皮载体.基于此,本文制备一种雨生红球藻油柔性纳米脂质体冻干粉(Hpo-FNL-LP),为功能性油脂与ASTA纳米载体的研发与应用提供参考.
1 实验部分
1.1 实验仪器
1200型高效液相色谱仪(图像二极管阵列(DAD)检测器,美国安捷伦公司);超声波清洗仪(河南省巩义市予华仪器有限责任公司);VS-2500M型漩涡混合器(江苏省无锡市沃信仪器制造有限公司);真空干燥箱(广东省广州市深华生物技术有限公司);台式高速冷冻离心机(美国Thermo公司);紫外可见分光光度计(日本岛津公司);RYJ-6B型药物透皮扩散试验仪(上海市黄海药检仪器有限公司);RC-806D型溶出实验仪(天津市天大天发科技有限公司);纳米粒度及Zeta电位分析仪(美国布鲁克海文仪器公司);真空冷冻干燥机(北京市松源华兴生物技术有限公司)
1.2 实验试剂
雨生红球藻油、虾青素微囊粉(合肥省安徽市德宝生物科技有限公司);虾青素对照品、胆固醇、吐温-80、胰蛋白酶、胃蛋白酶、蔗糖、海藻糖、甘露醇、葡萄糖、乳糖、三氯醋酸钠、硫代巴比妥酸(上海市易恩化学技术有限公司);甲醇、石油醚、丙酮、正己烷、无水乙醚(广东省汕头市西陇化工股份有限公司);二氯甲烷、盐酸(北京市国药集团化学试剂有限公司);磷酸盐缓冲盐溶液、PEG-400(上海市阿拉丁生化科技有限公司);蛋黄卵磷脂PC-98T(上海市艾伟拓医药科技有限公司);氢氧化钠(上海市麦克林生化科技有限公司).
1.3 实验材料
27只SD大鼠(雄性大鼠,质量为200~250 g,购自福建省福州市吴氏试验动物研究中心,试验动物使用许可证号为SCXK(闽)2016-0002).
2 实验结果与分析
2.1 Hpo-FNL-LP的制备
采用熔融乳化法制备Hpo-FNL,将20.0 g·L-1(在磷酸盐缓冲溶液中,下同)的蛋黄卵磷脂与5.0 g·L-1的胆固醇放入烧杯中,加入5 mL无水乙醇超声溶解.将烧杯置于65 ℃水浴锅中,加热至溶剂完全挥发,加入2.2 g·L-1Hpo与12.1 g·L-1吐温-80,充分搅拌均匀后,再加入50 mL0.1 mol·L-1的磷酸盐缓冲溶液(pH=7.4).溶液超声至分散均匀后,将烧杯置于磁力搅拌器上恒温,搅拌30 min,过0.22 μm微孔滤膜整粒,即得Hpo-FNL.将Hpo-FNL转入样品瓶中,加入160.0 g·L-1甘露醇,经-80 ℃的冰箱冷冻24 h后,放入真空冷冻干燥机中干燥36 h,即得Hpo-FNL-LP.
2.2 ASTA体外质量浓度测定
2.2.1 吸收波长的测定 将甲醇-二氯甲烷(V(甲醇)∶V(二氯甲烷)=4∶1)溶液作为空白对照,使用紫外可见分光光度计对10.0 μg·mL-1的ASTA对照品溶液与Hpo-FNL-LP供试品溶液进行200~800 nm范围内扫描,测得ASTA的最大吸收波长为477 nm,且Hpo-FNL-LP中的其他成分对ASTA的吸收波长无干扰.
2.2.2 高效液相色谱条件 色谱柱为依利特Sino Chrom ODS-BP(4.6 mm×250.0 mm,5 μm),流动相为纯乙腈,检测波长为477 nm,流速为1.0 mL·min-1,进样量为20 μL.
2.2.3 专属性的考察 分别取ASTA对照品溶液、FNL-LP空白溶液和Hpo-FNL-LP供试品溶液,过0.45 μm微孔滤膜后,在节2.2.2色谱条件下检测,测得ASTA在对照品与供试品溶液中的保留时间基本一致,且空白对照无干扰.
2.2.4 线性关系 精密量取2.5 mg的ASTA对照品,用甲醇-二氯甲烷溶液溶解并定容至50 mL,得到50.0 μg·mL-1的ASTA对照品储备液.精密移取适量储备液,并加入甲醇-二氯甲烷溶液,依次稀释至4.5,4.0,3.5,3.0,2.5,2.0,1.5 μg·mL-1.
在节2.2.2色谱条件下进样检测,以峰面积为纵坐标(Y),以ASTA质量浓度为横坐标(x)进行线性回归,绘制标准曲线,线性回归方程为Y=284.26x+5.649 2,相关系数R2=0.999 8.结果表明,ASTA在1.5~4.5 μg·mL-1质量浓度范围内线性关系良好.
2.2.5 方法的考察 制备质量浓度为4.0 μg·mL-1的ASTA对照品溶液,在节2.2.2色谱条件下进行检测,连续测定6次,测定的相对标准偏差为0.09%,这说明该仪器精密度良好.平行配制6份4.0 μg·mL-1的ASTA对照品溶液,在节2.2.2色谱条件下进行检测,测得的相对标准偏差为1.33%,说明该方法具有较好的重现性.制备空白FNL-LP并分别加入适量ASTA对照品溶液,配制质量浓度分别为1.5,3.0和4.5 μg·mL-1的回收率供试品溶液各3份,过滤后,在节2.2.2色谱条件下进样检测,测得的回收率分别为(100.64±0.97)%,(99.99±1.17)%,(100.13±1.19)%,相对标准偏差分别为0.96%,1.17%,1.19%,说明该方法较准确.
2.3 Hpo-FNL-LP的质量评价
2.3.1 包封率 精密量取2.0 mL Hpo-FNL-LP复溶液于15 mL离心管内,加入3.0 mL石油醚,涡旋30 s后,在4 ℃,2 000 r·min-1的条件下离心5 min,取下清液加适量甲醇和二氯甲烷溶液破乳,在节2.2.2色谱条件下进行检测,根据标准曲线计算ASTA质量浓度,得到包封在脂质体里的药物质量浓度(ρ(包));另取同样量Hpo-FNL-LP直接加适量甲醇和二氯甲烷溶液破乳,在节2.2.2色谱条件下进行检测,根据标准曲线计算ASTA质量浓度,得到总的ATSA质量浓度(ρ(总)).Hpo-FNL-LP的包封率(δE)的计算公式为
(1)
测得的Hpo-FNL-LP的包封率为(89.16±1.21)%.2.3.2 载药量 量取一定质量的Hpo-FNL-LP,在一定体积(V)的25 ℃蒸馏水中复溶,待其完全溶解后,在节2.2.2色谱条件下进行检测,其载药量(W)的计算公式为
(2)
测得Hpo-FNL-LP的载药量为(1.34±0.04)%.
2.3.3 粒径及Zeta电位 粒径分布图,如图1所示.图1中:I为强度;d为粒径.通过纳米粒度及Zeta电位分析仪,直接测定复溶后的Hpo-FNL-LP的粒径、Zeta电位.测定得到的Hpo-FNL-LP的粒径为(165.75±0.11) nm,聚合物分散性的指数为(0.132±0.016),Zeta电位为-(18.45±0.48) mV.

图1 粒径分布图
2.3.4 形态的观察 Hpo-FNL与Hpo-FNL-LP的透射电镜图,如图2所示.由图2可知:Hpo-FNL外观为双层膜的圆形结构;Hpo-FNL-LP复溶后颗粒完整,粒径大小与冷冻干燥前无明显差别.

(a) Hpo-FNL (b) Hpo-FNL-LP
2.3.5 稳定性 将Hpo-FNL与Hpo-FNL-LP在4 ℃和25 ℃条件下放置30 d,并分别在0,5,10,20,30 d时进行渗漏率、粒径、丙二醛(MDA)质量浓度的测定,以考察稳定性.按2.3.1包封率测定方法计算Hpo-FNL-LP内包封的ASTA质量浓度,渗漏率(δP)计算公式为
(3)
式(3)中:ρ0为0 d时的Hpo-FNL内包封的ASTA质量浓度,ρt为td时的Hpo-FNL内包封的ASTA质量浓度.
Hpo-FNL,Hpo-FNL-LP稳定性结果,如表1所示.表1中:ts为储藏时间;θ为储藏温度;δP为泄漏率;c为浓度.

表1 Hpo-FNL,Hpo-FNL-LP稳定性结果
由表1可知:在4 ℃条件下储藏30 d时,Hpo-FNL的泄漏率与粒径均无明显变化,MDA的浓度增加0.96 mmol·L-1,而Hpo-FNL-LP泄漏率无明显变化,粒径随储藏时间延长稍有增大,MDA的浓度增加0.26 mmol·L-1;在25 ℃条件下储藏30 d时,Hpo-FNL泄漏率高达(25.88±0.45)%,粒径减小,MDA的浓度增加1.24 mmol·L-1,而Hpo-FNL-LP泄漏率为(7.62±0.73)%,粒径随储藏时间延长稍有增大,MDA浓度仅增加0.33 mmol·L-1;与Hpo-FNL相比,Hpo-FNL-LP的泄漏率与MDA浓度均降低,稳定性明显提高,可有效延长Hpo-FNL的储藏时间.
2.4 体外溶出评价
根据2020版《中华人民共和国药典》四部通则0931项溶出度和释放度测定法第2法(桨法)[10]进行体外溶出度测定.制备并精密量取Hpo-FNL-LP复溶液与雨生红球藻油乙醇溶液(Hpo-ES)各10.0 mL,将其装于预处理好的透析袋(相对分子质量为14 000)内.将透析袋分别置于装有400.0 mL释放介质的溶出仪中,释放介质为人工胃液(SGF,含质量分数为2.0%的吐温-80)与人工肠液(SIF,含质量分数为2.0%吐温-80),温度设定为(37.0±0.5) ℃,搅拌速度设定为100 r·min-1.
依次在0.25,0.5,1,2,4,8,12,24,48 h取样,每次取样2.0 mL并过0.45 μm微孔滤膜,同时补充等量释放介质,按照节2.2.1条件取滤液进行检测,并计算药物累计释放率.体外累计释放曲线,如图3所示.图3中:tr为释放时间;Q为累计释放量.由图3可知:在SIF,SGF中,Hpo-FNL-LP的释放明显较Hpo-ES缓慢(P<0.05),24 h释放比较迅速,6 h时累计释放率分别达到(45.89±1.83)%与(38.45±2.03)%,48 h累计释放率达到(93.71±1.21)%,(55.15±1.47)%.

图3 体外累计释放曲线图
2.5 体外透皮评价
2.5.1 离体皮肤的准备 将SD大鼠断颈处死后,先使用脱毛膏脱掉其腹部皮肤表面的毛发,脱毛过程不宜过长,否则会损伤皮肤,再使用刮毛刀剔除未脱净的毛发.剔除完毕后,剪下大鼠完整的腹部皮肤,将皮下脂肪组织全部切除,并保持整个皮肤的完整性.用生理盐水将皮肤洗净后浸泡其中,放入4 ℃的冰箱内保存,24 h内使用.
2.5.2 体外透皮试验 使用扩散池法测定体外透皮.将节2.5.1得到的大鼠腹部皮肤夹在立式扩散池中间,其角质层面朝释放池,真皮层面朝接受池.释放液分别为2.0 mL等质量浓度的Hpo-FNL-LP复溶液、雨生红球藻油普通脂质体冻干粉复溶液、雨生红球藻油(Hpo-OS)溶液,而接收液为质量分数40%的PEG-400生理盐水溶液.扩散池温度设定为(32.0±0.5) ℃,搅拌速度设定为300 r·min-1.
分别在1,2,3,4,6,8,10,12,24 h吸取接收液0.7 mL,并过0.45 μm滤膜,同时,补加等量接收液,取滤液在节2.2.2色谱条件下进行检测,并计算各时间的单位累计渗透量Qn(μg·cm-2).
单位累计渗透量曲线图,如图4所示.图4中:tp为渗透时间.由图4可知:Hpo-FNL-LP在前4 h内透皮迅速,24 h后单位累计渗透量达到(12.84±0.36) μg·cm-2,显著高于Hpo-LPO-LP与Hpo-OS组,说明用柔性纳米脂质体包载Hpo后更利于ASTA透过皮肤.

图4 单位累计渗透量曲线
2.5.3 皮肤滞留试验 将完成体外透皮实验后的大鼠腹部皮肤取出,用生理盐水溶液反复进行冲洗,去除皮肤表面残留的接收液和样品溶液,用滤纸吸干表面水分.剪碎鼠皮,并将其放入15 mL离心管中,加入3.0 mL甲醇-二氯甲烷溶液,涡旋30 s后,水浴超声30 min,3 000 r·min-1离心5 min,重复3次,合并上清液,在节2.2.2色谱条件下进行检测,并计算皮肤滞留量Qs(μg·cm2).


表2 皮肤滞留量实验结果
2.6 ASTA体内质量浓度测定方法
2.6.1 高效液相色谱条件 色谱柱为依利特SinoChrom ODS-BP(4.6 mm×250.0 mm,5 μm),流动相为V(甲醇)∶V(水)=90∶10,检测波长为477 nm,流速为1.0 mL·min-1,进样量为20 mL.
2.6.2 血浆样品的处理 取0.6 mL大鼠眼眶的血,将其置于1.5 mL含有肝素钠的离心管(EP)中,在4 ℃,3 500 r·min-1条件下离心10 min,取上清液,即得血浆,放-20 ℃的冰箱储藏备用.
取200.0 μL血浆置于1.5 mL的离心管中,加入1.0 mL的丙酮-正己烷(V(丙酮)∶V(正己烷)=1∶1)溶液,涡旋1 min后,10 000 r·min-1离心10 min,取上清液于3 mL离心管中,继续向残渣沉淀中加入1.0 mL丙酮-正己烷溶液,重复操作一次,合并上清液.在25 ℃下真空干燥至完全,用50 μL的甲醇-二氯甲烷溶液复溶,10 000 r·min-1离心10 min,取40.0 μL上清液进样检测.
2.6.3 专属性的考察 将大鼠空白血浆、含药血浆与体内血浆按节2.6.2方法处理后,在节2.6.1色谱条件下进样分析,空白血浆、含药血浆与体内血浆的HPLC图,分别如图5所示.图5中:S为电信号;tf为色谱柱流出物的流出时间.
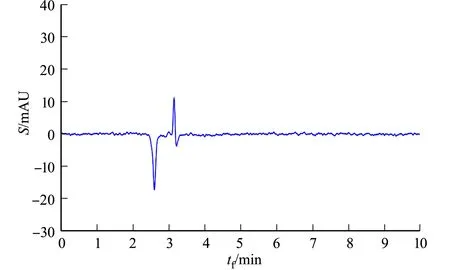
(a) 空白血浆
由图5可知:ASTA在6 min左右出现峰值,且血浆对其测定无干扰,峰型较好,表明该色谱条件下的体内分析方法专属性良好.
2.6.4 线性关系 配制质量浓度为0.012 5,0.025,0.075,0.125,0.175,0.250,0.375,0.500 μg·mL-1的大鼠含药血浆,经处理后分别在节2.6.1色谱条件下进样检测.以峰面积为纵坐标(Y),以ASTA质量浓度为横坐标(x)进行线性回归,线性回归方程为Y=354.37x+4.466 5,R2=0.999 1,表明体内血浆中ASTA在0.012 5~0.500 0 μg·mL-1质量浓度范围内线性关系良好.
2.6.5 方法的考察 制备质量浓度分别为12.5,125.0,500.0 ng·mL-1的3种低、中、高大鼠含药血浆,按节2.6.2方法处理血浆后,在节2.6.1色谱条件下进样分析.根据色谱条件进样检测,连续测定了6次,测定其相对标准偏差分别为1.76%,0.54%,1.33%,连续测定6 d,测定其相对标准偏差分别为3.25%,1.53%,0.91%,表明该方法日内、日间精密度良好.
制备上述3种质量浓度大鼠含药血浆各5份,分别于室温存放12 h,在-20 ℃的冰箱连续冻融3次,存放一个月后,按节2.6.2方法处理血浆后,在节2.6.1色谱条件下进样检测,测定其相对标准偏差分别为0.87%~4.35%,1.80%~3.91%,0.81%~3.78%,表明该方法稳定性良好.制备上述3种质量浓度的含药血浆各3份,按节2.6.2方法处理血浆后,在节2.6.1色谱条件下进样检测,测得血浆中ASTA回收率为100.47%~103.28%,相对标准偏差为1.37%~2.27%,表明该方法回收率良好,方法较准确,符合体内方法学的要求.
2.7 动物实验
精密量取适量ASTA对照品溶于植物油中,配制成质量浓度为3.0 g·L-1的ASTA-OS;精密量取适量Hpo溶于植物油中,配制质量浓度为3.0 g·L-1的Hpo-OS;精密量取适量市售虾青素微囊粉(ASTA-MSP),用蒸馏水溶解并定容至100 mL.
将24只健康的雄性SD大鼠随机分为4组(ASTA-OS组、Hpo-OS组、Hpo-FNL-LP组、ASTA-MSP溶液组,n=6),前两组按ASTA质量与大鼠的质量比为60 mg·kg-1灌胃给药,后两组按ASTA质量与大鼠的质量比为10 mg·kg-1灌胃给药,分别在0,0.5,1,2,4,6,8,10,12,24,36,48,60 h时,取眼眶血,按节2.6.2方法处理血浆后,在节2.6.1色谱条件下进样检测,大鼠体内的平均血药质量浓度-时间曲线,如图6所示.图6中:重复次数n=6;ρave为大鼠体内的平均血药质量浓度.

图6 大鼠体内的平均血药质量浓度-时间曲线
大鼠药代动力学参数,如表3所示.表3中:t1/2为半衰期;ρmax为血药达峰的质量浓度;AUC为给药时曲线下面积;tmax为达峰时间;tmr为平均滞留时间;F为生物利用率;与ASTA-OS组相比,其他组a表示P>0.05;与Hpo-OS组相比,其他组b表示P<0.01;与ASTA-MSP组相比,其他组c表示P<0.01.由表3可知:大鼠口服Hpo-FNL-LP与口服ASTA-OS,Hpo-OS,ASTA-MSP相比,消除半衰期t1/2延长,ρmax,tmax,AUC0-60均增大,相对生物利用度高达(422.53±3.30)%,显著高于ASTA-MSP与Hpo-OS组,说明Hpo-FNL-LP有效提高了ASTA的口服生物利用度.

表3 大鼠药代动力学参数
2.8 数据分析
3 讨论
脂质体为液体制剂,在长期储藏中存在磷脂氧化水解、芯材药物泄露、颗粒聚集产生沉淀等[11]现象,文献[12]表明,将脂质体通过冷冻干燥法固化成冻干粉,可有效提高其稳定性.稳定性实验结果表明,与冻干前的Hpo-FNL相比,Hpo-FNL-LP的泄漏率与脂质氧化程度明显降低,可有效延长Hpo-FNL的储藏时间.
体外溶出的实验结果表明,Hpo-FNL-LP的释放明显较Hpo-ES缓慢(P<0.01),不存在突释现象.这是由于体外释放曲线最符合一级动力学,具有一定缓释效果,且释放机制主要以Fick扩散机制为主[13-14].体外透皮与皮肤滞留量的实验结果表明,Hpo-FNL-LP在24 h的皮肤累计渗透量为(12.84±0.36) μg·cm-2,皮肤滞留量为(4.49±0.10) μg·cm-2.与Hpo-OS与Hpo-LPO-LP相比,Hpo-FNL-LP显著提高了ASTA的皮肤渗透性且增加了ASTA的皮肤滞留量,有利于其作为外用皮肤制剂,可预防皮肤老化与损伤,提高皮肤对紫外线的免疫功能.
口服药动学研究发现,即使ASTA-OS与Hpo-OS给药浓度是其他制剂的6倍,Hpo-FNL-LP与ASTA-MSP的ρmax,t1/2和AUC0-60仍显著大于ASTA-OS与Hpo-OS(P<0.01),表明两种制剂均极大延长了ASTA的体内吸收时间,并提高了吸收能力,在体内实现缓慢的释放,克服了ASTA口服生物利用度低的缺点,且Hpo-FNL-LP的相对生物利用度优于ASTA-MSP.原因可能是Hpo及其有效成分ASTA难溶于水,体内代谢快,不易被胃肠吸收.制成Hpo-FNL-LP或ASTA-MSP后,ASTA被脂膜或囊壳包裹,在水中以胶束的形式分散,极大提高了其水溶性,促进其吸收.其中,Hpo-FNL-LP特有的磷脂双分子层膜是一种类生物膜,具有极强的生物相容性,且其粒径比ASTA-MSP小,更容易分散,因此,生物利用度更高,将其以口服给药的方式应用,具有更广阔的前景.
制备的Hpo-FNL-LP显著提高了Hpo及其有效成分ASTA的水溶性、稳定性、皮肤渗透性,以及口服生物利用度,为功能性油脂与ASTA纳米载体的研究开发与应用提供参考.下一步将对其安全性进行研究,以确保Hpo-FNL-LP可安全地应用于各种领域中.

