五类马铃薯病毒实时荧光定量PCR检测方法的建立
阳 腾, 刘怒安, 刘聪聪, 陈恩发
(贵州省生物技术研究所, 贵阳 550006)
马铃薯(SolanumtuberosumL.)是世界四大粮食作物之一,块茎中富含淀粉、蛋白质、维生素、类胡萝卜素、花青素等营养成分[1-3],在巩固我国粮食安全和人民营养健康方面发挥着重要作用。病毒病是引起马铃薯减产的重要因素[4],可使马铃薯减产20%~50%,严重的达80%以上。感染病毒的马铃薯通过块茎无性繁殖进行世代积累和传递,致使块茎种性退化,产量下降。约40种病毒及类病毒可侵染马铃薯引发病害[5],马铃薯 X 病毒(PVX)、马铃薯 Y 病毒(PVY)、马铃薯 A 病毒(PVA)、马铃薯卷叶病(PLRV)、马铃薯 S 病毒(PVS)以及马铃薯纺锤状块茎类病毒(PSTVd)[4]是目前严重危害我国马铃薯产区的几类马铃薯病毒。
病毒检测技术是阻断病毒在马铃薯种薯中累积传播的重要手段,主要用于病毒检测的技术有免疫学方法和分子生物学方法。免疫学方法中的酶联免疫吸附剂测定法(ELISA)在病毒检测上应用较广泛[6-7],但存在耗时长、干扰因素多、易出现假阳性等缺点。实时荧光定量PCR(qRT-PCR)检测技术因其灵敏度高、特异性强、重复性好和可批量检测多种病毒等优点,已被运用于动物[8-9]、果树[10]等多物种的病毒检测中。
本研究根据马铃薯病毒序列设计特异性引物,并构建PVY、PVX、PVS、PSTVd、PLRV五种马铃薯病毒qRT-PCR检测方法,以期能提高病毒检测通量,提高病毒检测效率,促进马铃薯病毒检测技术的发展。
1 材料与方法
1.1 试验材料
本实验所用马铃薯(SolanumtuberosumL.)脱毒苗保存于贵州省农业科学院生物技术研究所种质资源库中。
1.2 DAS-ELISA
试剂盒购于瑞士BIOREBA公司,按试剂盒操作说明进行试验。
1.3 重组质粒标准品制备
RNA提取试剂盒购于ABI公司,按照试剂盒操作说明提取样品RNA,并测定浓度。反转录酶购自Promega,随机引物购自Takara,按照操作说明进行反转录。使用1 U Ex-Taq(Takara)进行25 μL体系的基因扩增,反应条件为95 ℃ 3 min,94 ℃ 30 s,53 ℃ 30 s,72 ℃ 40 s,72 ℃ 10 min,共30个循环,引物序列及扩增片段大小见表1。
取3 μL PCR扩增产物与PMD-19T载体连接,总体系10 μL,16 ℃过夜连接。使用CaCl2法制备E.coli DH 5 α 感受态菌,将载有目标片段的T 载通过热休克法转化至感受态 DH 5 α大肠杆菌中,并通过氨苄筛选培养基和蓝白斑法进行阳性克隆的筛选。运用碱裂解法抽提阳性单菌落质粒,双酶切(BamH I/Hind Ⅲ)和质粒PCR进行阳性验证。重组质粒于上海生工进行测序。
1.4 qRT-PCR
qRT-PCR荧光染料购于TAKARA公司,采用10 μL反应体系。反应条件:95 ℃ 3 min ,95 ℃ 20 s, 60 ℃ 1 min, 40个循环;反应结束后,进行65~95 ℃的熔解曲线分析,qRT-PCR所用引物序列见表2,由上海生工合成。
1.5 数据分析
数据采用Excel软件进行分析。
2 结果与分析
2.1 引物特异性检测
使用设计的荧光定量PCR引物(序列见表2)扩增对应的阳性质粒来验证引物的特异性(图1)。5对引物扩增条带均一,且没有引物二聚体条带,结果表明,设计的5对引物均能很好地扩增目的片段,可用于后续的实时荧光定量PCR检测。
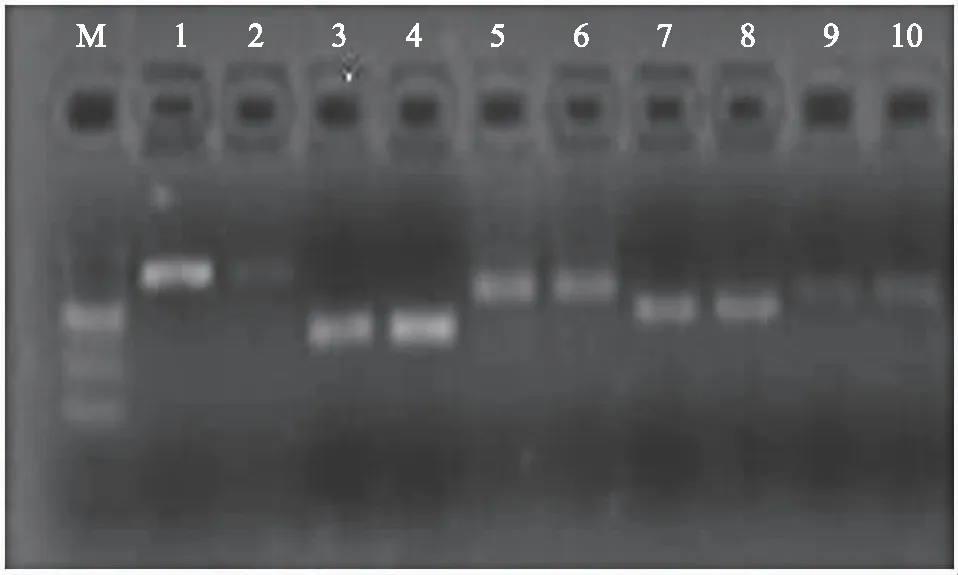
注:M为200 bp DNA maker;1和2为PLRV 149 bp;3和4为PVY 79 bp;5和6为PVS 117 bp;7和8为PVX 91 bp;9和10为PSTVd 114 bp。图1 五种马铃薯病毒引物特异性检测Fig.1 Primer-specific detection of five potato viruses
2.2 重组质粒标准曲线的建立
5种重组质粒经103~108倍稀释后,进行实时荧光定量PCR检测。以CT值为Y轴、所测质粒拷贝数对数为X轴,运用Excel软件制作标准曲线(图2),并得到标准曲线方程(表3)。
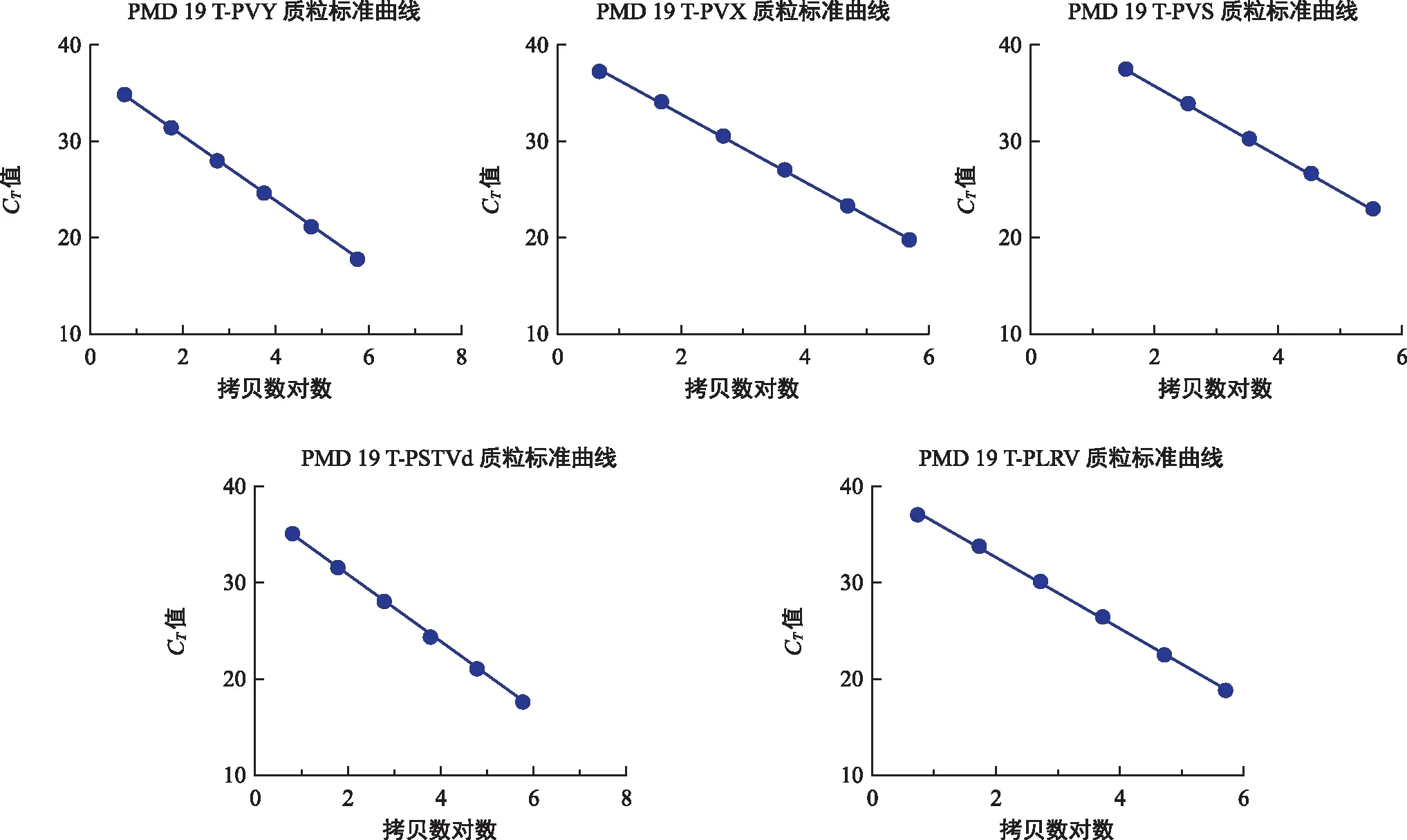
图2 五种重组质粒的标准曲线Fig.2 Standard curve of five recombinant plasmids
绘制的五组标准曲线方程的R2均接近1,表明在所测浓度范围内,阳性质粒拷贝数对数与对应的CT值线性相关度较高,可用于后续样品中病毒拷贝量的检测。

表3 重组质粒标准曲线方程Table 3 Recombinant plasmid standard curve equations
2.3 检测重复性与灵敏度分析
对每组质粒标准品进行了组内重复性分析,各组标准偏差均小于0.5,变异系数值均小于1.5%(表4),各组标准品不同浓度间组内重复性良好,表明五种马铃薯病毒qRT-PCR检测体系重复性好,可满足后续实验要求。
经测定,重组质粒PMD 19 T-PVY、PMD 19 T-PVX、PMD 19 T-PVS、PMD 19 T-PSTVd、PMD 19 T-PLRV初始浓度分别为2.38 ng/μL、2.03 ng/μL、1.46 ng/μL、2.44 ng/μL和2.22 ng/μL(表5)。经103~108倍稀释后,运用qRT-PCR技术进行检测。结果表明,qRT-PCR技术能检出重组质粒PMD 19 T-PVY、PMD 19 T-PVX、PMD 19 T-PVS、PMD 19 T-PSTVd、PMD 19 T-PLRV的最低浓度分别为5.74 copies/μL、4.89 copies/μL、3.52 copies/μL、5.88 copies/μL、5.35 copies/μL,此方法检测灵敏度较高。

表4 标准偏差与变异系数范围Table 4 Variation range of standard deviation and coefficient
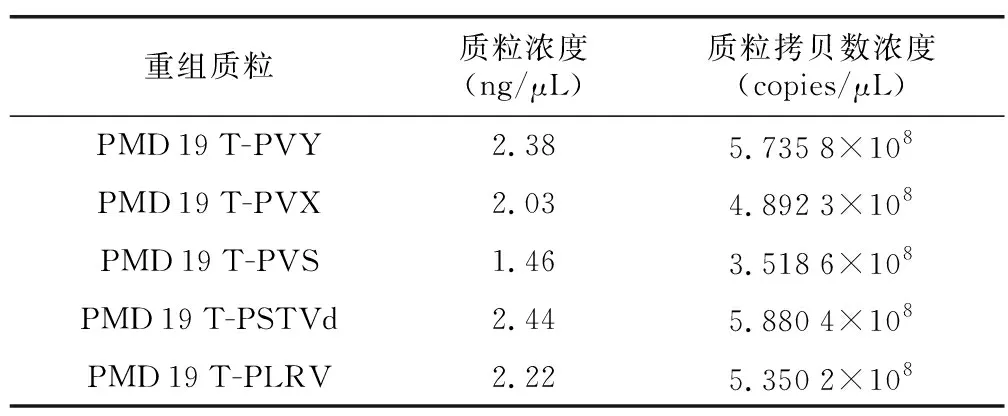
表5 质粒初始浓度(稀释倍数为1)Table 5 Table of initial plasmid concentration (dilution multiple 1)
2.4 样品检测
实验室保存的50份马铃薯脱毒菌苗被用于此qRT-PCR病毒检测,将获得的CT值代入对应的标准曲线求得样品中病毒拷贝数。结果表明(表6),保存的50株脱毒苗病毒检出阳性率分别为PVY 2%、PVX 6%、PVS 2%、PSTVd 0%、PLRV 4%;阳性样品中病毒的拷贝数(范围)依次为:PVY 217 copies/μL、PVX (525~68)copies/μL、PVS 354 copies/μL、PSTVd 0 copies/μL、PLRV (221~179)copies/μL(表6)。
同时运用ELISA法检测同一批马铃薯脱毒苗样品,PVY、PLRV、PSTVd、PVS四种病毒检出阳性率结果与qRT-PCR法一致,而PVX阳性检出率较qRT-PCR法检测结果偏低,为4%(表6)。
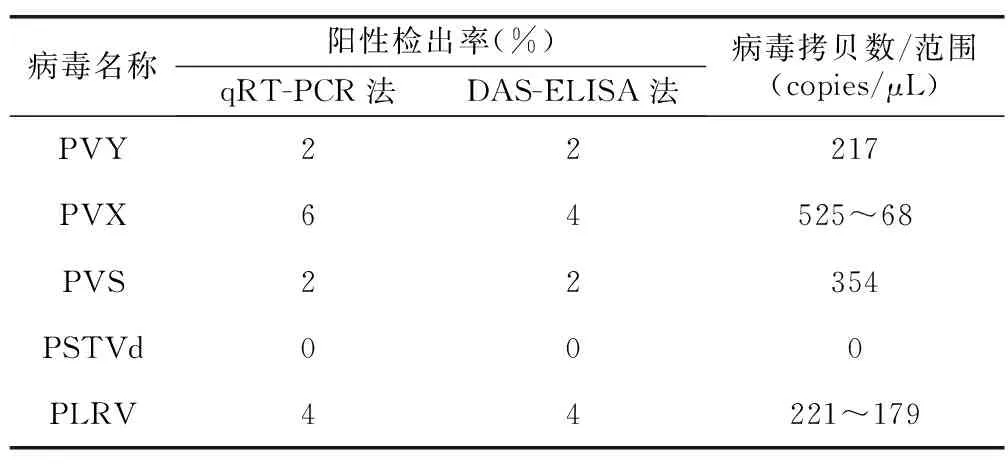
表6 qRT-PCR法与DAS-ELISA法样品检测比较Table 6 Comparison of sample detection by qRT-PCR method and DAS-ELISA method
3 讨 论
马铃薯病毒病是马铃薯的主要病害,在我国大部分地区均有发生。已感染病毒的马铃薯可通过营养器官无性繁殖世代积累和传递病毒,最终将引起马铃薯种性退化、生长繁殖受阻、产量下降等现象[11]。快速高效的病毒检测技术能够及时筛选出带毒株系,有效阻断病毒在马铃薯种薯中的累积传播。
ELISA法是目前应用较为广泛的马铃薯病毒检测技术[12-13],主要通过病毒与特异性抗体结合,固定病毒颗粒,并利用酶与底物的显色反应来进行病毒检测,但存在耗时较长、干扰因素多、易出现假阳性等缺点。qRT-PCR在病毒检测方面具有较大的潜力,它省略了常规PCR后的繁琐操作,可批量检测多种病毒并对反应产物实时监测,操作简单、灵敏度高、重复性好,已逐步应用于动植物病毒的检测[8-10]。本研究通过两种方法对保存的脱毒马铃薯苗中5种病毒进行检测,PVX含量有差异(表6),qRT-PCR阳性检出率为6%,而DAS-ELISA法阳性检出率为4%,推测是由于部分样品中PVX病毒含量较低,未达到DAS-ELISA法检测限度[14]。同时也表明,qRT-PCR法的灵敏度比DAS-ELISA法高。
本实验室保存的脱毒苗PSTVd脱毒较为彻底,而PVY、PVX、PLRV、PVS这四种病毒的脱除还有待加强,脱毒苗在保存、继代、扩繁期间仍有可能重新感染病毒。脱毒技术、继代扩繁等操作均可影响马铃薯病毒携带率[15]。因此,脱毒苗的生产与保存过程中,还应注意定期对脱毒苗进行病毒检测,确保脱毒苗的品质。
——一道江苏高考题的奥秘解读和拓展

