囊腔液mtDNA水平对0PN来源囊胚发育速度的影响
赵海静,袁萍,黄佳,邱绮,张清学,王文军
(中山大学孙逸仙纪念医院生殖中心,广州 510120)
在常规体外受精(IVF)过程中,原核观察是目前评估受精与否的常用方法。通常在授精后16~20 h于倒置显微镜下观察,正常受精卵有两个清晰原核(2PN),不具有2PN的均为异常受精。在光学显微镜下,异常受精的表现形式主要有:零原核(0PN)、单原核(1PN)和多原核(多PN)受精卵。IVF过程中约30%的卵母细胞表现为0PN受精,其原因可能是卵母细胞受精失败,也可能是雌雄原核过早融合,导致原核消失[1]。如未观察到原核的受精卵在后续发育中其卵裂速度及卵裂球形态与观察到2PN的受精卵发育而来的胚胎没有差异,称之为0PN来源胚胎[1]。依据欧洲人类生殖与胚胎学会实验室指南,不建议移植0PN来源胚胎[2]。然而大量的细胞遗传学分析结果显示,部分0PN来源胚胎为二倍体胚胎,并且有4.4%~37.2%的0PN来源胚胎能够发育为优质囊胚[3-5]。这些研究表明0PN来源胚胎仍具有一定的临床应用价值。因此,我中心对于0PN来源胚胎(本文中所提及的0PN来源胚胎特指0PN来源卵裂期胚胎)的处理是,如果第3天(D3)发育到4细胞及以上,则进行囊胚培养,如D5或D6形成评分3CC以上囊胚者视为可利用囊胚,进行冷冻保存。
近期的一项荟萃分析显示,无论是新鲜周期还是冻融周期,D5囊胚移植的种植率、临床妊娠率及出生率均显著优于D6囊胚[6]。此外,仅对于整倍体囊胚移植的研究也表明,D5囊胚的移植结局显著优于D6囊胚[7-8]。这些结论提示我们,除了内膜和染色体因素,还有其他重要因子影响着D6囊胚的潜能和发育。最近,滋养层细胞中线粒体DNA(mtDNA)数量被认为是胚胎选择的另一个潜在标记物。Wu等[9]的研究结果表明,相同倍性D5囊胚中滋养层细胞mtDNA数量显著多于D6囊胚(P<0.05);在妊娠结局相同的情况下,移植的D5囊胚中滋养层细胞mtDNA数量也显著多于移植的D6囊胚(P<0.05),因此他们认为mtDNA数量可能是影响囊胚发育速度的一个关键因素。有趣的是,发育速度快的D5囊胚中mtDNA数量显著多于发育速度慢的D5囊胚(P<0.05),D6囊胚中mtDNA数量亦呈现同样的趋势[10-11],这进一步体现了mtDNA数量在囊胚发育速度中的作用。但目前关于IVF中0PN来源囊胚的mtDNA数量与其发育速度之间的关系尚未见报导。
近年来,基于滋养层细胞活检的植入前遗传学检测(PGT)广泛用于胚胎非整倍体筛查。然而,滋养层细胞活检的局限性在于:(1)对胚胎的有创活检可能会降低其发育潜能;(2)要求胚胎学家具有丰富经验和娴熟技术;(3)活检操作过程复杂;(4)由于内细胞团未经过检测,嵌合体容易导致假阴性或假阳性结果;(5)活检的长期生物安全性尚未评估[12-16]。而基于废弃囊胚培养液的无创PGT也存在一些缺点,因为废弃囊胚培养液比囊腔液具有更高的母源污染(颗粒细胞)风险,尤其是囊胚阶段的废弃培养液中会检测到更高水平的母源核DNA[17-18]。在滋养层细胞连接处进行激光打孔以释放囊腔液或使用注射针抽吸来获取囊腔液[19-20],并以囊腔液为样本进行mtDNA数量检测的方法创伤小、操作简易,还能有效避免母源颗粒细胞污染。因此,本研究首次以囊腔液为样本,对IVF中0PN来源囊胚的mtDNA水平进行检测及综合分析,并进一步探索0PN来源囊胚中mtDNA水平与其发育速度之间的关系。
资料与方法
一、研究对象
回顾性分析2019年11月至2021年8月在本中心行常规IVF助孕治疗的66对夫妇的临床资料。纳入标准:(1)D1原核观察为0PN;(2)D5或D6囊胚评级为3CC级以上;(3)D5或D6囊胚留取囊腔液行整倍体检测及mtDNA水平检测;(4)男女双方相关检测及资料完整。排除标准:(1)D1的原核观察为1PN、2PN、3PN或多PN;(2)D1卵母细胞形态学观察为MI、GV期、出现退化或空透明带;(3)D5或D6囊胚评级为3CC级及以下。本研究中所有样本的使用均进行了充分地知情告知,并签署知情同意书,且研究的开展获得了医院伦理委员会的审批通过。
本研究共纳入66个助孕治疗周期中的109枚0PN来源囊胚。根据囊胚发育速度不同进行分组,分为D5-0PN囊胚组(0PN来源胚胎在D5发育为可冷冻囊胚者,n=87)、D6-0PN囊胚组(0PN来源胚胎在D6发育为可冷冻囊胚者,n=22)。
二、研究方法
1.控制性促排卵(COH)及取卵:入组患者采用长方案或拮抗剂方案进行促排卵。阴道B超监测卵泡生长情况,当B超监测有1~2个卵泡直径≥18 mm时给予肌肉注射HCG(珠海丽珠)10 000 U,注射后36~38 h在阴道B超引导下穿刺取卵。在体视显微镜下收集卵泡液中卵丘-卵母细胞复合物,并置于G-IVF液(Vitrolife,瑞典)中培养。
2.精液收集及处理:取卵当天男方以手淫法采集精液。待精液液化后,通过密度梯度离心及上游法处理,并调至统一的受精浓度(本中心所用浓度为0.3×106/ml)。
3.体外授精及原核观察:卵母细胞经体外培养4~6 h进行IVF人工授精。授精16~20 h后进行原核观察,未见原核者记录为0PN,可见两个原核者为2PN。
4.胚胎培养及发育评估:D1拆除颗粒细胞后,将胚胎转移至G1-plus(Vitrolife,瑞典)培养液中,置于37℃、6%CO2、5%O2培养箱中培养。D3将胚胎转移至G2-plus(Vitrolife,瑞典)培养液中进行囊胚培养。D5和D6分别评估囊胚发育,依据Gardner和Schoolcraft的评分系统[21],综合囊胚扩张状态、内细胞团和滋养层细胞的发育对囊胚质量进行全面评估。根据囊胚腔的大小和是否孵出将囊胚发育分为6个时期:1期:早期有腔室囊胚,囊胚腔体积小于胚胎总体积的1/2;2期:囊胚腔体积大于或等于胚胎总体积的1/2;3期:扩张囊胚,囊胚腔完全占据了胚胎的总体积;4期:囊胚腔完全充满胚胎,胚胎总体积变大,透明带变薄;5期:正在孵出,囊胚的一部分从透明带中逸出;6期:孵出囊胚,囊胚全部从透明带中逸出。处于3~6期的囊胚,还需对内细胞团和滋养层细胞进行质量分级。其中,内细胞团分级:A级:细胞数目多,排列紧密;B级:细胞数目少,排列松散;C级:细胞数目很少。滋养层细胞分级:A级:上皮细胞层由较多的细胞组成,结构致密;B级:上皮细胞层由不多的细胞组成,结构松散;C级:上皮细胞层由稀疏的细胞组成,细胞很少。本中心可利用囊胚的定义为:透明带扩张程度≥3且内细胞团和滋养层细胞评分为CC以上;优质囊胚的定义为:透明带扩张程度≥3且内细胞团和滋养层细胞评分为BB及以上。
5.囊腔液收集:为了避免母源颗粒细胞污染,将D3的0PN来源胚胎转移到不同的G2-plus液滴(预平衡)中润洗多次以除去透明带上的颗粒细胞,再移入新的G2-plus液滴中进行囊胚培养。D5或D6丢弃最初用于囊胚培养的液滴,将0PN来源囊胚转移到不同的新鲜G2-plus液滴(预平衡)中润洗3次以再次完全除去透明带上松散的颗粒细胞,随后把0PN来源囊胚转移到另一个新鲜的15 μl G2-plus液滴中,用200 μs激光脉冲(LYKOS,Hamilton Thorne,美国)在滋养层细胞连接处打孔以释放囊腔液。激光打孔4~6 h后,将0PN来源囊胚进行玻璃化冷冻,收集囊腔液与G2-plus液滴的混合液装入含有5 μl磷酸盐缓冲液(PBS)的无RNAse/DNAse小管中(江苏亿康基因)(具体收集方法参考Jiao等[19]的方法),做好样本标记后置于-80℃冰箱保存,之后将冷冻样本交由江苏亿康基因公司进行后续检测。使用未经胚胎培养的G2-plus液滴作为阴性对照。
6.0PN来源囊胚染色体整倍体及mtDNA含量检测:使用基于单细胞的多次退火环状循环扩增技术(简称MALBAC)对囊腔液样本进行全基因组扩增(江苏亿康基因)。通过NextSeq550测序仪(Illumina,美国)进行第二代测序分析,用于全面染色体筛查。以常染色体扩增拷贝为基础,根据测序比对的序列数和区域数来分析单核基因组下线粒体的拷贝。线粒体含量以拷贝数/核基因组的形式进行量化。对比对到线粒体基因组的测序读取序列进行计数,并通过比对到常染色体的读取序列计数进行均一化,参考前期文献[22]公式计算每个核基因组的线粒体拷贝数。
7.观察指标:记录两组患者的年龄、不孕年限、体质量指数(BMI)、基础生殖激素(FSH、LH、E2)水平、抗苗勒管激素(AMH)、基础窦卵泡计数(AFC)、Gn总量、获卵数、精子正常形态率、顶体酶活性、囊胚整倍体率、优质囊胚率及囊腔液mtDNA数量。
三、统计学分析

结 果
一、患者一般资料分析
比较D5-0PN囊胚组与D6-0PN囊胚组患者的基本信息和临床资料,结果显示D5-0PN囊胚组的女方年龄和Gn总量均显著低于D6-0PN囊胚组(P<0.05),D5-0PN囊胚组的男方年龄极显著低于D6-0PN囊胚组(P<0.01)。两组患者的不孕年限、BMI、基础生殖激素(FSH、LH、E2)水平等均无统计学差异(P>0.05)(表1)。
二、D5-0PN囊胚与D6-0PN囊胚整倍体率、优质囊胚率及女方高龄率比较
D5-0PN囊胚和D6-0PN囊胚的整倍体率比较无显著性差异(P>0.05);D5-0PN囊胚组的优质囊胚率极显著高于D6-0PN囊胚组(P<0.01)。为了排除女方高龄对mtDNA水平的影响,参照之前的文献[9,23]选择40岁作为本研究中高龄女性的界限,比较两组间来自高龄女性(≥40岁)的囊胚比例,结果无显著性差异(P>0.05)(表2)。
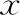
表1 两组患者一般资料比较(-±s)

表2 D5-0PN囊胚与D6-0PN囊胚的整倍体率、优质囊胚率及高龄率比较(%)
三、不同分层下D5-0PN囊胚与D6-0PN囊胚mtDNA水平比较
比较整倍体囊胚与非整倍体囊胚、<40岁与≥40岁女性、优质囊胚与非优质囊胚中mtDNA的水平。D5-0PN囊胚中整倍体囊胚35枚,D6-0PN囊胚中整倍体囊胚11枚;在相同倍性(均为整倍体或均为非整倍体)情况下,D5-0PN囊胚的mtDNA水平均略高于D6-0PN囊胚,但尚无显著性差异(P>0.05)。D5-0PN囊胚中来源于<40岁女性者85枚,D6-0PN囊胚中来源于<40岁女性者20枚;在相同的囊胚发育时期,<40岁女性与≥40岁女性的0PN来源囊胚中mtDNA数量无显著性差异(P>0.05);但无论<40岁或≥40岁女性,其D5-0PN囊胚中mtDNA水平均略高于D6-0PN囊胚(P>0.05)。D5-0PN囊胚中优质囊胚(评级≥3BB)58枚,D6-0PN囊胚中优质囊胚6枚;在相同发育时期,优质0PN来源囊胚中mtDNA水平略高于非优质0PN来源囊胚,但尚无显著性差异(P>0.05);且无论囊胚质量如何,D5-0PN囊胚中mtDNA水平均略高于D6-0PN囊胚(P>0.05)(表3)。
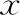
表3 不同分层下D5-0PN囊胚与D6-0PN囊胚mtDNA水平比较(-±s)
讨 论
0PN来源胚胎的临床应用价值一直存在争议,因为无法确定0PN来源胚胎源自于正常受精或异常受精[24]。我们中心的常规策略是将0PN来源胚胎进行囊胚培养,若形成可利用囊胚则冷冻保存。在患者无2PN来源囊胚可移植的情况下,移植0PN来源囊胚以增加妊娠机会。考虑到0PN可能为异常受精,所以0PN来源胚胎的移植应该尽可能地结合PGT[5]。目前广泛应用的PGT方法是对囊胚滋养层细胞进行活检,然而这种方法存在活检工作量大、耗费成本较高、有创、取样有偏倚(只检测滋养层细胞而没有检测内细胞团)等缺点[25]。废弃囊胚培养液是无创PGT的首选材料,但具有较高的母源颗粒细胞污染风险,并且会检测到更高水平的母源核DNA[17-18]。因此本研究选择以囊腔液为样本来分析0PN来源囊胚的染色体状态。
滋养层细胞或培养液中mtDNA数量被认为是胚胎选择的另一个潜在标记物[9,26]。早期胚胎中mtDNA数量的差异很可能起源于相应的卵母细胞[22]。有研究表明,卵母细胞质量与其所含有的mtDNA数量有着内在联系。卵巢功能下降或高龄女性的卵母细胞中mtDNA数量显著低于卵巢功能正常或年轻女性[27-29]。此外,未受精卵母细胞中mtDNA拷贝数也显著低于受精卵母细胞[30-32],退化卵母细胞则含有更少的mtDNA[32]。mtDNA数量较多的卵母细胞具有更高的发育潜能[33],卵母细胞中线粒体储备下降将引起植入前胚胎能量不足,进而导致胚胎发育阻滞[34]。充足的mtDNA水平提示卵母细胞质量好,这不仅有益于成功受精,而且对后期的胚胎发育至关重要。在胚胎发育过程中,线粒体平均分布于每个卵裂球,但是在囊胚阶段之前,线粒体总数相对稳定[35],同样线粒体的活性也相对稳定[34]。当胚胎发育到囊胚阶段时,mtDNA大量复制,表明线粒体已完成从静止到激活的转变[36-37]。因此,我们推测囊胚期mtDNA数量也许有着某种重要的意义,同时启发我们关注囊腔液中mtDNA水平。
Ho等[38]研究认为,从活检的每个滋养层细胞中获得的mtDNA拷贝数与从整个胚胎获得的mtDNA拷贝数相当。这一研究证实了我们以囊腔液为样本对0PN来源囊胚中mtDNA数量进行检测及综合分析的可行性。在Wu等[9]的报道中,调整了胚胎倍性、移植结局、女方年龄和囊胚质量这些混杂因素后,D5囊胚中mtDNA数量仍显著高于D6囊胚(P<0.05)。我们的研究结果表现出了相似的趋势:在相同倍性、女方年龄、囊胚质量的情况下,D5-0PN来源囊胚中mtDNA水平均有高于D6-0PN来源囊胚的趋势,虽然尚无显著性差异(P>0.05)。
有研究表明,囊腔液中游离DNA含量与胚胎等级呈正相关[39],而游离DNA由核DNA(nDNA)和mtDNA组成[40]。此外,Stigliani等[26]对人类胚胎的研究显示,D3培养液中较高的mtDNA/nDNA比例提示较高的胚胎发育潜能。因此我们推测囊腔液中mtDNA含量可能与胚胎质量呈正相关。本研究中我们的数据显示,D5-0PN来源囊胚中mtDNA水平略高于D6-0PN来源囊胚,同时D5-0PN囊胚组的优质囊胚率极显著高于D6-0PN囊胚组(P<0.01);无论D5或D6,优质0PN来源囊胚的mtDNA水平均略高于非优质0PN来源囊胚;这些结果与我们的推测相符。
Wu等[9]认为影响囊胚发育速度的关键机制之一是卵母细胞中含有的最初mtDNA数量。那些含有充足mtDNA的卵母细胞将会“及时”形成囊胚,而那些mtDNA数量相对少的卵母细胞则需要额外时间以完成囊胚的发育过程。因此他们推测D6囊胚最初来源于mtDNA数量相对少的卵母细胞,由于能量不充足,所以需要额外1 d的时间去形成囊胚。这同样适用于解释0PN来源囊胚中mtDNA水平与其囊胚发育速度之间的关系。
综上,本研究首次全面分析了囊腔液mtDNA水平与IVF中0PN来源囊胚发育速度之间的关系。综合考虑胚胎倍性、女方年龄和囊胚质量等因素后,D5-0PN来源囊胚中mtDNA水平有高于D6-0PN来源囊胚的趋势,提示mtDNA数量可能是影响0PN来源囊胚发育速度的一个关键因素,较低的mtDNA水平可能与0PN来源囊胚发育延迟相关。本研究的局限性在于样本量较少,将来需要开展更大样本量的研究以验证本文的结论,从而更加深入地阐述0PN来源囊胚中mtDNA水平与其发育速度之间的关系。

