围隔生境下养殖密度对菲律宾蛤仔生长的影响❋
潘渊博, 孙秀俊, 郭 贺, 林忠洲, 徐建峰, 周成旭❋❋
(1.宁波大学,浙江 宁波 315211;2.中国水产科学研究院黄海水产研究所,山东 青岛 266071;3.福建省连江县水产技术推广站,福建 连江 350500)
养殖密度是贝类养殖生产管理的重要因素之一,影响着贝类的生长、产量和品质[1-2]。合理的养殖密度也是科学利用滩涂、优化养殖格局、保护养殖环境的重要途径[3]。贝类养殖生产全过程分为不同的阶段,例如育苗期、稚贝中间培育期和成贝养殖期等,贝类个体生长呈现阶段性的特征和规律。因此,探明养殖密度对贝类不同阶段个体生长的影响特征,这对养殖生产管理具有重要的指导意义。目前,研究养殖密度对贝类个体生长的影响主要集中在其早期发育阶段[4-6],而对受多重环境影响的幼贝和成贝生长特征的研究相对较少。
生长模型采用数学方程,定量描述贝类质量、相对体积和形态参数等生长性状的变化规律,是反映不同养殖条件下贝类个体生长规律的有效工具[7-8]。通过对贝类个体生长数据的曲线拟合,可揭示复杂环境下贝类个体生长的定量规律。研究发现,企鹅珍珠贝(Pteriapenguin)贝苗阶段的最优生长模型为Gompertz模型[9];紫贻贝(Mytilusedulis)不同生长阶段分别符合Gompertz和Von Bertalanffy生长模型,呈阶段性的生长特征[10]。虽然养殖密度是影响贝类个体生长特征的重要因素,但养殖密度对大多数贝类个体生长特征的影响尚不明确。不同养殖密度造成多重环境因子相应变化,贝类个体生长受到多因子的综合影响,因此,通过研究贝类的个体生长特征,可为深入研究贝类的密度效应、机制以及优化养殖容量评估模型提供参考。
菲律宾蛤仔(Ruditapesphilippiharum)是中国重要的养殖贝类,南北方沿海均有养殖[11]。目前,国内学者已开展了一些海域中菲律宾蛤仔的适养密度和养殖容量研究[12-13]以及培育密度对菲律宾蛤仔稚贝生长、成活率影响的研究[14]。随着海洋环境不断变化,不同海域、不同养殖场景下,养殖密度造成的养殖综合环境条件不同,对贝类个体生长的影响及密度效应机制尚需更多研究。
本研究在福建定海湾菲律宾蛤仔养殖滩涂建立围隔,设置低、中、高密度实验组,通过解析菲律宾蛤仔个体生长曲线特征,研究了该围隔场景下养殖密度对菲律宾蛤仔个体生长的影响。
1 材料与方法
1.1 野外围隔实验设置
于福建定海湾菲律宾蛤仔养殖区滩涂(26.2°N,119.6°E)设置围隔实验系统(见图1)。于潮间带养殖区的滩涂上埋置塑料框以构建围隔系统,每个围隔底面积为2.6 m2,根据菲律宾蛤仔的栖息特征,铺以厚约0.3 m的原位挖掘的泥沙底质。退潮时,围隔内蓄水深约0.7 m,涨潮时水完全淹没养殖箱。各养殖箱上覆纱网,以避免菲律宾蛤仔被摄食,每月清理纱网及养殖箱壁上的藤壶类污附生物2~3次。

((C)图中L1~L3为低密度组;M1~M3为中密度组;H1~H3为高密度组;K1~K3为无养殖组。In figure(C)L1~L3 represent low density; M1~M3 represent medium density; H1~H3 represent high density; K1~K3 represent control.)
2019年7月开始实验,12月初结束,养殖周期共150 d。各实验组投放的贝类采自定海湾菲律宾蛤仔生产养殖区,其规格为:平均壳长(22.0±1.8)mm,平均壳宽(1.5±1.2)mm,平均壳高(9.0±0.7)mm。
参考当地菲律宾蛤仔的实际养殖密度,设置了低、中、高三种养殖密度。中密度组(M)与同海区实际生产养殖密度相当,密度为700 粒/m2;高密度组(H):2倍于M组的养殖密度,投放密度为1 400粒/m2;低密度组(L):1/2倍M组的密度,投放密度为350 粒/m2。设置一个无养殖的对照组(K)。各组设置3个平行实验组。
1.2 菲律宾蛤仔样品采集和水质环境因子监测
于2019年7月6日、8月3日、9月6日、10月15日、12月3日退潮时,采集各实验组的菲律宾蛤仔样品,并同时检测各养殖箱中水质参数。
采样过程中,各围隔内挖取20个蛤仔,用干净海水清洗蛤仔表面泥沙,用游标卡尺测量形态性状(壳长、壳宽、壳高,精密度0.1 mm),用电子天平测量体质量(带壳湿重);用便携式水质仪(Horiba U52G)及YSI水质仪分析仪检测各组水温、盐度、pH、溶解氧、叶绿素a等水质参数。
1.3 相对增产率和生长率的计算
相对增产率=[(实验结束时菲律宾蛤仔总质量+实验取样总质量-实验开始时菲律宾蛤仔投入总质量)/实验开始时菲律宾蛤仔投入总质量]×100%。
体积(长×宽×高)相对生长率=(当月抽样平均个体体积-前月抽样平均个体体积)/前月抽样平均个体体积;
体质量相对增长率=(当月平均体质量-前月平均体质量)/前月平均体质量。
1.4 个体生长模型的曲线模拟
选择3种贝类常用的生长模型对菲律宾蛤仔生长曲线进行拟合。
Von Bertalanffy生长模型:y=A(1-Be-kt)3;
(1)
其中,拐点处质量/相对体积y=8A/27,拐点日龄t=(ln 3B)/k。
Gompertz生长模型:y=Ae-Bexp(-kt);
(2)
其中,拐点处质量/相对体积y=A/e,拐点日龄t=(lnB)/k。
Logistic生长模型:y=A/(1+Be-kt);
(3)
其中,拐点处质量/相对体积y=A/2,拐点日龄t=(lnB)/k。
上述各式中:A为总生长量或生长极限;B为增长初始值参数;K为瞬时增长速率。
采用SPSS25.0软件进行数据处理及模型构建。根据菲律宾蛤仔的实际生长情况及经验,预设A、B和k初始值。选择Levenberg-Marquardt迭代法[15]估计生长参数,迭代精度设定为10-8,当各待估生长参数前后两次迭代结果的相对误差与误差平方和的相对误差都小于1×10-8时运算结束,最后以收敛的结果作为参数的最终估计值。以拟合度R2作为衡量拟合指标优劣的标准。
1.5 数据统计分析
数据结果为实验三重复的平均值±标准误差。用Origin 2019和SPSS 25绘图。使用SPSS25进行单向方差分析(One-way ANOVA),在方差分析结果显著时(P<0.05),采用多重比较(LSD法)进行组间的显著性比较。
2 结果与分析
2.1 不同养殖密度组中水质环境因子的变化
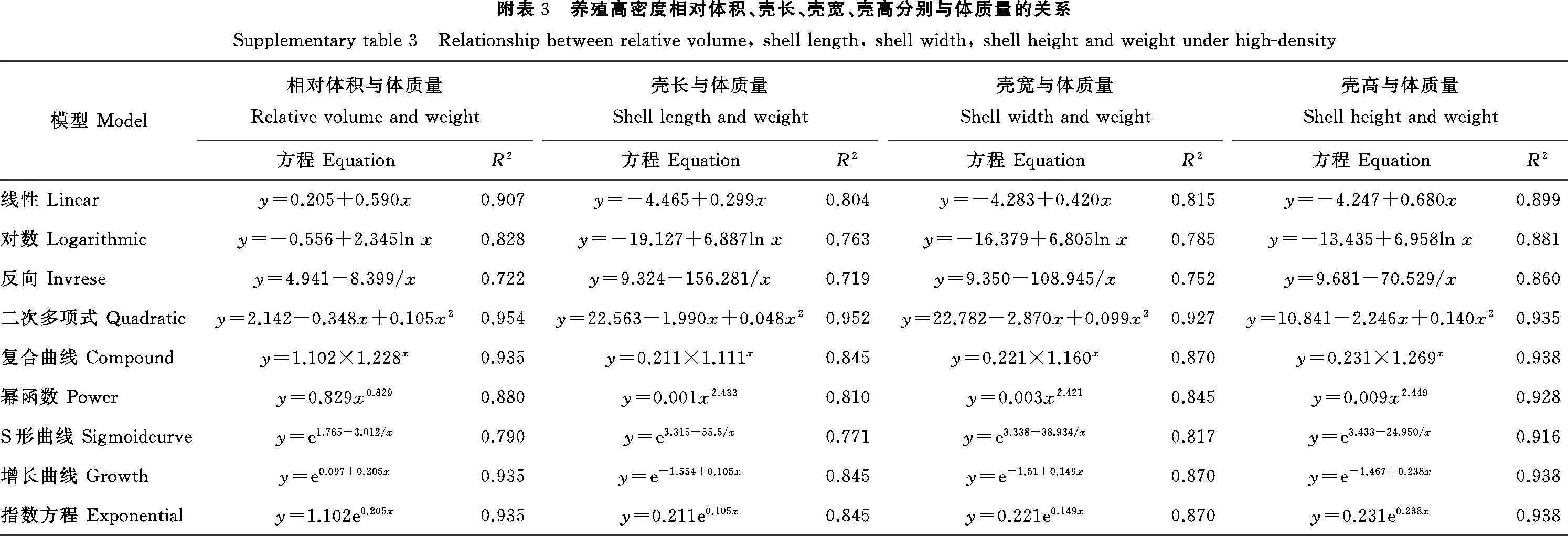
主要水质环境因子的变化如图2A所示。实验期间,水温在14.5~29.3 ℃之间,9月水温最高,12月初最低。盐度在26~30之间,其中7月最低,9月最高。pH在9月最低,12月最高。溶氧浓度在4.0~8.5 mg/L之间,8月最低,9—12月间溶氧浓度逐渐升高,12月最高。在7、8两个月中,因养殖密度上升,溶氧浓度下降。其中7月高密度组与对照组的溶氧浓度差异显著(p<0.05),8月各密度组与对照组的溶氧浓度差异显著(p<0.05)。9—12月不同密度组间的溶氧浓度无显著差异(p>0.05)。
如图2B所示,Chla总体含量在0.5~3.1 μg/L之间,7月最低,9月最高。Chla含量与养殖密度负相关,因养殖密度的上升,含量下降。7月,高密度组Chla含量显著低于无养殖组(p<0.05)。8月,中、高密度组Chla含量显著低于低密度与无养殖组(p<0.05)。9—12月,不同密度组的差异无统计学显著性。总体而言,各月的Chla含量呈现低密度组>中密度组>高密度组。
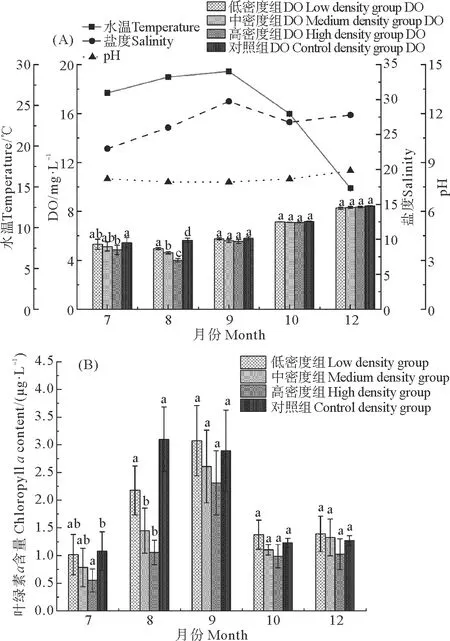
(字母为多重比较结果,同一时间下不同养殖密度组间字母相同为差异不显著,字母不同为差异显著。The letters represent the multiple comparison results, representing not significantly when the same letter exists between the stocking density and significantly when no same letter at the same time.)
2.2 菲律宾蛤仔的相对增产率
不同密度组菲律宾蛤仔在投放期和收获期的相对增产率如图3所示。低密度组总质量从1.8 kg增至2.1 kg;中密度组总质量从3.6 kg增至4.8 kg;高密度组总质量从7.2 kg增至7.9 kg(见图3(A))。中密度组的相对增产率为35%,显著高于高密度和低密度组(10%和17%,p<0.05,见图3(B))。

(不同小写字母表示同一时间不同养殖密度组间差异显著,p<0.05。Lowercase letters showed the difference significance among groups of dif-ferent stocking density each month, p<0.05.)
2.3 不同养殖密度下菲律宾蛤仔的个体生长
养殖密度和养殖时间对菲律宾蛤仔形态参数、相对体积及体质量的单因素方差分析等结果显示(见表1和表2):菲律宾蛤仔在各月的壳长、壳宽、壳高、相对体积和体质量等指标与养殖密度无显著相关性,但与时间显著相关(p<0.05)。
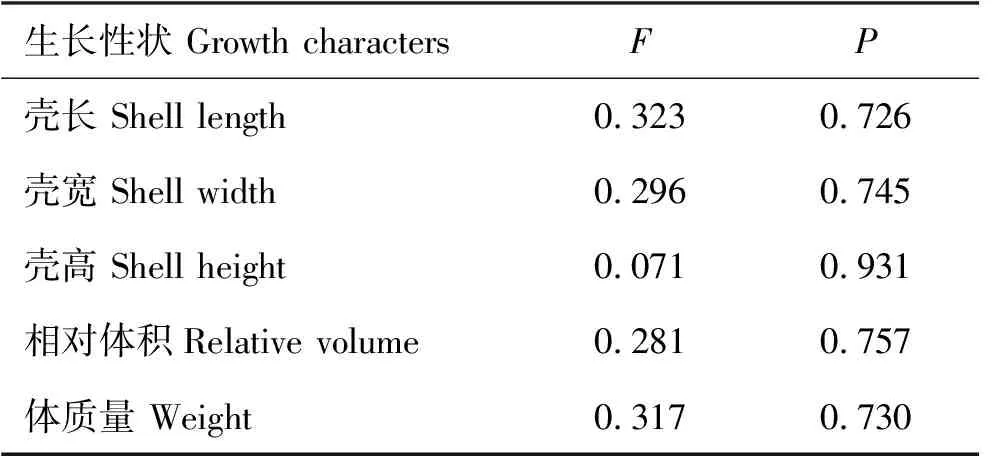
表1 养殖密度对菲律宾蛤仔形态参数、相对体积及体质量的单因素方差分析
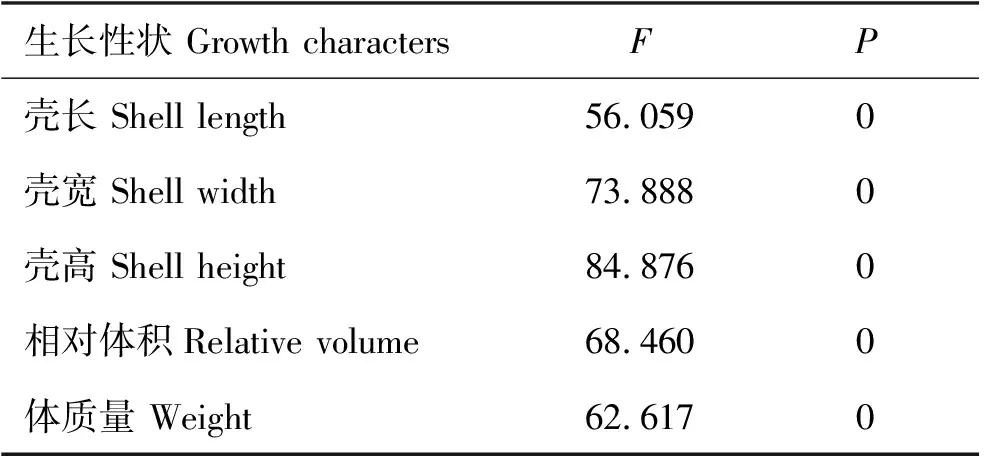
表2 时间对菲律宾蛤仔形态参数、相对体积及体质量的单因素方差分析
不同养殖密度下菲律宾蛤仔体质量和相对体积的变化过程如图4所示。
个体质量变化如图4(A)所示:中密度组中,7—8月快速生长,质量相对增加率约75%;8—9月,个体质量下降;9月恢复生长,至12月个体质量到达最大值(4.5±0.5)g。低密度组中,个体质量呈持续增长趋势,无显著停滞时期,各月质量相对增加率为7%~50%。高密度组中,7—8月质量相对增加率与低密度组一致(50%),显著低于中密度组。8—9月,个体质量增长出现停滞,无显著变化;9—12月,个体质量恢复增长,但质量相对增加率低于低、中密度组。
相对体积变化如图4(B)所示:7—8月,中、高密度组较低密度组相对生长率高,但无显著差异;8—10月,中、高密度组无显著生长,低密度组也生长缓慢;10—12月,中密度组相对生长率最高,达到25%,低密度组生长缓慢,相对生长率为15%,高密度组生长率最低(12%)。

图4 不同养殖密度下菲律宾蛤仔个体质量(A)和相对体积(B)的变化
2.4 不同养殖密度下菲律宾蛤仔个体质量变化的曲线拟合
高、中、低密度组中,各质量实测值与3种拟合曲线的比较如图5所示,生长曲线模型的拟合参数结果见表3。各密度组中,个体质量变化与Von Bertalanffy生长模型拟合的R2值最大(见表3),但不同密度组的拟合度不同:低密度组R2=0.913,K=0.014,拐点日龄t=41,拐点质量y=0.468;中密度组R2=0.769;高密度组R2=0.819。低密度组个体质量生长曲线与Von Bertalanffy模型具有最高的拟合度,而中、高密度组的质量生长曲线对三种生长模型的拟合度相对较低。

表3 不同养殖密度下个体质量拟合三种生长模型的参数估计值和拟合度

(■: 实测值; ●: Logistic预测值; ▲: Von Bertalanffy预测值; ▼: Gompertz预测值; A.低密度组; B.中密度组; C.高密度组。■: Measured value; ●: Logistic prediction value; ▲: Von Bertalanffy prediction value; ▼: Gompertz prediction value; A.Low density group; B.Medium density group; C.High density group.)
2.5 不同养殖密度下菲律宾蛤仔相对体积变化的曲线拟合
高、中、低密度组中,菲律宾蛤仔相对体积生长曲线模型拟合参数结果见表4,相对体积实测值与三种拟合曲线的比较如图6所示。各密度组中,拟合Von Bertalanffy生长模型的R2值最大(见表4),但不同密度组拟合度不同:低密度组R2=0.953,其中,K=0.019,拐点日龄t=29,拐点规格y=0.684;中密度组R2=0.900,K=0.017;高密度组R2=0.804,K=0.046。结果表明,低密度组相对体积生长曲线与Von Bertalanffy生长模型具有相对最高的拟合度,而中、高密度组的相对体积对三种模型的拟合度相对较低。

表4 不同养殖密度下相对体积拟合三种生长模型的参数估计值和拟合度

(■:实测值; ●:Logistic预测值; ▲:Von Bertalanffy预测值; ▼:Gompertz预测值。A.低密度组; B.中密度组; C.高密度组。■:Measured value; ●:Logistic prediction value; ▲:Von Bertalanffy prediction value; ▼:Gompertz prediction value.A.Low density group; B.Medium density group; C.High density group.)
2.6 菲律宾蛤仔形态参数与体质量相关性的曲线解析
三种养殖密度下,菲律宾蛤仔形态参数及相对体积与体质量之间的关系曲线如图7所示,其曲线方程及拟合参数见附录。

(A.低密度组; B.中密度组; C.高密度组。A.Low density group; B.Medium density group; C.High density group.)
分析菲律宾蛤仔形态参数(相对体积、壳长、壳宽、壳高)相对于体质量的拟合曲线,结果显示,不同组菲律宾蛤仔生长过程中的形态变化规律不同。以R2值大小为标准而言,低密度组的形态参数与体质量相关性的最大R2值出现在多种曲线关系中(见附表1):相对体积与体质量相关性曲线的最大R2值(0.972)出现在复合曲线、增殖曲线及指数方程中;壳长与体质量相关性曲线最大R2值(0.980)出现在二次多项式中;壳宽与质量相关性曲线最大R2值(0.965)、壳高与体质量关系曲线的高值则出现在更多关系式中(见附表1)。
在中、高密度组中,形态参数(相对体积、壳长、壳宽)和体质量曲线相关性最大R2值均出现在二次多项式中,相对体积、壳长及壳宽与体质量相关性R2最大,中密度组分别为0.942、0.944、0.935,高密度组分别为0.954、0.952、0.927(见附表2和3)。但壳高与体质量相关曲线的最大R2值则出现于多种拟合曲线方程。
总体而言,菲律宾蛤仔壳长与体质量的相关曲线在不同密度组中均符合二次多项式关系;相对体积、壳宽与体质量的相关曲线在低密度组没有出现规律性特征,但在中、高密度组中较符合二次多项式关系;壳高与体质量均无较明显的曲线相关性。
3 讨论
3.1 养殖密度对菲律宾蛤仔产量的影响
盐度、溶氧、pH等是影响贝类生长的重要环境因子[16-18],贝类的养殖密度会对水质产生重要的影响[19]。本研究中,7—9月高密度组水体的溶氧最低,说明高密度组菲律宾蛤仔的耗氧量大。不同养殖系统,养殖密度造成水质环境条件变化是有所区别的。例如,室内模拟研究的缢蛏养殖系统中,其溶氧含量随着缢蛏放养密度的增加而减小[20];开放池塘中,规律性换水可保障不同文蛤养殖密度对环境中pH、盐度、DO等水质指标不构成显著影响[21]。本研究于退潮后对养殖箱中截留水质进行检测,养殖密度对溶氧的影响较为突出。本研究发现,与低密度和高密度组相比,中密度组菲律宾蛤仔具有最大的相对增产率,说明中密度组菲律宾蛤仔的养殖效果最好。已有的研究表明,低密度养殖的文蛤(Meretrixmeretrix)在净产量、产量/投放量比方面效果最好,而高密度养殖可能超过环境容量导致种群增长率降低[22]。在本研究中,通过对实验围隔水中溶氧的测定,发现高密度组养殖水体溶氧最低。因此,高密度养殖导致的溶氧降低可能是菲律宾蛤仔生长缓慢、增产率较低的重要原因。在天津沿海开展的菲律宾蛤仔养殖实验表明,高密度菲律宾蛤仔养殖会严重制约其生长速度,导致菲律宾蛤仔摄食不足、肥满度下降和死亡率升高等现象,而低密度组菲律宾蛤仔死亡可能是被肉食性螺类捕食所致[14]。本研究中,高密度组菲律宾蛤仔增产率相对较低,可能由于养殖密度过高超过环境容纳量,引起水体溶氧降低、饵料缺乏,最终导致菲律宾蛤仔生长缓慢。
本研究实验结束后发现,低密度组底质出现较明显的淤积状态,且较中、高密度组淤积更严重。底质淤积是由于围隔的封闭箱底造成了底质水体交换不充分。低密度组淤积严重的原因,可能由于低密度组菲律宾蛤仔种群的呼吸水流低于高密度组,使得底质透水性和透气性相对较低,影响底质内环境的更新效率,出现低氧环境[23],进一步导致了该组的菲律宾蛤仔增产量较中密度组更低。另一方面也说明,在底质趋于不利的环境中,养殖密度对重构底质的重要性。从水中Chla的含量来看,高密度组中菲律宾蛤仔由于养殖密度大,摄食量升高,从而导致水体中Chla含量相对最低。而低密度组Chla的含量相对高,是由于菲律宾蛤仔个体数量少、总体摄食量低所致。此外,从本研究同期分析的菲律宾蛤仔脂肪酸组成和含量来看(未发表数据),菲律宾蛤仔脂肪酸的组成和含量在不同养殖密度组间无显著差异,说明在生长过程中,各组菲律宾蛤仔的食物来源组成结构无显著差异[24]。然而,本研究在养殖海区基于围隔系统开展养殖密度实验,并不能完全代表该养殖海区的实际养殖效果,今后需进一步开展实际生产条件下的实验研究,以更深入揭示养殖密度对菲律宾蛤仔养殖产量的影响。
3.2 养殖密度对菲律宾蛤仔生长过程的影响
越来越多的研究表明,不同养殖密度会影响海洋贝类的生长发育过程。孙同秋等[25]研究不同养殖密度对毛蚶(Scapharcasubcrenata)生长的影响,发现高密度组(500 粒/m2)毛蚶的壳长和体质量增长最大。李永仁等[13]研究发现菲律宾蛤仔养殖密度会影响其个体生长特征,生长呈现阶段性生长规律。养殖密度不仅影响生长速率和总产量,还对生长过程产生影响。本研究中,实验周期(7—12月)涵盖了定海湾养殖区菲律宾蛤仔的不同生长阶段,即7—8月快速生长期、8—9月性成熟期、9—10月收获期和10—12月休整期。本研究中,三个密度组菲律宾蛤仔在养殖初期都快速生长,这可能由于7—8月温度适宜,环境饵料丰富,导致个体快速生长,这与海区的实际养殖生产周期一致。8—9月,中密度组规格大小生长变化出现停滞、体质量下降,高密度组规格大小生长停滞但无明显的体质量下降,而低密度组菲律宾蛤仔的规格大小和体质量生长均未呈现这种阶段性的生长特征。福建定海湾海区以8—9月盛产蛤母(菲律宾蛤仔亲贝)而闻名,此时海区饵料丰度较高,是菲律宾蛤仔的主要繁殖季节[5]。在本实验中,中密度组菲律宾蛤仔的体质量下降较大,可能由于性成熟后排放生殖细胞的原因导致。对本研究贝类样品的生化指标分析结果显示,不同养殖密度对菲律宾蛤仔肌肉组织糖原含量造成显著影响,中密度组菲律宾蛤仔肌肉糖原含量在9月最低,与低密度组差异显著(未发表数据)。糖原含量是贝类生理状态的一个重要指标,双壳类在繁殖季会将大量糖原供给生殖细胞而导致肌肉组织中的糖原含量急剧下降[26]。糖原含量的显著下降可能是导致繁殖期菲律宾蛤仔生长停滞现象的主要原因之一。
10月后,定海湾海域水温开始逐渐下降,菲律宾蛤仔进入缓慢生长阶段,这与北方胶州湾菲律宾蛤仔生长的季节变化规律一致[27]。常见的动物生长模型包括Von Bertalanffy、Gompertz、Logistic、Brody和Richa-rds等,其中前三种模型较为常见,常用于拟合和描述水产动物各生长性状特征的规律[28]。例如,企鹅珍珠贝(Pteriapenguin)选育系的壳长、壳高、売宽、咬合线长和体质量等生长性状符合Gompertz生长模型[29]。长牡蛎(Crassostreagigas)F3代快速生长选育群体幼虫期壳高、壳长的生长规律与Logistic生长模型一致[30]。本研究发现,不同密度组的菲律宾蛤仔生长特征具有显著差异,低密度组的个体质量和相对体积显示持续生长的特征,其生长曲线均与Von Bertalanffy动物生长模型具有最好的拟合度。由于中、高密度组的质量和规格生长过程呈现显著的阶段性特征,与常见动物该生长模型的拟合度较低。生长曲线拟合生长模型的差异说明了养殖密度对菲律宾蛤仔的个体生长模式造成了影响。
3.3 养殖密度对菲律宾蛤仔形态性状的影响
动物生长过程中,某些形态参数(如长度)与体质量存在某些定量相关关系,其定量指数的高低,常用来表征动物的生理、营养或健康状态,即状态参数[31]。双壳贝类中,在体长与体质量关系呈指数相关的前提下,壳长与总质量的比值可作为状态参数[32-33]。研究发现,长牡蛎壳黑选育系F7养成期的壳高、壳长和売宽与总质量的拟合效果较好(R2均大于0.99),可通过其中一个性状预测另一个性状的生长规律[34]。海湾扇贝(Argopectenirradians)各数量性状间存在显著相关性,通过形态性状与体质量的相关系数可建立最优的多元线性回归方程[18];通过对耳鲍(Haliotisasinina)不同密度下生长性状的曲线拟合,发现贝类个体越大越容易受到密度的影响[35]。本研究中,通过对不同养殖密度菲律宾蛤仔相对体积、壳高、壳长、壳宽与体质量的关系进行拟合,发现中、高密度组形态参数和体质量曲线关系相对稳定,符合二次多项式模型,说明中、高密度组菲律宾蛤仔状态相对稳定,生长具有一定的规律性。而低密度组的形态参数和质量相关性无相对稳定的曲线关系,说明该密度下菲律宾蛤仔处于多变调节适应中,从而呈现出与中、高密度组不同的生长过程。
4 结语
在相对封闭的围隔系统中,养殖密度对菲律宾蛤仔的生长过程、状态参数以及产量可造成显著影响。曲线模型拟合结果表明,菲律宾蛤仔在低密度下的生长符合Von Bertalanffy模型,在较高密度下,生长过程呈阶段性特征,不能简单拟合为某个常见模型。养殖密度对菲律宾蛤仔的壳长与体质量的相关性影响不大,不同密度组的壳长与体质量关系曲线均符合二次多项式关系。不同养殖密度对壳高与体质量的相关性影响较大。生长状态稳定的中密度组,其相对增产量最大。本研究为进一步阐明滩涂贝类生长的密度效应提供了参考。