4种重金属离子对菲律宾蛤仔的急性毒性及安全评价
陈 志,魏成陈,胡丰晓,黄 健,李伟鹏,连晨阳
( 1.福建省淡水水产研究所,福建 福州 350002; 2.福建农林大学,福建 福州 350002; 3.福建省水产技术推广总站,福建 福州 350002 )
菲律宾蛤仔(Ruditapesphilippinarum),属软体动物门、瓣鳃纲、帘蛤目、帘蛤科、蛤仔属,俗称花蛤、蛤仔、蛤蜊、沙蚬子等,为广温广盐性贝类,广泛分布于我国沿海地区。因其肉质细嫩,味道鲜美,营养丰富,加工方法多样,一直深受广大消费者的喜爱[1]。加之其具有生长迅速、移动性差、适应力强、养殖方法简单、生产周期短、投资少、收益大等特点,成为我国滩涂贝类养殖的重要对象,与缢蛏(Sinonovaculaconstricta)、牡蛎和泥蚶(Tegillarcagranosa)一起被称为我国传统的“四大养殖贝类”[2]。
近年来,随着我国沿海城市经济的迅猛发展,沿海工业、农业以及各种人类活动所产生的污染物排放入海,导致沿海海域环境污染程度日益加剧,尤其以海洋重金属污染问题尤为严重。重金属污染物具有分布范围广、残留时间久、存在多形态间转化等特点,并可以通过食物链的逐级放大,在生物体内成千倍地富集,通过食物链的传递最终危及人类健康乃至生命安全[3-6]。
目前,有关重金属对菲律宾蛤仔的富集作用[7-8]和菲律宾蛤仔养殖水体中重金属安全限量[9-10]等方面的研究较多,但有关重金属对菲律宾蛤仔的急性毒性研究较少。因此,笔者主要使用Cd2+、Mn2+、Zn2+、Cu2+对菲律宾蛤仔进行急性毒性试验,探究菲律宾蛤仔对上述4种金属离子胁迫的敏感性,以期正确评价4种重金属对菲律宾蛤仔的毒性效应,为菲律宾蛤仔的安全生产提供参考。
1 材料与方法
1.1 试验材料
试验用菲律宾蛤仔选购自福清市三山镇养殖海区,平均壳长(3.13±0.22) cm,平均壳宽(2.09±0.15) cm,平均湿质量(6.32±1.07) g,试验容器选用34 cm×22 cm×21 cm的半透明塑料箱。试验前,先将菲律宾蛤仔暂养于塑料桶内,测得暂养期间水温24~25 ℃,盐度26.5~27.0,持续充气并投喂适量叉鞭金藻(Dicrateriainornate),6 h后开始试验。试验开始前停食,直至试验结束。
1.2 试验试剂
试验选用的4种试剂均为分析纯:硫酸镉(CdSO4·8/3H2O≥99.0%,西陇化工股份有限公司)、一水合硫酸锰(MnSO4·H2O≥99.0%,西陇科学股份有限公司)、七水合硫酸锌(ZnSO4·7H2O≥99.5%,西陇科学股份有限公司)、硫酸铜(CuSO4·5H2O≥99.0%,天津市科密欧化学试剂有限公司),试剂在使用前均先配制成一定质量浓度的母液,所配Cd2+、Mn2+、Zn2+、Cu2+的母液质量浓度分别为1000、5000、1000、100 mg/L,使用前用脱脂棉过滤的海水按比例稀释,现配现用。
1.3 试验方法
试验用海水经过充分曝气,每个试验容器注入5 L试验海水,试验期间水温24~26 ℃,盐度27.0~27.5,溶解氧5.00~5.62 mg/L,pH 7.66~7.75;采用静水试验法,首先进行预试验,以初步确定4种金属离子对菲律宾蛤仔的最小致死质量浓度和不引起死亡的最大安全质量浓度,根据等比数列和等对数间距法设置5个质量浓度组、1个对照组。经预试验,Cd2+试验质量浓度设为0.91、2.14、5.00、11.70、27.39 mg/L;Mn2+试验质量浓度设为50.00、88.91、158.11、281.17、500.00 mg/L;Zn2+试验质量浓度设为4.79、9.72、20.00、40.90、83.64 mg/L;Cu2+试验质量浓度设为0.10、0.38、1.41、5.31、20.00 mg/L。正式试验每个质量浓度设置3组平行和1个空白对照组,每个试验组随机放入10个菲律宾蛤仔。
正式试验期间不充气、不投饵,以保持试验容器内重金属离子相对稳定的质量浓度与分布状态。试验开始后,连续12 h观察并记录试验菲律宾蛤仔的健康状况,及时清除死亡个体并计算死亡率。之后每隔24 h观察并记录菲律宾蛤仔的活动情况和死亡数量,试验持续96 h。判定菲律宾蛤仔死亡的依据为:菲律宾蛤仔壳口大开,内脏团全部暴露于水中,或者贝壳微张,少数将水管末端或部分斧足伸出壳外,斧足僵硬,用玻璃棒多次刺激其软体部及贝壳皆无收缩反应和闭壳现象时,即判定为死亡。
1.4 数据处理
试验数据利用Excel 2010软件进行处理,利用SPSS 19.0软件的Probit模块计算4种重金属离子对菲律宾蛤仔的半致死质量浓度(LC50)和95%置信区间。安全质量浓度(SC)的计算公式如下[11]:
SC=96 h LC50×0.01
2 结 果
2.1 菲律宾蛤仔中毒症状
24 h内,4种重金属低质量浓度组绝大多数外壳张开,水管和斧足均伸出,水管过滤水体正常,受到外来刺激时反应迅速,水管和斧足均能迅速缩回壳内,并快速闭壳,与空白对照组活动无明显差异;高质量浓度组菲律宾蛤仔大部分双壳紧闭,极个别个体双壳微微张开,但水管和斧足均不露出。48 h内,各试验组菲律宾蛤仔多数表现为双壳紧闭,仅少数个体水管和斧足微微露出,外界刺激个体反应迟钝,水管和斧足无法立即缩回壳内,而对照组各受试菲律宾蛤仔水管与斧足均能伸出,活力良好。72~96 h,各质量浓度组菲律宾蛤仔的外壳逐渐张开,少数将部分斧足暴露于壳外,肉质僵硬,受外界刺激时无反应,失去生命特征。4种重金属离子对菲律宾蛤仔均呈现出不同程度的毒害作用,虽然中毒症状出现的时间有差异,但菲律宾蛤仔的中毒症状基本相似,且均表现为重金属质量浓度越高,受试时间越长,对菲律宾蛤仔的毒性越强,死亡率越高,表现出明显的时间—效应关系。
2.2 Cd2+对菲律宾蛤仔急性毒性的影响
24 h内,各质量浓度试验组的死亡率均不超过20%(图1);48 h内,各质量浓度试验组均出现死亡个体,最高质量浓度组(27.39 mg/L)死亡率达40%,48 h内菲律宾蛤仔对Cd2+表现出较强的耐受性;随着受试时间的增加,菲律宾蛤仔的死亡率随Cd2+质量浓度的升高呈线性上升趋势。72 h后死亡率大幅增加;96 h最高质量浓度组(27.39 mg/L)死亡率达到100%。Cd2+对菲律宾蛤仔24、48、72、96 h的半致死质量浓度分别为38.62、29.83、8.11、2.67 mg/L,96 h安全质量浓度为0.03 mg/L(表1)。
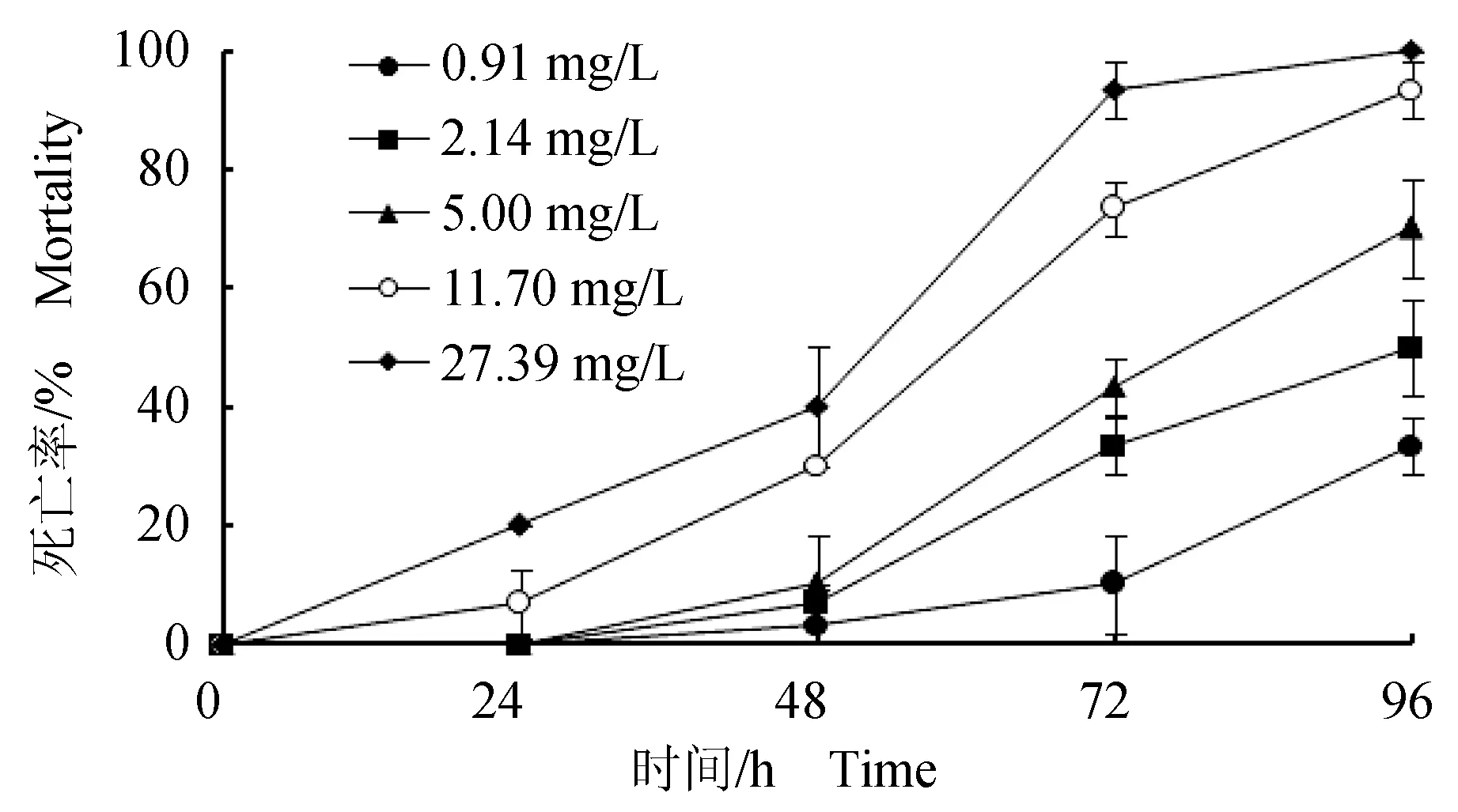
图1 Cd2+质量浓度对菲律宾蛤仔急性中毒死亡率的影响Fig.1 Effect of Cd2+ on mortality of Manila clam R. philippinarum in acute toxicity test
2.3 Mn2+对菲律宾蛤仔的急性毒性影响
在24 h内,各质量浓度试验组的死亡率不超过20%(图2);在48 h之内,各质量浓度试验组死亡率均有所升高,最高质量浓度组(500.00 mg/L)死亡率达60%;菲律宾蛤仔的死亡率随Mn2+质量浓度的升高呈线性上升趋势,72 h后死亡率大幅上升;96 h各质量浓度组死亡率进一步升高,最高质量浓度组(500.00 mg/L)死亡率接近100%,但死亡率增长幅度相较于72 h有所放缓,增长幅度不大,表明菲律宾蛤仔在经过一段时间的适应之后,对Mn2+表现出一定强度的适应性。Mn2+对菲律宾蛤仔24、48、72、96 h的半致死质量浓度分别为712.58、421.57、188.74、61.27 mg/L,96 h安全质量浓度为0.61 mg/L(表2)。

表1 Cd2+对菲律宾蛤仔不同暴露时间的半致死质量浓度

图2 Mn2+质量浓度对菲律宾蛤仔急性中毒死亡率的影响Fig.2 Effect of Mn 2+ on mortality of Manila clam R. philippinarum in acute toxicity test
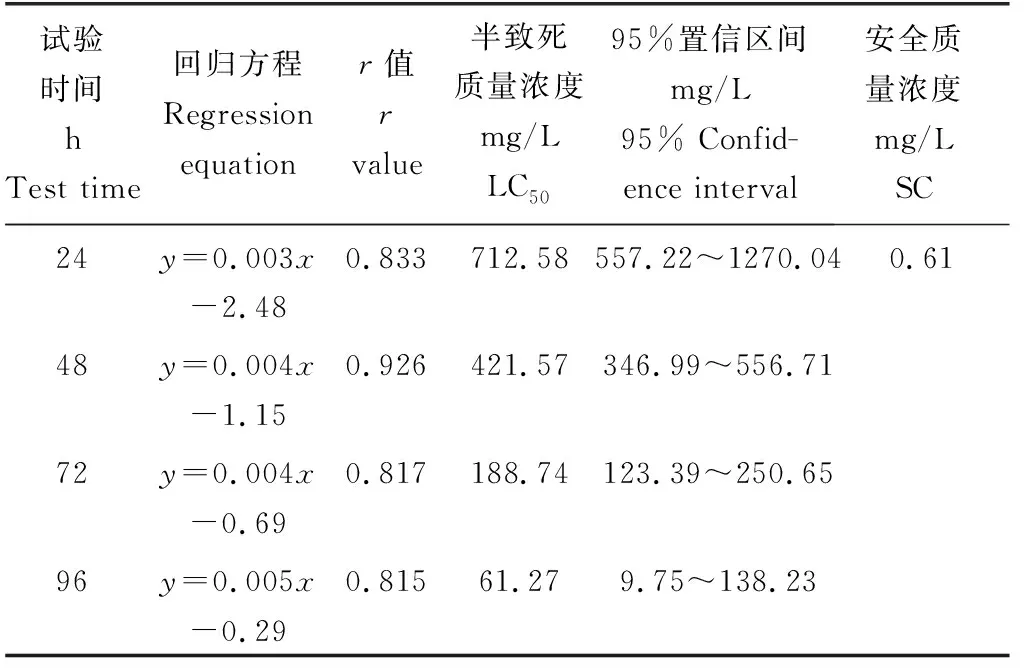
表2 Mn2+对菲律宾蛤仔不同暴露时间的半致死质量浓度
2.4 Zn2+对菲律宾蛤仔的急性毒性影响
在24 h之内,各质量浓度试验组的死亡率均不超过10%(图3);在48 h之内,各质量浓度试验组均出现了死亡个体,最高质量浓度组(83.64 mg/L)死亡率接近60%;随着受试时间的推移菲律宾蛤仔的死亡率随着Zn2+质量浓度的升高呈现逐级升高的趋势。72 h后死亡率虽大幅增加,但高质量浓度试验组死亡率的涨幅明显高于低质量浓度试验组,表明菲律宾蛤仔对低质量浓度的Zn2+有一定的耐受性;96 h最高质量浓度组(83.64 mg/L)死亡率达到100%。由表3可知,Zn2+对菲律宾蛤仔24、48、72、96 h的半致死质量浓度分别为141.27、72.20、34.91、21.57 mg/L,96 h安全质量浓度为0.22 mg/L。
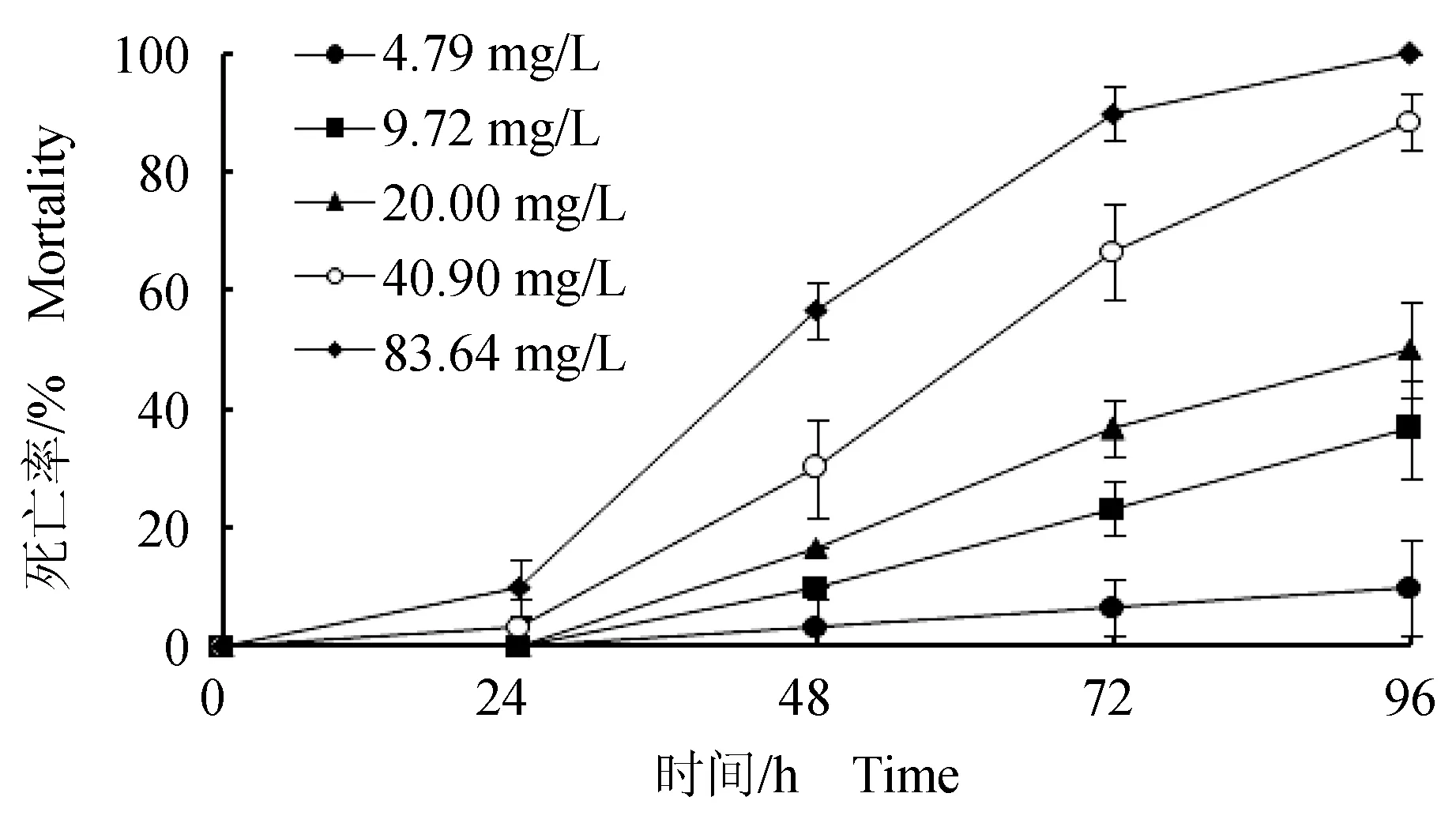
图3 Zn2+质量浓度对菲律宾蛤仔急性中毒死亡率的影响Fig.3 Effect of Zn 2+ on mortality of Manila clam R. philippinarum in acute toxicity test
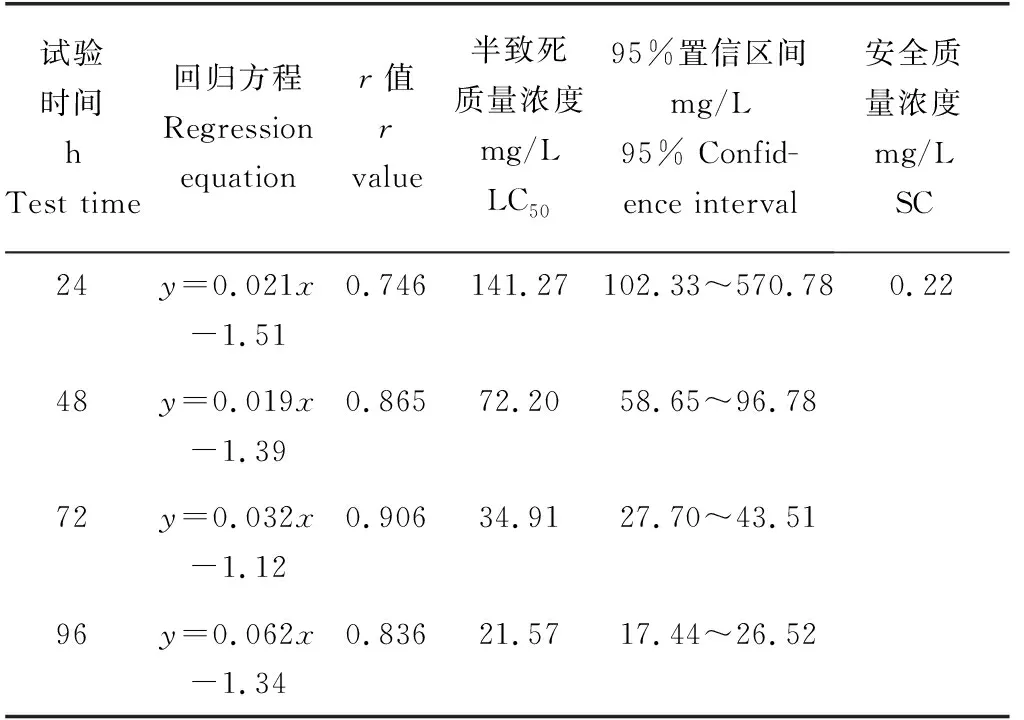
表3 Zn2+对菲律宾蛤仔不同暴露时间的半致死质量浓度
2.5 Cu2+对菲律宾蛤仔的急性毒性影响
在24 h内,各质量浓度试验组的死亡率均不超过20%(图4);在48 h之内,各质量浓度试验组的死亡率急剧升高,最高质量浓度组(20 mg/L)死亡率达到70%,表明菲律宾蛤仔对Cu2+的敏感性较强,耐受性较弱;随着受试时间的推移菲律宾蛤仔的死亡率随着Cu2+质量浓度的升高呈现出逐级递增的趋势,72 h后死亡率仍大幅上升;96 h最高质量浓度组(20 mg/L)死亡率达到100%。由表4可知,Cu2+对菲律宾蛤仔24、48、72、96 h的半致死质量浓度分别为29.88、12.06、3.62、0.79 mg/L,96 h安全质量浓度为0.01 mg/L。
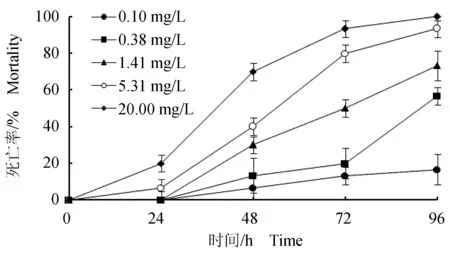
图4 Cu2+质量浓度对菲律宾蛤仔急性中毒死亡率的影响Fig.4 Effect of Cu 2+ on mortality of Manila clam R. philippinarum in acute toxicity test
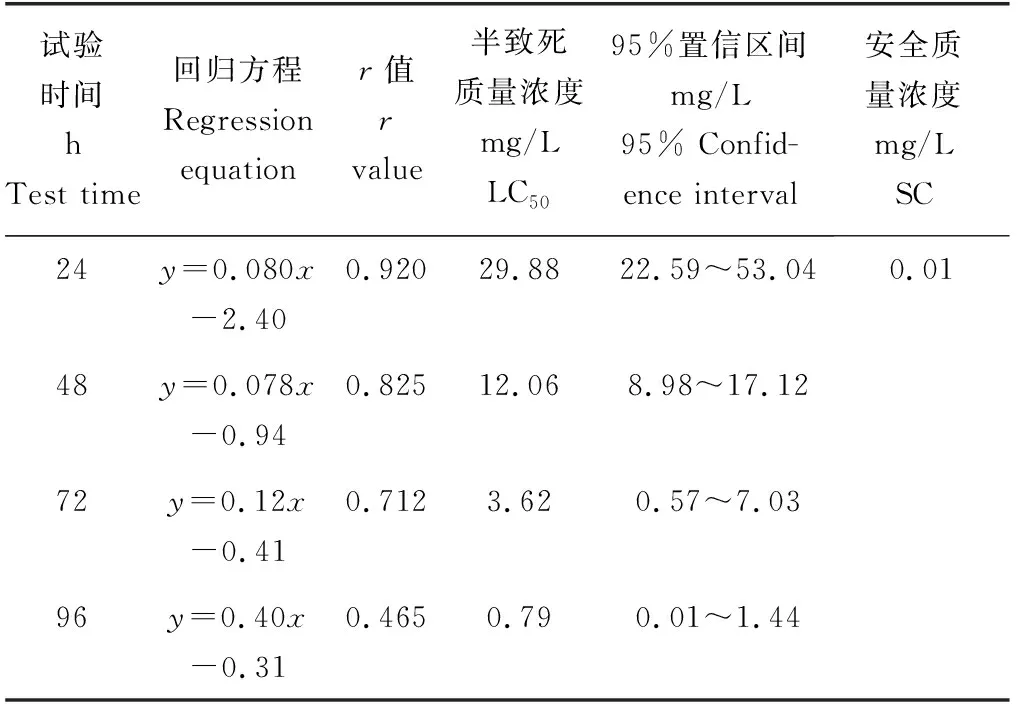
表4 Cu2+对菲律宾蛤仔不同暴露时间的半致死质量浓度
3 讨 论
3.1 4种重金属对菲律宾蛤仔的致毒机理及毒性强度评价
Cd2+可与含氨基、羧基、巯基的蛋白分子结合,导致不同酶类的活性受到抑制,酶中的Zn2+被Cd2+置换后将失去活性,最终导致蛋白质的分解和再吸收减少,对细胞正常的生理功能和代谢产生负面影响[12],这可能是Cd2+对某些海洋生物毒性大于Zn2+的原因[13-14]。Mn是水生动物正常生长发育必不可少的微量元素,不仅参与体内各种酶的化学组成,也是许多酶的激活剂,对水生动物的生长、免疫和抗应激都有十分重要的影响[15]。唐婉琴等[16]研究发现,当草鱼(Ctenopharyngodonidellus)暴露在一定质量浓度范围Mn水体中,其静止代谢率会出现相应的升高以满足机体解毒时额外的能量需求,而高质量浓度的Mn暴露则会损伤鱼体并降低鱼体的静止代谢率。目前,关于Mn对水产动物生长发育影响的作用机制研究仍处于起步阶段,主要是通过饲料中Mn的添加量来对鱼类[17-18]和虾类[19-20]的生理机能与免疫进行研究,而关于Mn对于贝类的相关研究鲜有报道,还有待进一步深入研究。Zn是生物生命过程中必需的微量元素,不仅参与细胞和酶的结构组成,在蛋白质和糖类的代谢过程中也发挥重要作用,但当Zn的含量超出一定阈值时,会影响生物的正常生理代谢,抑制生物的生长发育,也会导致免疫与生殖系统损伤[21]。Cu是一种极易被海洋生物富集的金属污染物,Cu2+可与生物蛋白质巯基结合抑制相关酶的生物活性,阻断生物正常的新陈代谢,破坏体内抗氧化酶活力,加快生物体内脂质过氧化作用,损伤细胞甚至导致生物体死亡[22-23]。此外,Cu2+还能影响水生动物体内Na+/K+-ATP酶的活性,进而导致细胞内外渗透压失衡[24],这或许是大多数水生动物对Cu2+比较敏感的原因。
本次试验中,Cd2+、Mn2+、Zn2+、Cu2+对菲律宾蛤仔96 h半致死质量浓度分别为2.67、61.27、21.57、0.79 mg/L,4种重金属离子对菲律宾蛤仔毒性大小为Cu2+>Cd2+>Zn2+>Mn2+。秦华伟等[25]研究发现,Cu2+、Cd2+、Zn2+对菲律宾蛤仔的毒性效应依次为Cu2+>Cd2+>Zn2+,与本研究结果较为一致。但从Cd2+、Zn2+、Cu2+对菲律宾蛤仔96 h半致死质量浓度比较,本试验中,Cd2+、Zn2+对菲律宾蛤仔96 h半致死质量浓度均小于其所得出的2.843 mg/L和30.246 mg/L,这可能与本试验中试验温度较高(24~26 ℃)、溶解氧水平较低(5.00~5.62 mg/L)等有关,水体温度越高,溶解氧水平越低,对水生生物的毒性也就越大。而本试验Cu2+对菲律宾蛤仔的96 h半致死质量浓度是其所得结果的2.4倍,表现出对Cu2+的较高耐受性,这可能与受试菲律宾蛤仔的规格、栖息环境和其他试验条件的差异有关。高淑英等[26]研究发现,Cd2+、Mn2+、Zn2+对长毛明对虾(Fenneropenaeuspenicillatus)幼体的毒性效应依次为Cd2+> Mn2+>Zn2+,而本试验中,Zn2+对菲律宾蛤仔的毒性要强于Mn2+,表明贝类和甲壳类对重金属的耐受能力有差异,也可能与受试水生动物的年龄大小和生活习性有关。
3.2 4种重金属离子的安全质量浓度评价
本次试验中,Cd2+、Mn2+、Zn2+、Cu2+对菲律宾蛤仔的安全质量浓度分别为0.03、0.61、0.22、0.01 mg/L。Cd2+的安全质量浓度与乔庆林等[10]测定的养殖水体环境中菲律宾蛤仔Cd2+的安全限量结果非常接近。宁军号等[27]进行了Zn2+、Cu2+、Cd2+对偏顶蛤(Modiolusmodiolus)的急性毒性试验,得出Cd2+、Zn2+、Cu2+对偏顶蛤的安全质量浓度分别为0.25、0.62、0.005 mg/L。其中Cd2+与Cu2+对偏顶蛤的安全质量浓度均低于Cd2+与Cu2+对菲律宾蛤仔的安全质量浓度,表明菲律宾蛤仔对Cd2+与Cu2+的耐受性均高于偏顶蛤,但Zn2+对菲律宾蛤仔的安全质量浓度低于对偏顶蛤的安全质量浓度,菲律宾蛤仔和偏顶蛤的种属差异可能是造成该差异的主要原因。
GB 11607—1989《渔业水质标准》规定:ρ(Cd2+)≤0.005 mg/L,ρ(Zn2+)≤0.1 mg/L,ρ(Cu2+)≤0.01 mg/L。本试验中,除Cu2+外,Cd2+、Zn2+对菲律宾蛤仔的安全质量浓度均高于渔业水质标准,说明菲律宾蛤仔对Cd2+与Zn2+的耐受性较强,在重金属超标的环境中仍可以存活。研究证实,菲律宾蛤仔对Cu2+的耐受性在试验的4种金属离子中最差,敏感性最高。因此,在养殖过程中应该特别注意含Cu消毒剂的使用剂量,防止使用不当造成损失。随着人们生活水平与健康意识的提高,人们对食物的安全评判标准也愈加规范,因此,在水产品的养殖过程中,应该参照现行渔业水质标准,严格控制水体中重金属含量,防止重金属超标,确保水产品的健康品质。
4 结 论
本试验采用毒理学试验方法研究了Cd2+、Mn2+、Zn2+、Cu2+对菲律宾蛤仔的急性毒性效应,试验结果表明,暴露于上述4种不同的重金属溶液以及同组不同质量浓度梯度环境中的菲律宾蛤仔,均会受到一定程度的毒害作用,且毒害作用的大小随重金属离子及其质量浓度的变化而变化。本试验结果表明,4种重金属离子对菲律宾蛤仔的毒性强弱依次为Cu2+>Cd2+>Zn2+>Mn2+,Cd2+、Mn2+、Zn2+、Cu2+对菲律宾蛤仔的96 h半致死质量浓度分别为2.67、61.27、21.57、0.79 mg/L,安全质量浓度分别为0.03、0.61、0.22、0.01 mg/L。本试验结果可为菲律宾蛤仔人工育苗和养殖过程中的水质监测提供理论依据。

