贝伐珠单抗联合免疫治疗对非鳞非小细胞肺癌血清学指标及预后的影响
朱加作,李春燕,赵吉光,程志原,解 华
肺癌是我国最常见的恶性肿瘤,病死率居恶性肿瘤的首位,而非小细胞肺癌是临床常见的病理类型,其中非鳞非小细胞肺癌(nsNSCLC)包括腺癌、大细胞癌及其他不常见的类型[1-2]。临床研究显示,大部分nsNSCLC患者在就诊时已无根治性手术治疗机会,且预后较差[3]。此外癌症的治疗策略需依据肿瘤临床分期、病理类型及患者身体状况等多种因素制订,而在无法进行手术的情况下,患者仅能依赖药物及放射治疗。随着现代医学的发展,更为精确的分子靶向治疗逐渐成为临床研究热点,其中免疫治疗主要通过阻断程序性细胞死亡分子1及其配体相互作用的免疫检查点来达到治疗癌症的效果,目前临床使用的药物包括Pembrolizumab、纳武利尤单抗、阿替利珠单抗等[4]。贝伐珠单抗是血管内皮生长因子(VEGF)抑制剂,能有效阻断恶性肿瘤组织血管生成,目前已在多种癌症治疗中获得肯定的效果[5]。本研究基于血清细胞角蛋白19片段抗原21-1(CYFRA21-1)、糖类抗原125(CA125)水平变化探究贝伐珠单抗联合免疫治疗对nsNSCLC患者预后的预测价值,现报告如下。
1 资料与方法
1.1 一般资料
回顾性分析2018年1月—2020年6月我院收治94例nsNSCLC的临床资料。纳入标准:均经组织病理学检查确诊,符合nsNSCLC的诊断标准[6];年龄>18岁,且<60岁者;无癌症治疗史;充分知情同意者。排除标准:无法耐受或对研究药物过敏者;合并其他恶性肿瘤者;预计生存期<6个月者;存在肿瘤侵犯重要血管或脑转移者;合并精神障碍者;心、肾、肝严重功能不全者;合并咯血或血液系统疾病者;妊娠或哺乳期女性。根据治疗方案将纳入患者分为对照组和观察组,每组47例。2组一般临床资料比较差异无统计学意义(P>0.05),具有可比性。见表1。

表1 2组非鳞非小细胞肺癌一般临床资料比较
1.2 方法
2组均予以营养支持、止痛等常规对症治疗。在此基础上对照组予以纳武利尤单抗(Bristol-Myers Squibb Holdings Pharma, Ltd. Liability Company,批准文号:S20180014)3 mg/kg静脉注射,治疗时间60 min,治疗频率为2周1次,直至患者出现疾病进展或不可接受的不良反应。观察组在对照组基础上予以贝伐珠单抗(Roche Diagnostics GmbH,批准文号:S20170035)15 mg/kg静脉注射,首次注射时持续90 min,若患者耐受性良好则自第二次开始缩短至60 min,治疗频率为3周1次;纳武利尤单抗使用剂量与对照组一致,但治疗频率调整为3周1次。在观察组贝伐珠单抗治疗3个周期结束后统计2组结果,治疗期间对患者持续观察,治疗结束后均随访2年。
1.3 临床疗效
治疗3个周期后,探究2组临床疗效差异,以影像学检查结果为参考,使用WHO颁布的实体瘤疗效评价标准1.1[7]对疗效进行评估。完全缓解:所有目标病灶完全消失;部分缓解:全部可测量靶病灶直径之和缩小超过30%;疾病进展:出现新病灶或全部可测量靶病灶直径之和增大超过20%;疾病稳定:处于部分缓解与疾病进展之间者。总有效以完全缓解与部分缓解之和计算。
1.4 血清学指标
比较2组治疗前、治疗3个周期后血清癌症相关指标及生长因子指标差异,采集患者空腹静脉血6 mL,离心后取血清,应用化学发光定量法检测血清CYFRA21-1水平,应用微粒子发光法检测血清CA125水平,应用酶联免疫吸附试验检测血清载脂蛋白A1(ApoA1)、VEGF、转化生长因子-β1(TGF-β1)、巨噬细胞移动抑制因子(MIF)水平。
1.5 不良反应及生存情况
记录并统计2组治疗期间不良反应发生情况及随访2年生存情况差异。
1.6 统计学方法
2 结果
2.1 临床疗效比较
观察组治疗3个周期后临床总有效率高于对照组(P<0.05)。见表2。
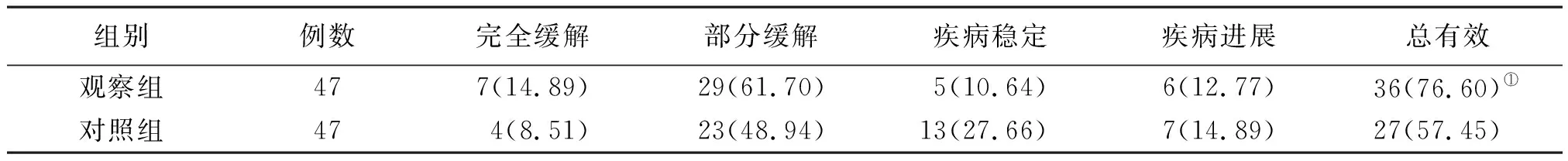
表2 2组非鳞非小细胞肺癌临床疗效比较[例(%)]
2.2 血清癌症指标比较
治疗3个周期后,2组血清CYFRA21-1、CA125水平均较治疗前降低,且观察组低于对照组(P<0.05)。治疗3个周期后,2组血清ApoA1较治疗前升高,且观察组高于对照组(P<0.05)。见表3。
表3 2组非鳞非小细胞肺癌治疗前后血清癌症指标比较
2.3 血清生长因子指标比较
治疗3个周期后,2组血清VEGF、TGF-β1、MIF水平均较治疗前降低,且观察组低于对照组(P<0.05)。见表4。
表4 2组非鳞非小细胞肺癌治疗前后血清生长因子指标比较
2.4 不良反应比较
治疗期间,2组疲劳、腹痛腹泻、恶心呕吐、口腔溃疡、食欲不振、皮疹等不良反应发生率比较差异无统计学意义(P>0.05)。见表5。

表5 2组非鳞非小细胞肺癌治疗期间不良反应比较[例(%)]
2.5 2年生存率比较
随访2年后,观察组2年生存率为93.62%,对照组2年生存率为85.11%。2组2年生存率比较差异无统计学意义(P>0.05)。见图1。
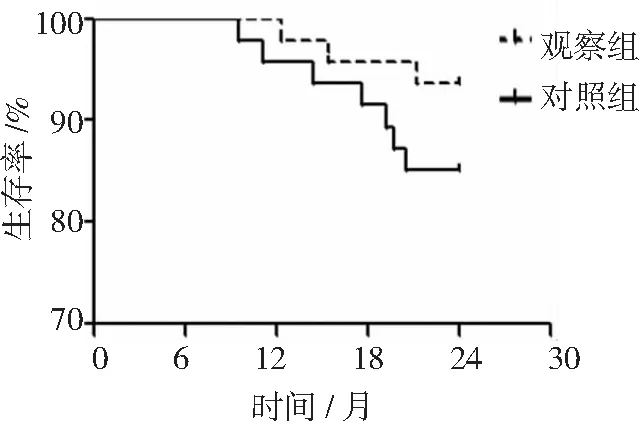
观察组予以贝伐珠单抗联合纳武利尤单抗治疗,对照组予以纳武利尤单抗治疗。图1 2组非鳞非小细胞肺癌随访2年生存情况
3 讨论
nsNSCLC是临床常见的肺癌类型,由于大多数患者确诊时已属于晚期,丧失根治性手术机会,临床多采用化疗方案治疗。有部分研究认为,尽管化疗能延长nsNSCLC患者中位生存时间,但对提高远期生存率的效果仍存在争议[8-9]。随着免疫治疗技术的发展,程序性细胞死亡分子1及其配体通路选择性抑制剂在肿瘤治疗中逐渐应用,成为治疗多种癌症的新选择,该药物可通过激活杀伤性T淋巴细胞发挥抗肿瘤作用[10-11]。肿瘤可通过新生血管进行增殖,抗血管生成药物主要通过阻断新生血管发挥抗肿瘤作用,且能改善肿瘤微环境中的免疫抑制,因此具有提升免疫治疗效果的可能性[12],故本研究探讨抗血管生成药物联合免疫治疗对nsNSCLC患者的效果。
贝伐珠单抗属于抗血管生成药物,是一种VEGF单克隆抗体,能特异性结合VEGF异构体中的VEGF-A,阻断其与相关酪氨酸激酶受体之间的相互作用[13]。本研究结果显示,观察组治疗3个周期后临床疗效更好,其原因可能在于肿瘤生长过程中异常的血管生成可引起微环境免疫抑制,抑制异常血管生成可使肿瘤微环境趋于正常,有助于抗肿瘤药物在患者体内起效,因此贝伐珠单抗对免疫治疗有增效作用。RIZVI等[14]研究证实,抗血管生成药物联合免疫治疗能提升癌症治疗效果,本研究结果与之相似。CYFRA21-1广泛分布于层状或鳞状上皮中,其水平上升与肿瘤细胞溶解或坏死存在联系[15];CA125在正常人血清中含量低下,但机体正常组织被肿瘤浸润时会被释放进入血液[16];ApoA1是由肝脏及小肠合成的功能蛋白,能在一定程度上调节肿瘤微环境及机体免疫反应。本研究结果显示,治疗3个周期后,观察组血清CYFRA21-1、CA125水平低于对照组,而ApoA1水平高于对照组。究其原因可能在于:1)联合使用贝伐珠单抗能通过竞争性结合相关受体阻断血管生成,进而阻断肿瘤组织的营养供应,发挥抗肿瘤作用[17];2)nsNSCLC患者血管生成因子与抗血管生成因子失衡,内皮细胞大量增殖、迁移在肿瘤组织周围形成高通透性的管状及囊状血管,影响组织周围血流,不利于抗肿瘤药物发挥作用,而贝伐珠单抗通过抑制异常血管生成,为免疫治疗药物在肿瘤局部的聚集创造条件,进而改善患者血清癌症指标。
VEGF能与相应受体结合而介导血管生成,还可参与肿瘤的生长、浸润、转移过程;TGF-β1可通过调节基质金属蛋白酶的表达影响肿瘤细胞增殖、转移;MIF可通过影响细胞分裂、调节免疫反应、促血管生成等参与肿瘤生长进程。本研究结果显示,治疗3个周期后,观察组血清VEGF、TGF-β1、MIF水平均低于对照组。其原因可能在于贝伐珠单抗可直接抑制血管生成,进而降低患者体内血清生长因子水平。从不良反应来看,贝伐珠单抗联合免疫治疗尽管会导致部分不良反应发生增加,但2组之间差异并无统计学意义,提示联合用药的安全性尚在可接受的范围内。邬仁华等[18]研究证实,免疫治疗联合贝伐珠单抗治疗Ⅳ期肺腺癌不会导致不良反应增加,本研究结果与之一致。本研究结果还显示,2组2年生存率比较差异无统计学意义,可能与本研究随访时间较短有关。
综上所述,贝伐珠单抗联合免疫治疗有利于提高nsNSCLC患者的临床疗效,还能降低血清CYFRA21-1、CA125及相关生长因子水平,且不良反应不会显著增加,安全性较好,但对患者生存期无显著影响。本研究的不足之处为单中心研究,有待临床进一步展开多中心、大样本研究,深入探讨贝伐珠单抗联合免疫治疗的有效性。

