高原低氧环境与平原地区常住居民HIF-1、VEGF水平及与阿尔茨海默病易感性的相关性和交互作用
叶亚丽,郑莹莹,师 强,王圣巍
阿尔茨海默病(AD)是常见的神经退行性疾病,也是导致痴呆的常见疾病,主要特征为记忆力进行性降低,常伴有视觉空间功能障碍、行为改变,严重时可致患者死亡[1]。众多学者认为AD发病与基因、环境、基因-环境交互有关[2-3],在研究AD发病因素时,若单纯考虑基因因素或环境因素与疾病病因的相关性,而忽略基因-环境两因素的交互作用,会影响对AD病因的风险评估[4]。缺氧诱导因子-1(HIF-1)是一种低氧诱导结合蛋白,对缺氧环境较为敏感,可调控血管形成、炎症反应、细胞凋亡、氧化应激等多种生物学过程,进而参与中枢神经系统疾病的发生发展[5]。血管内皮生长因子(VEGF)属于血小板衍生生长因子超家族成员,是一种常见的血管生成因子,与AD认知功能障碍密切相关,可参与AD的发生发展[6]。目前关于不同地区HIF-1、VEGF表达及对AD易感性相关性和交互作用的影响尚不明确。鉴于此,本研究选择香格里拉高原低氧环境地区、延安市平原地区的180例常住居民作为研究对象,分析高原低氧环境与平原地区常住居民HIF-1、VEGF水平差异及与AD易感性的相关性和交互作用,以便更好阐述AD发生发展过程,为预防AD提供参考依据。
1 资料与方法
1.1 纳入与排除标准
纳入标准:抽取香格里拉市区及周边农村藏族居民、延安市区及周边农村汉族常住居民;迁入延安市区及香格里拉市区居住≥1年的常住人口;迁出香格里拉市区及延安市区居住<1个月的常住人口;AD诊断标准符合“神经疾病诊断和统计手册第Ⅳ版”[7],并经头颅MRI等检查确诊。排除标准:连续寻找3次未见或解释说服后仍拒绝参加本研究者;长期服用镇痛药物、成瘾性药物者;伴贫血、甲状腺功能亢进及感染性疾病患者;存在重大颅脑创伤、手术史者;患精神疾病及严重焦虑、躁狂等心理疾病者;患自身免疫性疾病和恶性肿瘤者。所有研究对象签署本研究知情同意书,本研究经本院医学伦理委员会审核通过。
1.2 研究对象
依据纳入及排除标准,按照1︰1原则选取2020年1月—2023年1月香格里拉高原低氧环境地区、延安市平原地区各180例常住居民作为研究对象,根据是否患有AD分为AD组、无AD组。高原低氧环境地区180例常住居民中男93例,女87例;年龄52~85(70.03±9.75)岁;体质量指数21.8~26.9(24.39±0.86)kg/m2;本地区居住时间1~30(15.00±5.23)年。平原地区180例常住居民中男89例,女91例;年龄52~89(70.52±8.86)岁;体质量指数22.4~26.6(24.50±0.72)kg/m2;本地区居住时间1~31(17.08±5.34)年。
1.3 HIF-1、VEGF检测方法
采集纳入对象肘部静脉血3 mL,3 000 r/min离心15 min,采用放射免疫法检测血清HIF-1水平,采用双抗夹心法检测血清VEGF水平,试剂盒均购自上海化邦生物科技有限公司。
1.4 观察指标
1)收集高原低氧环境地区和平原地区AD组、无AD组居民的基线资料,基线资料包括性别、年龄、体质量指数、本地区居住时间、AD家族史、吸烟情况、饮酒情况、脑梗死史、受教育层次;2)比较高原低氧环境地区和平原地区AD组、无AD组居民血清HIF-1、VEGF水平差异;3)AD易感性采用多因素Logistic回归分析;4)分析高原低氧环境地区和平原地区不同HIF-1、VEGF水平AD患者危险度;5)分析HIF-1、VEGF水平对AD易感性的交互作用。
1.5 统计学方法
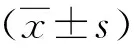
2 结果
2.1 基线资料
高原低氧环境地区和平原地区AD组、无AD组在性别、年龄、体质量指数、本地区居住时间、AD家族史、吸烟、饮酒、脑梗死史、合并疾病、受教育层次方面比较差异均无统计学意义(P>0.05)。见表1。

表1 高原低氧环境地区和平原地区有无AD常住居民基线资料
2.2 不同地区有无AD常住居民HIF-1、VEGF水平差异
高原低氧环境地区、平原地区AD组HIF-1水平高于无AD组,VEGF水平低于无AD组(P<0.01)。高原低氧环境地区AD组、无AD组HIF-1水平高于平原地区对应的AD组、无AD组,VEGF水平低于平原地区对应的AD组、无AD组(P<0.05)。见表2。
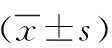
表2 高原低氧环境地区和平原地区有无AD常住居民HIF-1、VEGF水平差异
2.3 AD易感性的多因素Logistic回归分析
因变量:AD情况(有=1,无=0);自变量:性别(男=1,女=2)、年龄(按实际值赋值)、体质量指数(按实际值赋值)、本地区居住时间(按实际值赋值)、AD家族史(无=0,有=1)、吸烟(否=0,是=1)、饮酒(否=0,是=1)、脑梗死史(无=0,有=1)、合并疾病(无=0,有=1)、受教育层次(小学=1,初中=2,高中或中专=3,大专及以上=4)。多因素Logistic回归分析显示,HIF-1、VEGF水平与高原低氧环境地区、平原地区及总体AD易感性均显著相关(P<0.05,P<0.01)。见表3。
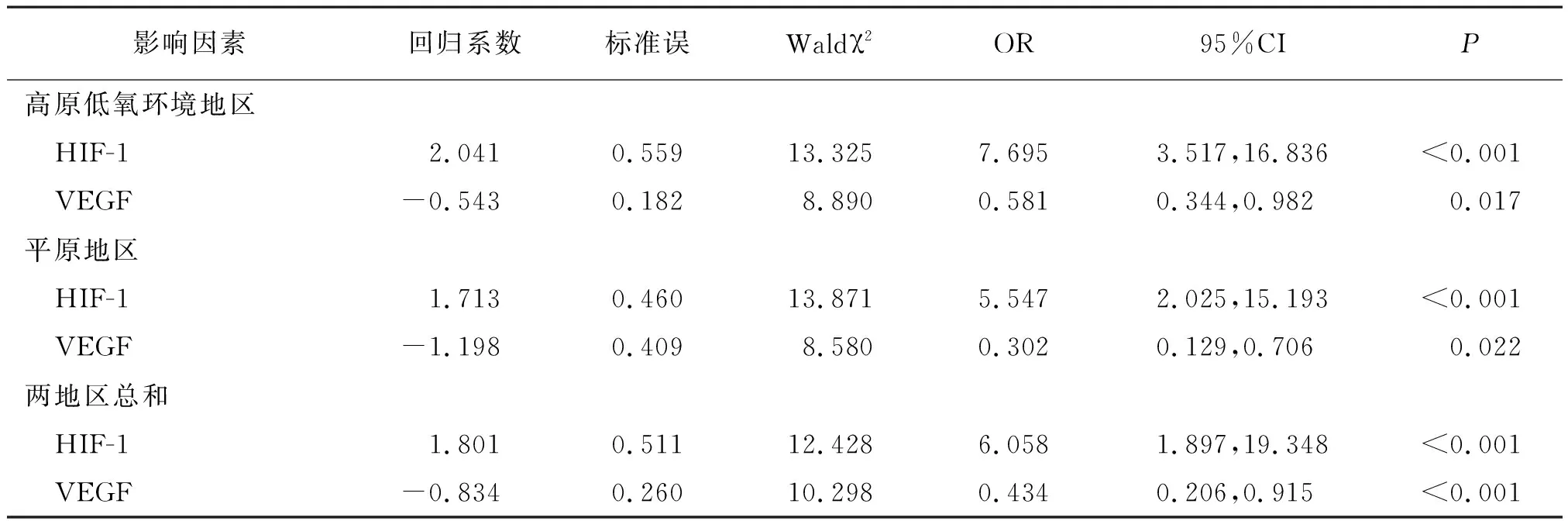
表3 高原低氧环境地区和平原地区常住居民AD易感性的多因素Logistic回归分析
2.4 不同HIF-1、VEGF水平患者AD危险度分析
以高原低氧环境地区、平原地区HIF-1、VEGF水平均值为分界,将患者分为HIF-1、VEGF高水平与低水平亚组。HIF-1高水平亚组罹患AD危险度是低水平亚组的6.174倍(P<0.01);VEGF高水平亚组罹患AD危险度是低水平亚组的0.327倍(P<0.01)。见表4。
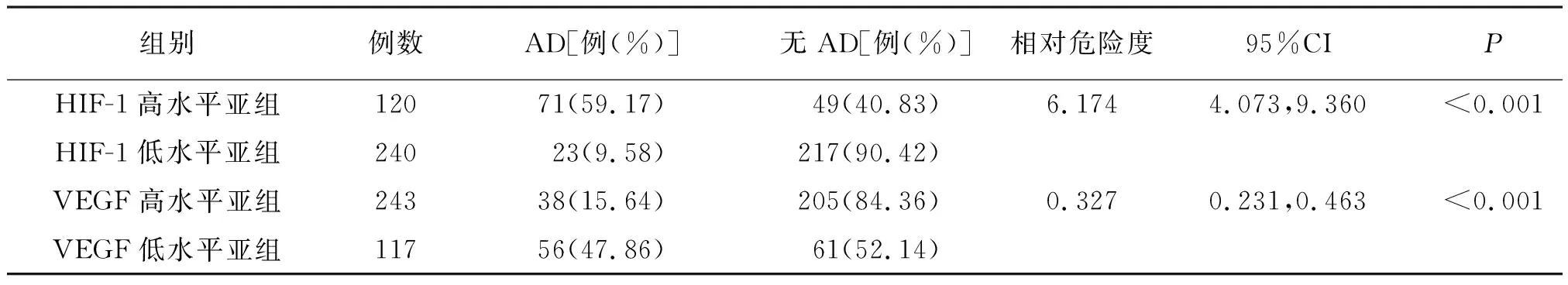
表4 高原低氧环境地区和平原地区不同HIF-1、VEGF水平患者AD危险度分析
2.5 HIF-1、VEGF水平对AD易感性的交互作用
单独HIF-1水平升高所致的OR为6.200,单独VEGF水平降低所致的OR为10.075,HIF-1和VEGF共存时所致的OR为21.097,交互作用OR<两单独因素OR值的乘积,符合次相乘交互作用模型,交互作用系数γ为1.320>1,提示HIF-1水平升高对VEGF表达降低的效应具有正向交互作用。见表5。
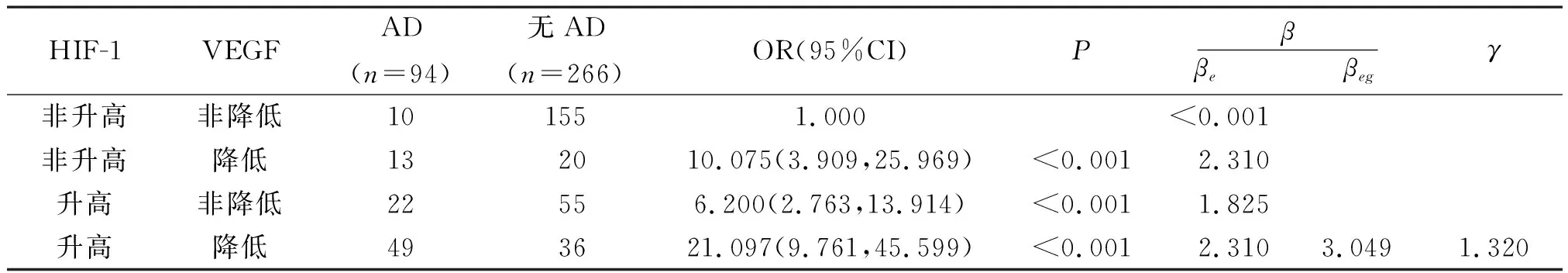
表5 高原低氧环境地区和平原地区常住居民HIF-1、VEGF水平对AD易感性的交互作用分析
3 讨论
随着我国社会经济快速发展和人口老龄化进程的加快,AD患病人数逐年增多,据统计我国60岁以上老年群体中有1 507万例痴呆患者,其中AD患者983万例,约占痴呆患者的65.23%[9]。目前研究发现,遗传易感性、环境因素对AD的发生发展具有重要作用[10-11]。确定与AD发病相关的基因、环境条件将有助于了解该病分子病理基础,可为临床干预AD提供新的方向。
AD的病理基础与β-淀粉样蛋白(Aβ)聚集、神经纤维缠结及神经元丢失等有关。有研究显示,缺血缺氧可诱导神经元Aβ形成、促进tau蛋白磷酸化,进一步加重AD认知功能障碍[12-13]。动物实验显示,长期处在高原低氧环境下可加重海马神经细胞损伤、脑组织水肿,导致机体认知功能障碍[14]。在分子水平上,缺氧应答主要通过HIF-1调节和介导,而HIF-1是一种异源二聚体,主要包括HIF-1α和HIF-1β两种亚基,可直接感应生物体氧浓度变化,也是低氧信号通路的关键蛋白[15]。正常氧浓度环境下,HIF-1α半衰期较短,可在细胞中不停地合成、降解,不能与HIF-1β结合,无法启动细胞核内缺氧应答原件[16];而氧浓度降低使得HIF-1α降解过程被抑制,可与HIF-1β结合启动细胞核内缺氧应答原件,诱导下游靶基因转录,从而参与血管生成、糖酵解、氧化应激等过程[17-18]。研究发现,HIF-1α与AD发病密切相关,随着时间延长HIF-1α表达逐渐升高,沉默HIF-1α可降低小鼠神经元HIF-1α表达,可减轻神经元、胶质细胞损伤[19]。本研究显示,不同地区AD组HIF-1水平高于无AD组,表明HIF-1水平升高可参与AD的发展。本研究还发现,高原低氧环境地区AD组、无AD组HIF-1水平高于平原地区对应的AD组、无AD组,其水平与高原低氧环境地区、平原地区及总体AD易感性均显著相关,可见HIF-1水平变化与AD易感性密切相关。分析认为,高原低氧环境下可促进体内神经元Aβ形成及tau蛋白磷酸化等,引起AD患者神经功能损伤,导致血清HIF-1水平升高。
VEGF可促进血管内皮细胞增殖分化、血管形成及维持血管内皮功能完整性[20],是公认的血管生成因子,可直接作用于神经细胞,促进神经细胞增殖、迁移和轴突再生[21-22]。PETRELIS等[23]、ASBY等[24]研究发现,VEGF对胆碱神经元有保护作用,可减少Aβ蛋白斑块沉积,若局部血管细胞缺乏VEGF,可失去神经细胞保护、血管修复功能,进而加重AD认知功能损伤。FAN等[25]报道显示,在低氧环境下HIF-1可产生一系列低氧适应性反应,通过调控下游VEGF、VEGF相关受体表达,进而参与疾病的发生发展。本研究发现,不同地区AD组VEGF水平低于无AD组,提示VEGF水平降低与AD发展密切相关。高原低氧环境地区AD组、无AD组血清VEGF水平较平原地区对应的AD组、无AD组低;多因素Logistic回归分析显示,VEGF水平与高原低氧环境地区、平原地区及总体AD易感性均显著相关。笔者推测,由于高原低氧环境地区AD患者血清HIF-1水平升高,进而调控下游VEGF表达,导致血清VEGF水平降低,加重患者神经细胞损伤。
本研究发现HIF-1高水平患者罹患AD的危险度是低水平患者的6.174倍;VEGF高水平患者罹患AD的危险度是低水平患者的0.327倍,表明HIF-1水平升高、VEGF水平降低可增加罹患AD的危险度。交互作用分析显示,单独HIF-1升高所致的OR为6.200,单独VEGF降低所致的OR为10.075,二者共存时所致OR为21.097,属于次相乘交互作用模型,而交互作用系数为1.320>1,表明HIF-1水平升高、VEGF水平降低具有正向交互作用。究其原因可能为高原低氧环境地区常住居民神经细胞Aβ沉积严重、过度tau蛋白磷酸化,加重了体内神经细胞损伤,增加了AD的发生风险。
综上,HIF-1水平升高、VEGF水平降低与AD易感性密切相关,且高原低氧环境可进一步增加HIF-1水平、降低VEGF水平,增加罹患AD的危险度;HIF-1水平升高、VEGF水平降低对AD易感性产生了正向交互作用,并符合次相乘交互作用模型。

