桥本甲状腺炎伴甲状腺乳头状癌的多灶性影响因素分析
任红臻 张 洁
甲状腺乳头状癌(papillary thyroid cancer,PTC)是甲状腺癌中最常见的类型,也是内分泌系统恶性肿瘤中最常见的一种,占甲状腺癌的85%~90%[1]。
桥本甲状腺炎(Hashimoto′s thyroiditis,HT,以下简称桥本),也是一种比较常见的甲状腺自身免疫性疾病,又称慢性淋巴细胞性甲状腺炎(chronic lymphocytic thyroiditis,CLT)。近年来HT伴发PTC的发生率呈上升趋势,并且通常是多灶癌[2]。对于PTC的患者,多灶性肿瘤的发生率很高,尚无明确指标能预先判断HT伴发的PTC是单发癌灶还是多灶癌,并且对于HT合并PTC这一群体患者多灶性的危险指标,既往文献少有报道。多灶癌具有更高的恶性肿瘤侵袭特征[3]。然而靠目前术前的检查手段并不能完全明确是单发癌还是多发癌,所以容易发生治疗不足或治疗过度的风险。因此对于多灶性PTC危险因素的分析更为重要,对指导临床治疗方案、手术方式的选择具有重要意义,从而使得桥本甲状腺炎合并多灶性甲状腺乳头状癌患者有更加积极的预后。
资料与方法
1.临床资料:选择新疆维吾尔自治区人民医院2015年1月~2021年10月出院诊断为甲状腺恶性肿瘤的患者1492例。收集这些患者的一般临床特征、甲状腺功能、病理等观察指标。纳入标准:①所有因具备甲状腺手术指征行手术治疗,并且术后病理证实为甲状腺乳头状癌的初治病例;②合并有桥本甲状腺炎的患者。排除标准:①接受消融或接受穿刺术等数据缺失的患者;②有甲状腺功能亢进症、结核病史或有其他恶性肿瘤病史、免疫功能低下、其他重大疾病史的病例,患者术前曾行化疗、放疗或免疫治疗史,均予以排除。共纳入符合条件的患者386例。收集入组患者的性别、年龄、BMI、甲状腺功能、BRAF基因突变情况、颈部淋巴结转移、中央淋巴结转移、被膜侵犯、肿瘤最大直径等临床病理信息。本研究通过医疗大数据平台筛选符合纳入与排除标准的患者,所有涉及患者个人隐私信息全部被隐藏,仅有相关数据信息,无需签署患者知情同意书,通过科室及院内审核。
2.指标评价:桥本甲状腺炎:凡是弥漫性甲状腺肿大,质地较韧,特别是伴峡部锥体叶肿大,不论甲状腺功能有否改变,均应怀疑HT。如甲状腺过氧化物酶抗体(TPOAb)和甲状腺球蛋白抗体(TgAb)阳性,诊断即可成立[4]。年龄:根据8版AJCC癌症分期手册年龄风险分层,以55岁为年龄切点值,将甲状腺乳头状癌患者分为<55岁和≥55岁。体重指数(body mass index,BMI):BMI<25kg/m2为正常,25kg/m2≤BMI<30kg/m2为超重,≥30kg/m2为肥胖[5]。TGAb效价>116IU/ml为TGAb抗体阳性;TPOAb效价>35IU/ml为TPOAb抗体阳性。颈部淋巴结转移、中央淋巴结转移、被膜侵犯、肿瘤最大直径情况取决于术后切除病理标本所见。
3.筛查方法:采集患者的空腹静脉血,采用化学发光免疫法(德国罗氏公司Cobase601全自动电化学发光免疫分析仪)测定游离甲状腺素(free thyroxine,FT4)、游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、促甲状腺素(thyroid stimulating hormone,TSH)、甲状腺过氧化酶抗体(thyroid peroxidase autoantibody,TPOAb)、甲状腺球蛋白抗体(anti-thyroglobulin antibody,TGAb)。BRAFV600E基因检测方法采用北京雅康博公司人BRAF基因突变检测试剂盒(荧光PCR法),该试剂盒采用实时荧光PCR技术,通过特异性探针水解释放荧光,监测PCR反应的进行,确定BRAF基因突变情况。

结 果
1.入选患者的一般资料:在386例PTC合并HT患者中,男性55例(14.2%),女性331例(85.8%),患者平均年龄为48±11岁,年龄范围为18~78岁;中位BMI为24.4(22.2,27.2)kg/m2;中位TSH为2.72(1.5,3.9)μIU/ml;FT3平均值为2.9±0.4pg/ml;FT4平均值为1.2±0.2ng/dl;中位TGAb值为213.8(69.4,458.7)IU/ml;中位TPOAb值为66.4(19.4,212.9)IU/ml;BRAF突变288例(74.7%);65例(16.8%)存在颈部淋巴结转移;105例(27.2%)存在中央淋巴结转移;既存在颈部淋巴结转移又同时存在中央淋巴结转移35例(9.1%);存在被膜侵犯的患者146例(37.8%);肿瘤最大直径为0.7(0.5,1.1)cm;多发癌灶为156例(40.4%),单发癌灶为230例(59.6%)。
2.单因素分析比较PTC合并HT多灶组和单灶组之间的特点:本研究中,HT合并多灶性PTC患者156例,占总样本的40.4%,HT合并单灶性PTC患者230例,占总样本的59.6%。在一般的临床特征包括性别、年龄、BMI,以及在实验室检查方面(TSH、FT3、FT4、TGAb、TPOAb)比较,PTC合并HT多灶组与单灶组比较,差异均无统计学意义(P>0.05)。多灶性PTC合并HT组,BRAF突变患者128例(82.1%),无BRAF突变患者28例(17.9%);单灶性PTC合并HT组,BRAF突变患者160例(69.6%),无BRAF突变患者70例(30.4%),两组比较差异有统计学意义(P=0.006)。在病理特征结果比较中,无论是颈部淋巴结转移还是中央淋巴结转移,两组间差异均有统计学意义(P<0.05)。在多灶性PTC合并HT组患者中有72例(46.2%)侵犯被膜,84例(53.8%)未侵犯被膜,在单灶性PTC合并HT组患者中有74例(32.2%)侵犯被膜,156例(67.8%)未侵犯被膜,两组间比较差异有统计学意义。多灶性PTC合并HT组患者肿瘤最大直径为0.8cm,大于单灶性PTC合并HT组(0.7cm,P=0.018)。详见表1、图1。
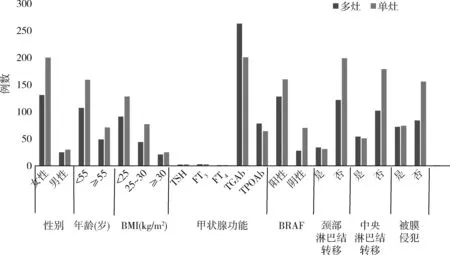
图1 单灶性与多灶性PTC合并HT患者临床特征对比分析

表1 HT伴多灶性PTC危险因素的单因素分析
3.多因素Logistic回归分析影响桥本甲状腺炎伴甲状腺乳头状癌多灶性的因素:本研究通过多因素Logistic回归分析影响桥本甲状腺炎伴甲状腺乳头状癌多灶性的因素,将BRAF基因突变、颈部淋巴结转移、中央淋巴结转移、肿瘤被膜侵犯、肿瘤最大直径引入Logistic回归模型行多因素回归分析,其中BRAF基因突变、甲状腺癌被膜侵犯对HT合并PTC多灶性有显著影响(P<0.05),是HT合并PTC多灶性的独立危险因素。而是否存在淋巴结转移、肿瘤最大直径对HT合并PTC多灶性无显著影响(P>0.05)。BRAF突变的PTC合并HT患者发生多灶癌的概率是无BRAF突变患者的1.9倍(OR=1.883,95%CI:1.135~3.123,P=0.014)。肿瘤侵犯甲状腺被膜的PTC合并HT患者发生多灶癌的概率是无被膜侵犯患者的1.8倍(OR=1.805,95%CI:1.137~2.867,P=0.012,表2)。

表2 HT伴多灶性PTC危险因素的多因素Logistic回归分析
4.PTC合并HT患者在BRAF基因突变的状态下,其多灶性与淋巴结转移、肿瘤最大直径的相关性:在单因素分析中发现BRAF基因突变、颈部淋巴结转移、中央淋巴结转移、肿瘤被膜侵犯、肿瘤最大直径均是HT合并PTC多灶性的影响因素,然而在进行多变量调整之后,发现淋巴结转移、肿瘤最大直径对HT合并PTC多灶性无显著影响,可见淋巴结转移、肿瘤最大直径对HT合并PTC多灶性无独立作用,在单因素分析观察到的与肿瘤多灶性相关可能受其他高危因素如BRAF基因突变、被膜侵犯等因素的影响。进一步选取BRAF基因突变PTC合并HT患者,观察淋巴结转移、肿瘤最大直径对HT合并PTC多灶性有无显著影响,所以在纳入人群中(HT合并PTC患者)筛选出合并有BRAF基因突变的患者进行分析。选取BRAF基因突变PTC合并HT患者288例,其中多灶肿瘤发生率为44.4%(128例),单灶肿瘤发生率为55.6%(160例)。研究结果表明,即使在单因素分析中,观察到淋巴结转移、肿瘤最大直径与肿瘤多灶性的相关性均不显著(P>0.05,表3)。

表3 BRAF基因突变阳性PTC合并HT患者多灶癌与单灶癌比较分析[n,M(Q1,Q3)]
讨 论
近年来HT伴发PTC的发生率升高,并且PTC往往为多灶癌[2]。研究表明,多灶性PTC具有甲状腺周围组织浸润的高风险,需要更广泛的手术或更密切的随访[6]。然而由于目前检查手段的局限性,以及不同医生检查水平的主观性,容易遗漏微小癌灶。有研究将PTC合并HT与单纯PTC比较显示,在PTC合并HT组中多灶癌所占的比例较大,HT的存在与多灶性呈正相关[7]。多灶癌具有更高的侵袭性特征。Zhang等[8]研究显示,多灶性PTC与单灶性PTC比较,多灶性PTC更容易发生淋巴结转移、TNM分期为晚期、更易复发。另外,有研究显示,多灶性PTC的甲状腺外侵、血管侵犯以及中央淋巴结转移的频率均高于单灶性PTC[9]。既往关于HT合并PTC的多灶性指标的研究为数不多,目前尚无明确的术前指标评估HT合并多灶性PTC发生的可能性,所以本研究针对HT合并多灶性PTC和HT合并单灶性PTC进行比较,尝试找出多方面指标来预测多灶癌的发生。本研究结果显示,桥本伴多灶性甲状腺乳头状癌和伴单灶性甲状腺乳头状癌在BRAF基因突变、颈部淋巴结转移、中央淋巴结转移、被膜侵犯、肿瘤最大直径方面比较,差异有统计学意义。BRAF基因突变、被膜侵犯是桥本合并甲状腺乳头状癌多灶性的独立危险因素。
BRAF基因突变是甲状腺癌中最常见的突变,占甲状腺肿瘤的29%~83%,其中约90%的BRAF突变是V600E突变[10]。董帅等[11]研究表明,升高的CK-19表达、BRAF突变和RET/PTC重排的存在是HT中多灶性PTC的指标,表明需要进行双侧甲状腺全切除术。双侧PTC患者BRAF突变发生率(63.4%)高于单侧PTC患者(42.3%),BRAF突变与PTC双侧性显著相关[12]。与既往文献报道一致,本研究结果显示,相对于单灶性PTC合并HT组,多灶性PTC合并HT组BRAF突变率更高。BRAF突变阳性是多灶性PTC合并HT的独立危险因素。
有文献报道,BRAF突变与PTC侵袭性特征有关联。这些侵袭性病理特征包括淋巴结转移、甲状腺外侵犯、复发风险、PTC亚型、肿瘤直径等[13]。在本研究中,经过BRAF突变、淋巴结转移、肿瘤直径校正后,甲状腺被膜侵犯仍是HT合并多灶癌的危险因素。甲状腺被膜侵犯与多灶性的风险增加有关[3]。本研究单因素分析结果显示,淋巴结转移、最大肿瘤直径是多灶性PTC合并HT的影响因素,然而,经过多因素校正后,两者均非独立危险因素。在单因素分析观察到的与肿瘤多灶性相关可能受其他高危因素如BRAF基因突变、被膜侵犯、高TPOAb浓度的影响[3~14]。进一步选取BRAF基因突变的PTC合并HT患者,进行单因素分析,结果显示虽然多灶癌在淋巴结转移中的比例大于单灶癌,但是淋巴结转移、肿瘤最大直径与肿瘤多灶性的相关性均不显著。或许是HT对于PTC起到了一定程度的保护作用,削弱了BRAF突变的侵袭作用,阻碍了淋巴结转移,需要更大样本量来进一步探究[15,16]。
本研究存在一定的局限性,由于本研究纳入样本量较小,仍需进一步补充病例数量并对PTC合并HT患者进行随访,观察术后复发、预后等情况。
综上所述,本研究通过比较HT合并单灶性PTC与HT合并多灶性PTC,发现两组患者在BRAF基因突变、淋巴结转移、被膜侵犯、肿瘤最大直径这些方面存在显著差异。另外,通过多因素Logistic回归分析得出BRAF基因突变、被膜侵犯是HT合并多灶性PTC的独立危险因素。以上结论提示,如患者临床表现、术前检验、B超及甲状腺穿刺活检等诊断PTC合并HT,那么BRAF基因突变或被膜侵犯则提示HT伴发多灶性PTC的可能性大,对于以上患者,甲状腺手术切除范围应更为广泛。这为PTC合并HT患者提供了更为个体化的手术方案,防止对于多灶性PTC治疗不足或对于单灶性PTC治疗过度的发生,减少术后复发风险及术后并发症的发生。

