苦荞抗立枯病基因FtTIR 的克隆及功能鉴定
陈媛媛 李光胜 刘洋 何毓琦 周美亮 方正武
(1 长江大学农学院,434025,湖北荆州;2 中国农业科学院作物科学研究所,100081,北京;3 湖南科技大学生命科学与健康学院,411201,湖南湘潭;4 西南大学农学与生物科技学院,400700,重庆)
作物的生长发育常受到病原微生物的侵害,在协同进化的过程中,作物逐渐形成了一系列复杂的防御机制来应对病原微生物的入侵[1]。这种防御机制是一个复杂的免疫应答调控过程,包含对病原微生物的识别、信号转导和抗病基因的调控等[2]。面对病原微生物的侵害,作物体内抗病蛋白能通过特异识别病原菌分泌的效应蛋白、介导应激反应信号转导、触发免疫响应对抗病原微生物的侵扰[3]。
TIR(toll-like receptor)基因是TIR-NB-LRR类型的抗病基因(resistance gene,Rgene)。TIR 蛋白的N 端含有白细胞介素受体TIR 结构域,能够特异识别病原菌分泌的效应蛋白,协助蛋白质之间的结合[4-5]。目前,已经从烟草[6]、拟南芥[7]和亚麻[8]中鉴定到了TIR基因,并对其功能进行了分析。在烟草中,将TIR 蛋白中与Toll 或TIR 信号转导相关的保守氨基酸位点突变后,突变的转基因烟草植株对烟草花叶病毒的抗性减弱,且病毒可以在突变位点及周围扩散[9]。此外,AtTIR基因突变后,拟南芥植株在没有病原菌诱导情况下的存活率显著降低[10]。同样,在亚麻中发现,TIR 结构域突变后,植株的抗病性也显著降低,证实TIR基因在植物抗病性中具有重要作用[11]。迄今为止,对TIR基因的研究主要集中在信号转导及病原菌识别方面。然而,关于苦荞TIR基因克隆与功能等方面的研究还鲜见报道。
苦荞是蓼科( Polygonaceae ) 荞麦属(Fagopyrum)的一种食药同源的杂粮作物,富含蛋白质、维生素、矿物质及各种药用类黄酮[12]。近年来,随着我国荞麦种植面积的不断扩大,由立枯丝核菌(Rhizoctoniasolani)侵害引起的荞麦立枯病害也呈逐年加重趋势,严重阻碍了我国荞麦产业的高质量发展。荞麦立枯病主要发生在苗期,立枯丝核菌通过侵入荞麦种子的种皮或幼苗茎基部和根部的伤口来感染荞麦植株,被感染的荞麦种皮表现为黄色或者褐色,严重时会导致种子腐烂[13]。受到感染的幼苗,前期茎基部会出现暗褐色的病斑或者水泽状,接着病斑部位不断扩大,病斑部位组织凹陷和腐烂,植株发生倒伏现象,后期幼苗发生枯萎,严重时幼苗死亡[14]。目前,荞麦立枯病的防治主要依赖喷施化学药物,虽然能有效杀死致病菌或抑制病菌的生长,但长期使用化学药物会导致土壤微生物种群减少、土壤板结和肥力下降等问题[15]。
为了解析荞麦立枯病菌的致病机理,挖掘抗病基因,本研究从苦荞中克隆了FtTIR基因,对其进行生物信息学分析和基因表达模式分析,并进一步在拟南芥中过表达FtTIR基因进行抗病性鉴定,为研究苦荞TIR基因在立枯丝核菌致病机制提供重要依据。
1 材料与方法
1.1 试验材料及处理方法
供试的立枯丝核菌株、野生型拟南芥(Col-0)、苦荞品种“品苦1 号”和植物表达载体pBI121 均由中国农业科学院作物科学研究所荞麦基因资源创新研究组提供。
选取颗粒饱满、大小均一的苦荞种子,经蒸馏水浸泡12h 后剥去外表皮。依次用1% NaClO 和75%乙醇消毒6min,然后用无菌水清洗3~5 次,将其平铺于MS 培养基上,在22℃、16h/8h 光暗周期的培养室中培养。将培养2 周后的幼苗用活化好的立枯丝核菌菌柄侵染,菌柄直径约3mm,用菌层接触无菌苗。于侵染后0、6、12、24 和48h 分别对幼苗根、茎和叶取样,用液氮速冻。
1.2 苦荞总RNA 提取和cDNA 合成
取苦荞幼苗80~100mg,按照RNA Easy Fast Plant Tissue Kit(北京天根生化科技有限公司)植物组织RNA 提取试剂盒提取样品总RNA;用HiScript®III 1st Strand cDNA Synthesis Kit(+gDNA wiper)试剂盒(南京诺唯赞生物技术有限公司)反转录合成第1 链cDNA,并于-20℃保存备用。
1.3 FtTIR 基因克隆及生物信息学分析
利用CE 软件以FtPinG0404132400.01.T01(Pinku1:http://mbkbase.org/Pinku1/)序列为参考序列,设计FtTIR基因全长扩增引物FtTIR-F/R(表1),以cDNA 为模板进行PCR 扩增。PCR 产物经电泳检验后,回收纯化。回收产物经连接和转化,筛选阳性克隆后送北京擎科生物科技股份有限公司测序,得到FtTIR-T 载体质粒。

表1 引物序列汇总Table 1 Summary of primer sequence
利用NCBI 在线网站对测序正确的序列进行blast 比对分析,确定FtTIR的开放阅读框(ORF)。利用Expasy(https://web.expasy.org/protparam/)网站预测FtTIR编码氨基酸数目、蛋白分子量(MW)、等电点(pI)等理化性质。分别利用PRABIGERLAND(https://npsa-prabi.ibcp.fr/)和SWISSMODEL(https://swissmodel.expasy.org/interactive)网站预测FtTIR 蛋白的二级结构和三级结构。利用Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)对FtTIR 蛋白进行亚细胞定位预测分析。在NCBI 网站上利用FtTIR 蛋白序列进行blast同源比对,用DNAMAN 软件进行TIR 蛋白的多序列比对,并用MEGA-X 软件构建系统发育树。
1.4 立枯丝核菌侵染下苦荞FtTIR 基因的表达模式分析
利用CE 软件设计FtTIR基因荧光定量PCR 引物FtTIR-qPCR-F/R(表1),以苦荞组成型表达基因FtH3为内参基因。使用Taq Pro Universal SYBR qPCR Master Mix 荧光定量试剂盒(南京诺唯赞生物技术有限公司)和7500 Real Time PCR System 仪器进行qRT-PCR 分析。按公式2-ΔΔCT计算基因的相对表达量。
1.5 pBI121-FtTIR 过表达载体的构建及拟南芥的遗传转化
以测序比对正确的FtTIR-T 质粒为模板,参照pBI121 图谱设计特异性引物121-FtTIR-F/R(表1)进行PCR 扩增,利用同源重组方法将FtTIR基因的全长编码区连接到空载体pBI121 中,测序比对后得到过表达载体质粒pBI121-FtTIR。
将重组质粒pBI121-FtTIR转化到农杆菌GV3101 感受态中,筛选鉴定得到阳性克隆。将阳性菌液培养至OD600=0.6~0.8,通过浸花法侵染野生型拟南芥,收取T0代转基因拟南芥种子,然后经卡那霉素抗性筛选得到T1代过表达拟南芥。以T1代过表达拟南芥叶片的DNA 为模板,载体pBI121的通用引物121F 为正向引物、121-FtTIR-R 为反向引物进行PCR 以鉴定阳性转基因拟南芥植株。筛选至纯化的T3代转基因拟南芥(FtTIR-OE)并进行后续的生理生化分析。
1.6 pBI121-FtTIR 过表达拟南芥的抗病性鉴定
采用离体叶片接种法检测转基因拟南芥的抗病性,将过表达FtTIR拟南芥T3代和野生型拟南芥种子消毒灭菌后先在MS 固体培养基上培养,7d后转移到蛭石:营养土=1:1 的混合土中培养,培养条件为25℃,光周期为光照16h、黑暗8h。取3周龄大小一致的叶片用于立枯丝核菌侵染。把叶片放置在铺有湿润滤纸的培养皿中,将活化好的立枯丝核菌平板菌打成直径0.3mm 的菌饼,菌层接触叶片正面。每个株系取15 个叶片,设置3 次生物学重复,对照使用无菌PDA 培养基。在接菌后24h统计发病情况。进一步做DAB 染色试验,并观察其病斑情况,然后检测立枯丝核菌侵染和未侵染条件下拟南芥中FtTIR和病程相关基因AtPR1的相对表达量,并测定过氧化物酶(POD)和超氧化物歧化酶(SOD)活性。
2 结果与分析
2.1 苦荞FtTIR 基因的克隆与生物信息学分析
以苦荞幼苗cDNA 为模板,经PCR 扩增获得一条长度为576bp 的目的片段(图1)。

图1 苦荞FtTIR 基因序列扩增Fig.1 Sequence amplification of FtTIR gene in tartary buckwheat
基因结构分析(图2a)表明,FtTIR基因编码蛋白与其他植物上的该基因编码蛋白具有相同的保守结构域TIR,属于TIR-NB-LRR 类型抗病基因家族,但不同植物间具有不同程度的同源性。SOPMA 在线网站分析(图2b)显示,FtTIR 蛋白二级结构包含41.36%α-螺旋、34.03%不规则卷曲、15.71%β-折叠及8.90%β-转角。三级结构预测(图2c)显示,FtTIR 蛋白与模板c5ku7B 的相似性达33%,与二级结构预测结果基本一致。利用Phyre2预测FtTIR 的三级结构,显示FtTIR 与TIR-NB-LRR型抗性蛋白rpv1(c5ku7B)的相似性达100%,与二级结构预测结果一致。系统发育分析(图2d)显示,FtTIR 蛋白与藜麦XP_021726625.1 和赤豆XP_047164412.1 亲缘关系较近,属于同一分支。

图2 FtTIR 基因的生物信息学分析Fig.2 Bioinformatics analysis of FtTIR gene
2.2 苦荞FtTIR 基因的表达模式分析
qRT-PCR 结果(图3)表明,FtTIR基因在立枯丝核菌侵染下总体表达上调,但苦荞根、茎和叶中FtTIR基因存在不同程度的诱导表达,且在根中的表达量普遍较低,在茎中的表达量较高。在茎中FtTIR基因的表达量在接菌后6h 时达到峰值,与不接菌相比表达量上调约7 倍。在根中FtTIR基因的表达量在接菌后48h 时达到峰值,且表达量仅上调0.5 倍左右。在叶中FtTIR基因的表达量在接菌后24h 时达到峰值,表达量上调约9 倍。
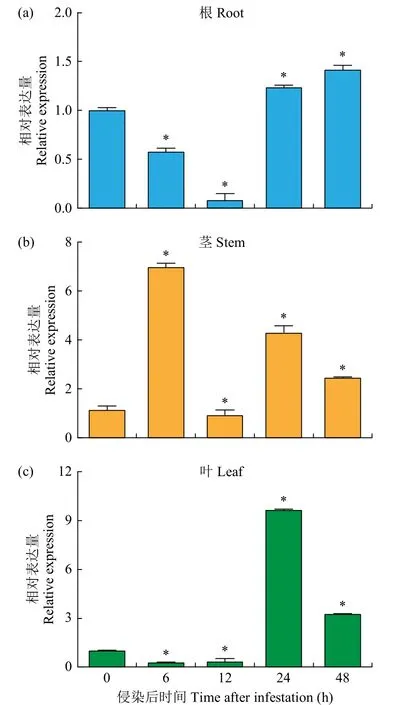
图3 立枯丝核菌侵染下FtTIR 基因在苦荞不同器官中的表达模式Fig.3 Expression patterns of FtTIR genes in different organs of tartary buckwheat under infestation with R.solani
2.3 FtTIR 过表达拟南芥的抗病性鉴定
2.3.1 过表达拟南芥叶片接种立枯丝核菌表型 选取生长状态相同的3 周龄的转基因和野生型拟南芥叶片进行立枯丝核菌接种(图4),在正常条件下,野生型(WT)与过表达拟南芥株系(FtTIR-OE)之间无明显差异。而在立枯丝核菌侵染后,过表达拟南芥株系叶片的抗病性较WT 强。

图4 转基因拟南芥的抗病性表型验证Fig.4 Phenotypic verification of disease resistance in transgenic Arabidopsis
2.3.2 DAB 染色试验 选取3 周龄的FtTIR-OE 和WT 拟南芥叶片进行立枯丝核菌侵染,对照组不作侵染。经28℃培养箱培养24h 后,用DAB 染色液对离体叶片染色20min,再用叶绿体脱色液脱色至叶片透明。如图5 所示,对照组FtTIR-OE 和WT拟南芥叶片无明显差异,而被立枯丝核菌侵染的叶片出现大量的病斑,呈棕褐色。在立枯丝核菌侵染24h 时,经DAB 染色后,FtTIR-OE 拟南芥株系叶片的病斑明显少于WT。这表明FtTIR基因对立枯丝核菌的侵害具有一定的抵抗作用。

图5 转基因拟南芥的抗病性DAB 染色验证Fig.5 DAB staining for resistance of transgenic Arabidopsis
2.4 立枯丝核菌侵染FtTIR 过表达拟南芥的表达模式
采用qRT-PCR 方法检测FtTIR-OE 和WT 拟南芥在立枯丝核菌侵染下FtTIR基因的表达模式,以Atactin为内参。如图6a 所示,FtTIR-OE 转基因株系中FtTIR基因的表达量较WT 显著提高,而在立枯丝核菌侵染后FtTIR-OE 转基因株系(OE-RS)中FtTIR基因的表达量较不侵染时(OE)的表达量显著提高。

图6 转基因拟南芥中的表达模式分析Fig.6 Analysis of expression patterns in transgenic Arabidopsis
进一步研究FtTIR在苦荞立枯病抗病信号通路中的作用,通过qRT-PCR 检测拟南芥叶片中病程相关基因AtPR1的表达水平,结果表明转基因拟南芥中AtPR1基因的表达量显著高于WT(图6b),同时在立枯丝核菌侵染下,AtPR1基因的表达量显著增加。
2.5 拟南芥抗病性相关生理生化指标分析
测定拟南芥叶片中POD 活性(图7a)发现,在WT 拟南芥中经立枯丝核菌侵染24h 条件下,POD 活性没有显著差异;而在FtTIR-OE 株系中,POD 活性在经立枯丝核菌侵染24h 后显著升高。WT 拟南芥在立枯丝核菌侵染下,SOD 活性显著低于正常条件;而在FtTIR-OE 株系中,与正常生长条件相比,被立枯丝核菌侵染24h 后,SOD 活性显著升高(图7b)。结果表明,过表达拟南芥株系在被立枯丝核菌侵染时,植株体内的POD 和SOD 活性均显著提高,表明过表达株系相较于WT 具有更强的抗病性。

图7 转基因拟南芥生理生化指标分析Fig.7 Analysis of biochemical indices in transgenic Arabidopsis
3 讨论
为了适应极端环境,植物进化出一系列防御机制来抵抗病原菌的侵害[15]。TIR抗病基因在植物的抗病信号通路中发挥着至关重要的作用[16]。荞麦的药用价值和经济价值日益显著,种植面积不断扩大,而其生产受立枯病影响日益严重[3,17]。立枯病是由立枯丝核菌感染造成的,用立枯丝核菌感染苦荞植株后,90%的植株出现坏死的褐色病变[18]。到目前为止,关于荞麦的立枯病抗病机制尚未明确。为解析苦荞对立枯丝核菌的抗病性,本研究从苦荞品种“品苦1 号”中克隆出FtTIR基因,生物信息学分析显示其具有TIR 家族特有的TIR 结构域。在苦荞苗期,立枯丝核菌侵染后的qRT-PCR 分析表明,FtTIR基因受立枯丝核菌胁迫的诱导;组织特异性分析表明,FtTIR基因在根、茎和叶中有不同的表达量,参与不同的发育阶段。
TIR基因的作用机制是通过与病原菌结合,将信号转递给转导因子[4]。转导因子与免疫反应基因的启动子相结合,诱导免疫反应基因表达,从而对病原菌产生抗性[18]。在烟草中,TIR基因的突变导致转基因烟草对烟草花叶病毒的抗性消失,且病毒的扩散速度大幅提升,说明TIR基因参与了烟草花叶病毒的信号转导[19]。在拟南芥中,TIR基因的突变导致转基因拟南芥在没有病原菌效应蛋白诱导的情况下也可以引起细胞坏死[11,20]。同样,在亚麻中TIR基因突变也导致转基因植株对条锈病的抗性消失[21]。这些研究证实,TIR基因与病原菌的效应分子识别有关,但TIR 蛋白是否直接与病原菌效应蛋白结合还有待进一步研究证实。此外,TIR基因具有调节信号转导的功能[22]。对拟南芥中TIR基因的研究[20,23]发现,TIR基因具有负调节抗性信号传导的功能,因为TIR基因的突变导致转基因拟南芥的防御反应一直处于激活状态。同样,过表达马铃薯TIR基因导致植株的病菌防御反应降低[24]。与上述研究矛盾的是,有研究[25]发现,TIR基因具有正调节功能。将TIR基因的LRR 结构域突变后,植株的抗性反应消失,说明LRR 结构域具有正调控信号转化功能。因此,TIR 是否作为植物抗病反应信号转导的负调控因子仍需进一步研究证实。
本研究中,在拟南芥中异源表达FtTIR后显著提高了拟南芥叶片对立枯丝核菌的抗病性。生理指标检测分析发现,其抗病性的提高与植物体内SOD和POD 活性的增加有关。此外,在立枯丝核菌侵染过表达拟南芥中病程相关基因AtPR1的表达水平也显著提高,这种病程相关蛋白激活了植株的防御机制,从而使植物最大程度减少损伤。本研究结果表明,FtTIR在提高苦荞对立枯丝核菌抗病性中发挥着积极作用。本研究证实了TIR基因通过激活病程相关基因PR1的表达来提高植株的抗病性,是苦荞立枯病抗性的正向调节因子,该结果为后续深入研究TIR基因调控苦荞立枯病抗病分子机制奠定了基础。
4 结论
从苦荞中克隆出TIR-NB-LRR 类型的抗病基因FtTIR,在立枯丝核菌侵染24h 后,其在苦荞根、茎和叶中表达量均有显著增加,在茎中表达量最高,表明FtTIR基因受立枯丝核菌诱导表达。过表达拟南芥离体叶片侵染和DAB 染色结果说明,FtTIR基因具有明显的抗病性。在立枯丝核菌侵染条件下,FtTIR转基因拟南芥植株的POD 和SOD活性较WT 显著提高,其抗病能力显著高于对照。

