小麦GzCIPK7-5B 基因的生物信息学及表达分析
赵鹏鹏 李鲁华 任明见 安畅 洪鼎立 李欣 徐如宏
(贵州大学农学院/国家小麦改良中心贵州分中心,550025,贵州贵阳)
小麦(TriticumaestivumL.)是我国重要的粮食作物之一,在其生长发育过程中,会遭遇各种非生物胁迫,进而严重影响产量与品质。钙调磷酸酶B 类似蛋白互作蛋白激酶(CBL-interacting protein kinase,CIPKs)是一类丝氨酸/苏氨酸蛋白激酶,能与钙离子感受器——钙调磷酸酶B 样蛋白(calcineurin B-like protein,CBL)相互作用,形成复杂的信号传递系统/网络[1]及响应干旱[2]、高温[3]、低温[4]和盐[5]等多种非生物胁迫以及应答激素信号[6-7]。
许多植物中都发现CIPKs 家族基因,如水稻、拟南芥、大麦、玉米、小麦和豌豆等[8-9]。研究[2]表明,在非生物胁迫响应方面,小麦TaCIPK2、TaCIPK27和TaCIPK23基因在拟南芥中异源过表达,可增强转基因植株的耐旱性。ZmCIPKHT基因的表达受高温胁迫的显著诱导,该基因的拟南芥过表达株系对高温胁迫表现出耐受性[3]。CIPK7在拟南芥中与冷诱导的CBL1相互作用,在冷反应中发挥作用,提升了拟南芥在冷胁迫中的耐受性[10]。CIPK24在拟南芥中过量表达提高了植物对Na+的耐受能力[11]。而OsCIPK03、OsCIPK12和OsCIPK15在水稻中过量表达可提高转基因植株的耐寒、耐旱和耐盐能力[12]。TaCIPK25过表达增强了小麦对盐胁迫的敏感性[13]。在植物对矿质营养吸收及植物生长方面,有研究[14]表明,AtCIPK23在拟南芥中通过影响铁螯合还原酶活性参与铁的获取。CIPK18在NHX5 和NHX6 介导拟南芥Li+稳态中起重要作用,且协同控制幼苗生长[15]。此外,有研究[16]发现,高浓度的蔗糖载体能够结合到UFGT1 的特异位点抑制其活性,从而抑制草莓花青素的合成,而钙/钙调蛋白能够特异地结合到UFGT1 与域间链接器部分重叠的位点,进而显著缓解底物的抑制作用。拟南芥中钙调蛋白结合蛋白CBP60g 也能够通过负调控花青素合成的结构基因(CHS、CHI和DFR)及调控基因(如PAP1)抑制蔗糖诱导的花青素积累[17]。可知,钙离子信号通路蛋白能够通过调控蔗糖途径参与花青素合成的生物学过程。
目前,在紫粒小麦花青素合成途径的结构基因方面取得了较好的研究基础,然而由于小麦基因存在于不同染色体的多拷贝以及多转录本等现象,关于其他途径如钙离子信号途径和植物激素信号途径等相关基因调控花青素合成的研究较少。CIPKs 家族是钙离子信号途径中重要的蛋白家族,且GzCIPK7-5B基因在影响小麦籽粒花青素的相关研究鲜有报道。因此,本研究以特色小麦品种贵紫麦1 号为试验材料,使用RT-PCR 克隆获得GzCIPK7-5B基因,进行生物信息学分析以及实时荧光定量验证分析,为GzCIPK7-5B基因的研究提供理论基础。
1 材料与方法
1.1 试验材料
试验以特色小麦品种贵紫麦1 号(Triticum aestivumL.cv.Guizi 1,GZ1,审定编号为黔麦2015003)为材料,种植于贵州大学农学院,取15d苗龄的根、茎、叶以及花后10、25、35d 的籽粒为样品。
1.2 试验方法
1.2.1 引物设计 从前期转录组数据库中筛选出GzCIPK7-5B基因,根据基因登录号从Ensembl Plants 数据库中下载目的基因核苷酸序列,使用Primer 5.0 设计特异性引物(表1),用于GzCIPK7-5B基因扩增、RT-PCR 和荧光定量PCR,引物由生工生物工程(上海)股份有限公司合成。

表1 试验所使用的特异性引物Table 1 Primers used in the experiment
1.2.2 总RNA 提取与cDNA 的合成 选取生长一致的15d 苗龄幼苗,利用植物总RNA 提取试剂盒[天根生化科技(北京)有限公司]提取总RNA。分别用紫外分光光度计以及1%琼脂糖凝胶电泳检测RNA 的浓度和质量。选取可用的RNA 使用试剂盒(FastKing gDNA Dispelling RT SuperMix,天根)进行反转录,获得根、茎、叶、籽粒cDNA。
1.2.3GzCIPK7-5B基因的克隆 以贵紫麦1 号15d 苗龄叶片cDNA 为模板,使用超保真DNA 聚合酶对该基因进行PCR 扩增,50µL PCR 反应体系为2×Phanta 最大缓冲液25µL、dNTP 混合物1µL、上、下游引物各2µL、超保真DNA 聚合酶1µL、DNA 模板1.5µL、ddH2O 17.5µL。扩增程序为预变性95℃3min;变性95℃15s,退火61℃15s,延伸72℃120s,循环34 次;修复延伸72℃10min,于4℃保存。产物用1%琼脂糖凝胶电泳,条件为80V/cm 电压,稳定10min 后,再升高电压到120V/cm 40min,得到目的条带。将目的基因的PCR产物送北京擎科生物科技有限公司测序。
1.2.4 生物信息学分析使用在线软件对GzCIPK7-5B基因进行生物信息学分析,包括氨基酸多重序列比对、进化树构建、蛋白的理化参数分析、磷酸化位点和亚细胞定位预测、蛋白质结构与功能预测,具体见表2。

表2 生物信息学分析软件及用途Table 2 Softwares and usage of biological information analysis
1.2.5 表达谱分析选用贵紫麦1 号15d 幼苗的根、茎、叶和花后10d 时籽粒的cDNA,用特异性引物(表1)进行RT-PCR 检测GzCIPK7-5B在各组织的表达情况。以反转录得到的cDNA 为模板进行PCR 检测。PCR 反应体系包括DNA 模板1μL、ddH2O 4.5μL、2×TaqPCR 混合物Ⅱ12.5μL、上游引物(10µmol/L)1μL、下游引物(10µmol/L)1μL,总体积20μL。PCR 反应条件为94℃5min;94℃30s,41.5℃30s,72℃1min 34 个循环;72℃5min;4℃进行1%琼脂糖凝胶电泳检测。
1.2.6GzCIPK7-5B在贵紫麦1 号花青素合成重要时期相对表达量 选用贵紫麦1 号花后10、25、35d时的籽粒cDNA,用特异性引物(表1)及qRT-PCR检测花后10、25、35d 时籽粒中GzCIPK7-5B表达情况与趋势。反应体系为cDNA 1µL、2×Talent qPCR 预混物(荧光染料掺入法)10µL、ddH2O 7.8µL、上游引物(10µmol/L)0.6µL、下游引物(10µmol/L)0.6µL,总体积20µL。反应条件为95℃预变性2min;95℃变性15s,41.5℃退火30s,72℃延伸20s,40 个循环,每个待测样设置3 个重复。以Actin 为内参基因,采用2-∆∆CT法计算目的基因表达量。
2 结果与分析
2.1 GzCIPK7-5B 基因的克隆
以贵紫麦1 号15d 苗龄叶的cDNA 为模板,利用特异性引物进行PCR 扩增(表1),凝胶电泳检测(图1)显示,GzCIPK7-5B基因(Genebank 登录号为TraesCS5B02G381500)在1296bp 有明显的条带。符合目的基因序列的长度。测序结果表明,扩增出来的基因序列与TaCIPK7-5B一致,将其命名为GzCIPK7-5B。

图1 GzCIPK7-5B 的PCR 扩增电泳图Fig.1 PCR amplification and electrophoresis of GzCIPK7-5B gene
2.2 GzCIPK7-5B 编码蛋白理化性质分析与亚细胞定位预测
利用在线工具ExPASy-ProtParam 对蛋白的理化性质进行分析。图2 显示,该蛋白的分子式为C2087H3370N606O596S20,等电点(pI)为8.82,总原子数为6679,分子量为47 128.62,带负电荷的氨基酸残基总数(Asp+Glu)为50,带正电荷的氨基酸残基总数(Arg+Lys)为55。其编码的氨基酸数量为431 个,其中亮氨酸含量最高,为63 个,占氨基酸总数的14.6%,脂肪指数为96.68,不稳定系数为53.83,表明此蛋白为不稳定性蛋白。

图2 GzCIPK7-5B 的氨基酸组成Fig.2 Amino acid composition of GzCIPK7-5B
利用Cell-PLoc2.0 进行亚细胞定位预测分析,分析结果显示该蛋白定位在细胞核。
2.3 GzCIPK7-5B 编码蛋白功能结构域、信号肽与亲疏水性分析
在NCBI 中利用CD search 对编码的蛋白进行保守结构域预测,结果(图3)显示,该蛋白含有丝氨酸―苏氨酸蛋白激酶家族保守结构域,分别是丝氨酸―苏氨酸蛋白激酶区和CBL 结合区即NAF结构域,同时还具有ATP 结合区,具有CIPK 家族基因的特征。

图3 GzCIPK7-5B 的保守结构域预测Fig.3 Prediction of amino acid conservative domain in GzCIPK7-5B
利用SingalP 5.0 Server 与SingalP 3.0 Server进行蛋白质信号肽分析。SingalP 5.0 Server 结果(图4)显示,编码蛋白具有信号肽的可能性为0.0007,推测该蛋白无信号肽;SingalP 3.0 Server结果显示,基因编码的蛋白为非分泌蛋白(D值为0.14)。

图4 GzCIPK7-5B 蛋白信号肽预测Fig.4 Prediction of signal peptide of GzCIPK7-5B protein
通过在线工具ProtScale 预测编码蛋白的亲疏水性,分析结果(图5)显示,该蛋白第213 个氨基酸表现最大疏水性,为2.79,第331 个氨基酸表现最大亲水性,为-3.69,亲水平均系数为-0.08,小于0,故推测编码蛋白为亲水性蛋白。

图5 GzCIPK7-5B 蛋白亲疏水性预测Fig.5 Prediction of affinity and hydrophobicity of GzCIPK7-5B protein
2.4 GzCIPK7-5B 编码蛋白跨膜结构域及磷酸化位点预测
利用工具TMHMM 和NetPhos 3.1Server 对蛋白质序列进行跨膜结构域预测(图6),发现此蛋白质无明显的跨膜区域,说明该蛋白不具有转运蛋白相关功能的基础结构。
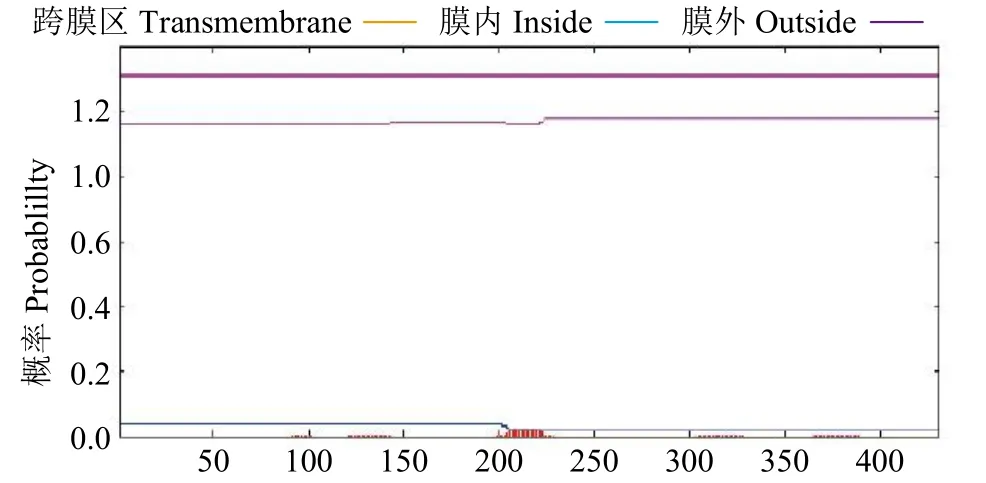
图6 GzCIPK7-5B 蛋白跨膜结构预测Fig.6 Prediction of transmembrane structure of GzCIPK7-5B protein
磷酸化位点分析结果(图7)显示,此蛋白有29 个磷酸化位点,其中丝氨酸(Serine)21 个、苏氨酸(Threonine)7 个、酪氨酸(Tyrosine)1 个。其中最有可能的潜在磷酸化位点是第142、172、282、331、341 和381 位的丝氨酸,它们的值均高于0.95,远远超过标准值(0.5),同时这一结果也表明,编码的蛋白可能通过调控相应位点的磷酸化来实现其功能。

图7 GzCIPK7-5B 蛋白磷酸化位点预测Fig.7 Prediction of phosphorylation site of GzCIPK7-5B protein
2.5 GzCIPK7-5B 编码蛋白二、三级结构预测分析
利用SOPMA 在线网站分析编码蛋白的二级结构(图8)发现,该蛋白由α-螺旋(有155 个氨基酸,占35.96%)、无规则卷曲(有155 个氨基酸,占35.96%)、延伸链(有81 个氨基酸,占18.80%)和β-转角(有40 个氨基酸,占9.28%)二级结构组成。

图8 GzCIPK7-5B 蛋白二级结构预测Fig.8 Prediction of secondary structure of GzCIPK7-5B protein
使用SWISS-MODEL 进行三级结构预测,结果(图9)显示,该蛋白三级结构由1 个PDB 号为6c9d.1.A 的结构为模板建立,6c9d.1.A 属于KA1自抑制MARK1 激酶(丝氨酸/苏氨酸蛋白激酶)的晶体结构,序列一致性为31.34%。推测蛋白可能参与相关激酶的合成。

图9 GzCIPK7-5B 蛋白三级结构预测Fig.9 Prediction of tertiary structure of GzCIPK7-5B protein
2.6 GzCIPK7-5B 基因进化树分析与同源氨基酸序列比对
在NCBI 数据库中获取野生二粒小麦(Triticum dicoccoides)和拟南芥(Arabidopsisthaliana)等15 个物种的CIPK 家族蛋白基因,利用MEGA7.0进行同源性聚类分析,构建系统进化树,结果(图10)显示,GzCIPK7-5B基因与野生二粒小麦TdCIPK7-5B、AtCIPK7-5D、TdCIPK7-5A和TaCIPK7同源性较高。利用DNAMAN 将GzCIPK7-5B与野生二粒小麦TdCIPK7-5B、节节麦AtCIPK7-5D、野生二粒小麦TdCIPK7-5A、小麦TaCIPK7和小麦TaCIPK7-5A基因的蛋白质序列进行同源性序列比对,结果(图11)显示,它们的同源性分别为100.00%、99.07%、98.84%、98.61%和98.61%。综合多重序列比对和系统进化树分析,可知GzCIPK7-5B在小麦中相对保守,与野生二粒小麦的TdCIPK7-5B在生物学功能上更为接近。

图10 GzCIPK7-5B 基因的进化树分析Fig.10 Phylogenetic tree analysis of GzCIPK7-5B gene

图11 GzCIPK7-5B 氨基酸多重序列比对Fig.11 Multiple sequence alignment of amino acids GzCIPK7-5B
2.7 GzCIPK7-5B 基因的表达谱分析
为了分析GzCIPK7-5B在贵紫麦1 号不同组织中的表达,取15d 苗龄幼苗的根、茎、叶以及花后10d 时的籽粒为样品,以cDNA 为模板,Actin 为内参基因,进行RT-PCR 检测。结果(图12)显示,GzCIPK7-5B在贵紫麦1 号的根、茎、叶、籽粒中均有表达,叶与根中表达量高于茎和籽粒。

图12 GzCIPK7-5B 的表达谱分析Fig.12 Expression profile analysis of GzCIPK7-5B
2.8 GzCIPK7-5B 在贵紫麦1 号籽粒花青素合成重要时期的相对表达量
分析前期贵紫麦1 号不同灌浆时期花青素积累的转录组数据发现,GzCIPK-7-5B在不同时期差异表达。为了确定GzCIPK7-5B在贵紫麦1 号籽粒花青素合成重要时期的表达变化水平,取花后10、25、35d 时的籽粒为样品进行qRT-PCR 验证。结果(图13)显示,在籽粒发育的3 个时期中,与花后10d时相比,在25d 时GzCIPK7-5B显著升高,然后在35d 时降低,且25 和35d 时极显著上调(P<0.01)。

图13 GzCIPK7-5B 在贵紫麦1 号籽粒花青素合成关键期的相对表达量Fig.13 Relative expression levels of GzCIPK7-5B in the critical period of anthocyanin synthesis in GZ1 grains
3 讨论
作为植物中普遍存在的激酶,CIPKs 在逆境胁迫信号传导中起着重要作用。它能与钙离子感应蛋白CBL 结合实现信号转导,激活下游相关基因。CIPKs 蛋白具有2 个特定的结构域,分别为N 端的蛋白激酶催化结构域和C 端的调节结构域。其中C端含有特定的由24 个氨基酸组成的高度保守的NAF 结构域。目前在许多植物中都鉴定出了该家族的基因,如水稻[18]、玉米[8]、拟南芥[18]和高粱[19]等。本研究中,GzCIPK7-5B具有该家族典型的N端蛋白激酶催化结构域和NAF 结构域,说明GzCIPK7-5B具有该家族的相似功能。
CIPKs 家族基因响应多种非生物胁迫。研究[20]发现,干旱和高盐胁迫显著诱导小麦TaCIPK23基因的表达。谷子SiCIPK16基因在低温胁迫下表达量呈现上调[21]。CIPK8基因在大豆中响应干旱胁迫,根和叶表达量呈上调[22]。在紫花苜蓿中,不仅对干旱有响应,还对低温和盐胁迫有应答[23]。此外,CBL-CIPKs 网络还参与调节矿质元素的吸收和转运。研究表明,CIPK23参与调节根系对K+的吸收[24-25],通过对高铁还原酶活性的调节参与拟南芥对铁的获取[14],还涉及通过磷酸化转运体(CHL)调节CHL 对硝酸盐的亲和力[26]。GzCIPK7-5B具有CIPKs 家族的典型特征,可能对干旱、低温和高盐等胁迫存在响应以及与矿质营养元素吸收有关。因此,该基因在小麦中的具体功能值得进一步研究。
CIPKs 家族基因在植物不同组织中广泛表达[27-28],本研究中,贵紫麦1 号GzCIPK7-5B的表达也有一定差异,其在根、茎、叶和籽粒中均有表达,根和叶中表达水平高于茎和籽粒。可能在该时期GzCIPK7-5B对根系和叶的生长发育影响较大。GzCIPK7-5B属于钙离子信号通路系统中的钙调磷酸酶B 类似蛋白互作蛋白激酶基因,且在贵紫麦1号籽粒花青素生物合成3 个重要时期(花后10、25、35d),相比于10d,GzCIPK7-5B基因的表达量在25 和35d 时显著上调,表明该基因与小麦籽粒花青素的积累有关。
4 结论
GzCIPK7-5B具有CIPKs 家族的典型特征。CDS 序列长1296bp,编码431 个氨基酸,蛋白含有29 个磷酸化位点,无跨膜结构,是一种无信号肽的不稳定亲水性质的核蛋白。该基因与野生二粒小麦TdCIPK7-5B的序列相似度最高,亚细胞定位显示该基因定位于细胞核。GzCIPK7-5B在根、茎、叶、籽粒表达具有组织特异性,在籽粒花青素合成关键期表达量具有显著变化,其中在花后25 和35d表达水平较10d 时显著升高。该结果丰富了小麦CIPK7基因资源,也为探讨钙离子信号途径参与小麦籽粒花青素积累奠定了基础。

