磁共振SWI和QMS技术在中枢神经系统退行性疾病中的应用特点
马怡群,温 杰,张东锐
(1.沧州医学高等专科学校 医学技术系,河北 061000;2.河北省沧州中西医结合医院 影像中心,河北 061000)
中枢神经系统退行性疾病包括帕金森病、阿尔茨海默病、亨廷顿病等,其主要病理特点是异常的神经元细胞在神经系统或整个大脑的部分区域中迅速死亡,最终导致大脑功能的丧失,包括认知和运动能力[1]。铁元素在神经核团的过量沉积被认为是引起神经细胞衰落和凋亡的因素之一,因此测量脑内的铁沉积量有助于相关疾病的诊断。与PET和SPECT核医学神经影像学技术相比,磁共振技术在脑铁含量测量方面有无电离辐射、检查成本低、性价比高等优点。铁作为一种顺磁性物质,过量的铁沉积会引起脑组织局部磁场磁化率微观变化,磁共振磁敏感加权成像(susceptibility-weighted images,SWI)和定量磁敏感成像(quantitative susceptibility maps,QSM)都可以利用组织间的磁化率差异来测量铁含量,但是基于重建算法的不同,两者在临床应用中有着各自的优缺点。本文以帕金森病为例,讨论SWI和QSM 这两种技术在中枢神经系统退行性病变中的应用特点,通过物理原理分析其产生差异的原因。
1 材料与方法
1.1 研究对象
本实验的研究对象为临床确诊的30例早期PD患者,年龄67.4±82岁,男女各占一半,要求家族史和帕金森病严重程度相当,正常对照组人数、年龄等要求与病例组相匹配。在检查前,所有被试者均排除包括有进行性核上麻痹和其他神经退行性疾病、头部损伤史、脑炎、暴露于神经抗精神病药物的患者。
1.2 检查方法
所有被试者均利用3.0 T磁共振设备进行常规MRI序列、QSM 序列及SWI序列扫描,把黑质、红核、苍白球、壳核、尾状核、丘脑作为感兴趣区。扫描结束后,由两位经验丰富的影像科医师对以上6个感兴趣脑区进行测量,获得数据。其中,利用QSM技术成像时,对传入工作站的原始影像进行图像后处理,获得磁敏感图,测量其磁敏感值。利用SWI技术成像时,对原始图像经过后处理,获得SWI图像,并在校正相位图上测量其相位值。所有脑区都取最大层面作为感兴趣区,连续测量三次,取其双侧的平均值。采用SPSS 19.0统计软件进行数据处理。对PD组和对照组的磁敏感值、相位值以均数±标准差的形式表示,分别进行组间独立样本t检验,比较两组同一感兴趣区的磁敏感值和相位值差异,以P<0.05为差异有统计学意义。
2 结果
2.1 QSM 检测比较各个脑区磁敏感值
在QSM 检测中,发现PD组黑质、壳核的磁敏感值显著高于对照组,差异有统计学意义(P<0.05),而两组间其他脑区相比,磁敏感值均无显著性差异(P>0.05)。见表1。
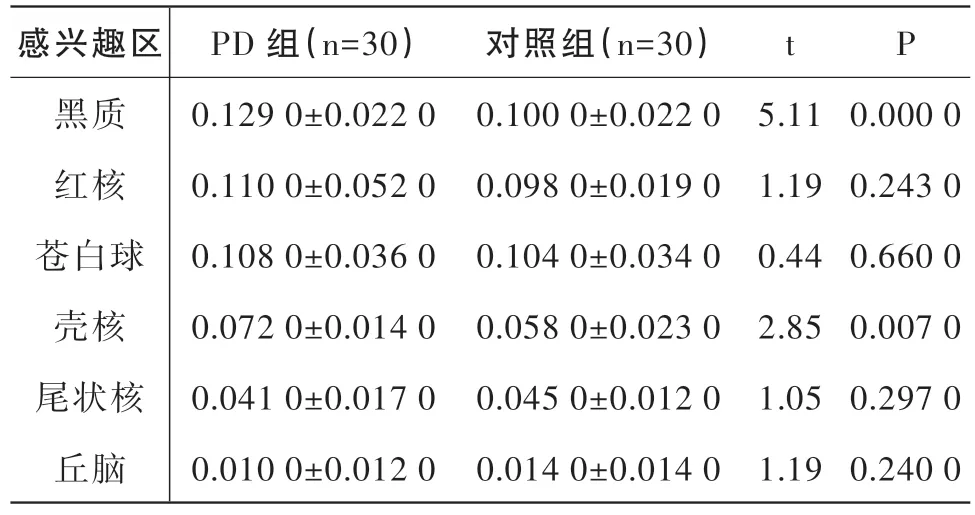
表1 PD组和健康对照组各个感兴趣脑区磁敏感值比较
2.2 SWI检测比较各个脑区相位值
在SWI检测中,发现PD组黑质的相位值显著高于对照组,差异有统计学意义(P<0.05),见表2。而两组间其他脑区相比,相位值均无显著性差异(P>0.05)。见表2。
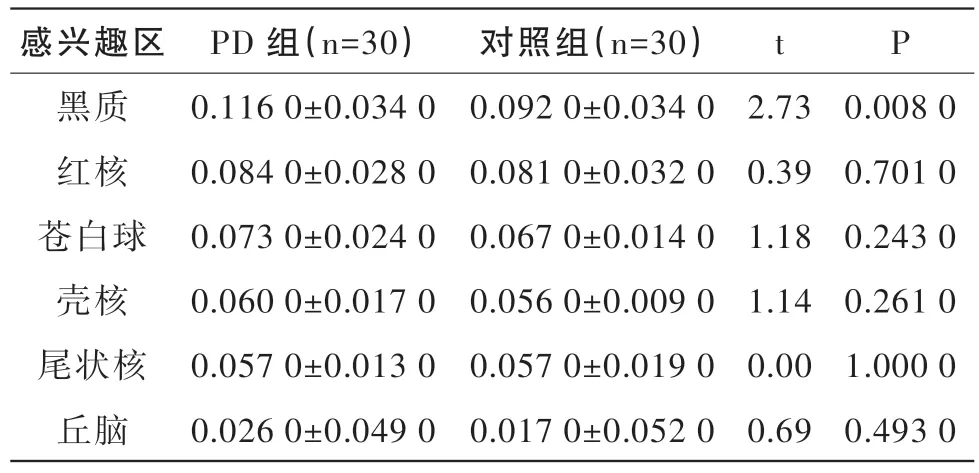
表2 PD组和健康对照组各个感兴趣脑区相位值比较
3 讨论
帕金森病(PD)是最常见的神经退行性疾病之一,临床特点就是发病初期病理改变不太明显,随着脑部神经元的退行变性和丢失,多种症状才会逐渐显现。铁对大脑的生理生化过程是必不可少的,然而,由于它的异常积累,导致过氧化氢反应超载,由此产生的羟基自由基会引起氧化应激,进而导致神经元的凋亡,因此,它被认为是致病因素之一[2],在分布上,具有区域特异性和时间特异性[3]。许多研究表明,PD患者过量铁沉积往往存在于一些特定的脑区,如黑质、壳核、红核等部位。不同脑区的铁沉积可以作为多种PD临床亚型鉴别的指标之一[4]。有学者认为,不同脑区的铁含量进展情况会随疾病病程的发展而改变,如黑质和苍白球中的铁会随病程的加重而增加,尤其是在疾病后期增加更为显著。红核和壳核的铁含量在PD早期显著增加,但在PD后期可能不会继续增加[5]。Kathuria等(2020)[6]研究发现,黑质体-1的缺失虽然不能区分特发性帕金森病和非典型帕金森综合征,但是可以作为对退行性帕金森综合征诊断的潜在影像学标志物。Eichhof(2021)[7]比较SWI和QSM这两种技术,证实在QSM 图中的黑体-1可视化效果最佳。Ren等(2022)[8]利用SWI技术鉴别早期帕金森病和多系统萎缩-帕金森病亚型,发现后者的豆状核后部狭窄,定量的形态学变化为临床辅助诊断提供了参考,这可能有助于医生在早期区分这两种病症。这些铁沉积的特征和研究进一步证实了帕金森病是一种高度特异性的疾病。因此,及时和准确地检测大脑不同区域的脑铁沉积情况,有助于PD之类的神经退行性疾病的诊断。
本文检测铁沉积采用SWI和QSM 两种方法,SWI利用相位图间接反映不同脑区的铁含量,而QSM通过磁化率图能对同一脑区的铁含量进行更加精确的测量。对两组被试者分别采用这两种技术检查,发现QSM检查中,黑质和壳核的磁敏感值与正常对照组相比,具有显著差异;SWI检查中,只有黑质的相位值与正常对照组相比,具有显著差异,说明这两个部位均出现了铁的异常沉积,并且QSM 技术更加敏感。在现有的磁共振新技术中,SWI和QSM都是利用组织间的磁化率差异来成像,铁作为一种顺磁性物质,局部组织含量越高,引起的磁场偏移现象就越严重,原则上利用两种技术推断出过量铁沉积的感兴趣区应该一致,但是基于原理的不同,壳核用SWI检测无明显差别,而QSM却能检测出显著差异。
从物理原理上分析这两种技术在临床使用中产生差异的原因,它们的序列基础都是利用梯度回波技术得到相位信息图,初步处理后,再进行解缠绕和去除背景场,SWI得到相位掩膜图,QSM得到局部场图。SWI是用处理好相位掩膜图的n次方乘以原始的幅值相,得到磁化率加权图像,而QSM是用处理好的局部场图进行反演获得真实的磁化率分布。把每个主要步骤拆开,按数据处理流程依次如下:①在对相位信息图的初步处理上,SWI对相位图作线性拟合,一般采用线性最小二乘法,但是噪声点较多,在进行线性拟合时,偏离大,导致结果偏差较大,磁共振信号的噪声分布复杂,采用这种方法进行场图拟合,除躁效果欠佳;而QSM采用基于最小二乘法的非线性拟合,直接对相位信号进行处理,不需要提前在时间维上解缠绕,虽然计算复杂,但是除噪效果好,为后续处理提供更多的有用信号。②解决相位解缠绕的问题,SWI图像相位处理主要采用零差滤波法,优点是算法简单且运行时间短,容易实现,能在一定程度上滤除相位伪影,但是同时也滤掉了一部分有用信号,它没有专门针对噪声相位进行解缠绕,并不能完全解决相位缠绕的问题;QSM在解决相位缠绕问题上常用的是拉普拉斯法和区域生长法,两者分别从空间维和时间维上更加彻底地解决了噪声相位缠绕的问题。③背景场去除,SWI常用的是零差高通滤波法滤除总场图中的低频部分,但对具有高频背景场的边界部分滤波效果不理想。同时,局部场中低频信息也被滤除,减少了有用信号,可能使最终的重建结果中含有磁化率伪影,降低图像质量,影响有效信号的提取;QSM有偶极场投影法、复杂调和伪影去除法和拉普拉斯边界值法等,其中前两者都会在边界处产生伪影,一定程度上影响诊断,而拉普拉斯法采用经典的偏微分方程拉普拉斯方程或者泊松方程,它用各种算法求解边界值,最大限度地接近真实值,正是这种基于物理和数学的方法,使背景场的滤除效果更好。因此,QSM比SWI更能得到真实的有效信息。④经过前面几步的处理,SWI得到相位掩模版,QSM得到局部场图,SWI将原始的幅值图与相位掩膜版的n次方相乘得到磁化率加权图像,QSM通过对局部场图进行磁化率反演获得真实磁化率分布图,常用的有傅里叶域法和空间域法。QSM所用的这些特殊的重建算法与SWI相比,计算更加复杂,但它最终的图像会更加精确。因此,从理论上讲,QSM技术克服了SWI技术的一些弊端,在反映铁含量分布方面也更为准确和敏感[9]。
从临床使用上看,SWI和QSM都属于非侵入性的磁共振技术,都具有高空间分辨率、无创、多序列和高重复性的优点。已经有大量的文章报道SWI测量颅铁含量的有效性,然而它的测量结果不够准确,尤其是疾病发展早期,容易漏检[10],本次研究也证明了这个问题。SWI的临床应用较为广泛,它还可以利用组织间的磁化率差异来增强图像对比度,最终在MRI数据中产生不同的相移。例如,SWI采用最小强度投影技术获得高分辨率的脑静脉结构轮廓,这是它在所有MRI技术中独有的特征[11]。多项研究证明,SWI已被熟练应用于各种微出血的诊断,其敏感性高于CT[12]。SWI使用氧气作为对比剂,不仅能够帮助区分旧出血和最新的出血,还可以识别活动性出血,避免使用造影剂,更利于人体检测[13]。SWI对脱氧血液和颅内矿物质沉积较为敏感,被广泛用于颅内出血、创伤性脑损伤、中风、肿瘤和一些神经变性疾病的诊断[14]。尽管如此,SWI对磁化率的测量并非直接的,而是间接的。随着新技术QSM和磁化率张量成像的发展,这一问题已经得到解决。从目前来看,QSM技术已被证实是定量计算颅内铁含量最准确的方法[15]。本次研究发现,QSM在疾病的早期阶段检测出黑质和壳核中铁含量增加异常,提示QSM可能作为一种早期诊断工具,与以往的研究结果一致。QSM还可以评估大脑两侧黑质内铁沉积的不对称性[16],亦可用于检测在病程发展中铁含量的增加快慢,这与疾病进展息息相关[17]。脑深部电刺激术(deep brain stimulation,DBS)作为一种治疗神经退行性疾病的新技术,最早用于治疗帕金森病,现在也用于阿尔茨海默病。DBS手术是在患者大脑特定部位植入刺激电极,通常选在丘脑底核(subthalamus nucleus,STN)中。手术前需要精确定位椭球状丘脑底核的大小和位置,最大限度保证手术的治疗效果,避免电极放置不正确产生的副作用。与CT和超声等其他影像方式相比,MRI可以说是STN成像的最佳成像工具,但STN在传统的MRI序列上仍然不能很好地显示出来。由于STN 具有较高的铁含量,与T2加权(T2w),T2*加权(T2*w)和SWI相比,QSM 的显示效果最好。使用7TMRI的QSM 可以更好地提高STN的可视化影像对比度,还可以有效地检测STN中下端的铁的增加量,在组织学上已经得到验证。因此,QSM是目前最好的DBS手术成像技术,可以显著降低与DBS电极放置不准确相关的无效治疗率[18]。
两者相比,QSM有以下优点:①QSM可以进行磁化率量化分析,在评价铁含量上更加准确和敏感。②QSM对含铁脑区的大小和形状的描述更加准确,不会因磁场的形状、回波时间、方向和强度的改变而产生显著差异。与此相反,SWI中相位图会受到含铁组织的几何形状和静态主磁场的定位方向等因素影响,导致它不能真实反映磁化率的空间分布。因此,通过测量相位值来反映相关脑区含铁量的准确率较QSM低。③QSM可以区分各种分子磁化率,在检测顺磁铁和抗磁钙化上,准确率高于SWI,这在肿瘤分类中很有用,还可以测量创伤性脑损伤患者的微出血[19]。SWI会因为参数选择的差异影响脑出血检测的准确性,QSM的定量磁化率图可以有效克服诸如回波时间等参数对成像信号的影响。④在临床上,QSM可用于监测PD患者的铁螯合剂去铁治疗,也可监测血脑屏障封堵后多发性硬化病变的阴燃性炎症和血脑屏障封堵前多发性硬化病变的活动性炎症[20]。
两者相比,QSM的缺点:①多回波序列执行时间较长,整个脑扫描通常需要5-10 m in,是一种较慢的成像技术。在这段时间里保持病人的头部稳定并不容易,特别是像患有帕金森这样疾病的被检者,不适合进行临床检查[21]。②由于QSM采集数据的方式是3D采集,与SWI成像相比,尽管它已借助于高性能计算机采用多种优化算法,但在进行计算重建时仍具有相当大的难度。同样,在QSM 技术中,哪种TE值最适合评估对脑铁最敏感的问题仍未完全解决。以上种种原因,使得QSM在临床使用中不如SWI普及[22]。
定量磁化率图谱提供了一种新的、定量的磁化率对比,因此可作为组织磁化率的体内表征。QSM有望为健康和病变组织中有关其成分的变化提供独特的病因学诊断信息,该方法向获得更具体的组织特性成像迈进重要一步。此外,该技术是神经成像设备的一个主要补充,鉴于其较高的特异性,在常规应用中具有重要意义。因此,QSM作为一种定量评估组织特性的MRI工具,其不可或缺的地位越来越突出[23]。
综上所述,QSM作为近几年兴起的磁共振成像技术,已经在越来越多的定量检测中显示出了优势,并在很多科研和临床中取得了良好的效果。虽然目前一些缺点制约着其发展,但相信随着科学技术的进步,QSM定会带给医疗界不一样的惊喜。

