甘蓝型油菜酪氨酸代谢关键基因FAH的克隆、功能鉴定和表达分析
支添添 周舟 陈纪鹏 韩成云
(1. 宜春学院生命科学与资源环境学院 宜春学院江西省作物生长发育调控重点实验室,宜春 336000;2. 宜春学院化学与生物工程学院,宜春 336000)
酪氨酸降解途径在动物中必不可少,若中断将导致严重的代谢疾病[1-3]。这条途径首先在动物和细菌中被发现[4-5],是一条非常重要的代谢途径。Dixon等[6]证明拟南芥(Arabidopsis thaliana)中存在酪氨酸降解途径的关键酶,并且和动物中有相同的功能。越来越多的证据表明,植物具有典型的酪氨酸分解代谢途径[7-13]。延胡索酰乙酰乙酸酶(fumarylacetoacetate hydrolase, FAH)是酪氨酸代谢途径的最后一个酶,FAH(SSCD1)基因的突变导致拟南芥在短日照下产生模拟病斑并激活植物防御[11-12]。
模拟病斑突变体是一类在没有明显的逆境、损伤或病原物侵害时,在叶片上能自发地形成类似病原物侵染后的坏死斑的突变体,这类突变体在植物中广泛存在,如拟南芥、水稻(Oryza sativa)、玉米(Zea mays)、高粱(Sorghum bicolor)、小麦(Triticum aestivum)、大麦(Hordeum vulgare)等中均有报道[14-19]。这些突变体往往能激活植物体的系统获得性抗性,通常具有与抗病反应相关的细胞学和生物化学特征,对许多病原物表现出局部和系统抗性,是研究植物抗病机理的理想材料[20],如bon1(bonzai1)和cpr1/cpr30模拟病斑突变体对丁香假单胞菌有抗性[21-22]。水稻模拟病斑突变体oscul3a对稻瘟病菌和黄单胞菌均有很强的抗性[23],大麦mlo突变体对白粉病具有非特异性抗性[24],小麦模拟病斑突变体Ning7840和lm3分别对叶锈病和白粉病具有抗性[25-26]。
研究表明模拟病斑突变体的抗病性与植物抗病信号中的水杨酸(salicylic Acid, SA)、茉莉酸(jasmonic acid, JA)、乙烯(ethylene, ET)等信号分子均有相关,这些植物激素不同程度地参与了抗病过程中的不同环节,起着非常重要的作用[27-32]。前期研究证实sscd1突变体产生模拟病斑的同时积累JA,同时激活调控JA/ET信号途径的部分病程相关基因PDF1.2,VSP1和SA病程相关基因PR1[12]。尽管sscd1中的模拟病斑的产生伴随着SA诱导基因PR1的上调,但与SA信号转导无关;而JA信号通路的中断显著抑制sscd1模拟病斑的产生[12]。这些结果说明FAH基因突变在短日照下激活拟南芥抗病信号途径从而调控植物抗病。
甘蓝型油菜(Brassica napus L.)是我国重要的油料作物,是第一大国产食用植物油来源和我国第二大饲用蛋白源[33]。然而,各种病害的频繁发生严重影响着油菜的产量和品质[34]。因此,挖掘油菜抗病相关遗传资源、提高油菜抗病性对于油菜生产具有重要意义。甘蓝型油菜是白菜(Brassica rapa, AA, 2n=20)和甘蓝(Brassica oleracea, CC,2n=18)通过自然杂交形成的异源四倍体作物(AACC,2n=4X=38)[35-36],白菜和甘蓝的基因组在古老的多倍化事件中都经历了3倍化的过程[37]。因此,甘蓝型油菜相比拟南芥,具有更加复杂的基因组特征并且大多数基因具有多个同源拷贝,具有冗余或不同的功能[38]。尽管在拟南芥中已证实FAH基因突变在短日照下产生模拟病斑并激活抗病反应,但鉴于甘蓝型油菜相比拟南芥基因组更复杂,仍需要鉴定不同FAH基因在甘蓝型油菜中的功能并分析其各自的表达模式。
本研究从甘蓝型油菜克隆了2个与拟南芥高度同源的FAH基因BnaA06g38260D(BnaA06FAH)和BnaC05g49430D(BnaC05FAH),通过生物信息学分析其编码的蛋白质序列和进化关系;构建过表达载体转化拟南芥突变体sscd1进行功能验证;进一步对BnaA06FAH和BnaC05FAH启动子进行克隆,探究其序列特征和潜在的响应元件,构建含有报告基因GUS的植物表达载体,通过GUS染色揭示其表达模式,为深入研究BnaA06FAH 和BnaC05FAH在甘蓝型油菜中的作用和功能奠定基础。
1 材料与方法
1.1 材料
甘蓝型油菜品种为‘westar’、拟南芥(Arabidopsis thaliana)生态型为哥伦比亚(Columbia, Col‑0),突变体sscd1、大肠杆菌菌株DH5α、农杆菌菌株GV3101、启动子分析载体pCAMBIA1301和过表达载体pBI121均由宜春学院江西省作物生长发育调控重点实验室保存。拟南芥sscd1突变体在短日照下产生模拟病斑[11]。
1.2 方法
1.2.1 DNA、RNA的提取及cDNA合成 待甘蓝型油菜长到四叶期,取适量的新鲜的叶片用液氮研磨,用高效植物基因组DNA提取试剂盒(北京天根生化科技有限公司)提取叶片基因组DNA,使用分光光度计(ND‑1000, NanoDrop, Thermo Fisher Scientific)检测浓度后储存于‑20℃,用作克隆启动子序列的模板;用Trizol(RNAiso Plus, 宝生物工程有限公司)提取总RNA,进一步用DNase I(RNase Free,Thermo Fisher Scientific)去除基因组DNA后利用反转录试剂盒ReverTraAce qPCR RT试剂盒(perfect real time, Toyobo),将RNA反转录成cDNA,用作克隆CDS序列的模板。
1.2.2 BnaA06FAH和BnaC05FAH的CDS序列和启动子的克隆以及载体的构建与转化
1.2.2.1 引物设计及目的片段的扩增 在甘蓝型油菜数据库(https://www.genoscope.cns.fr/brassicanapus/)中获得BnaA06FAH和BnaC05FAH的cDNA预测序列。利用软件Primer premier 5.0在2个基因非编码区设计特异引物(表1),用TaKaRa高保真DNA聚合酶进行PCR扩增,以扩增得到的cDNA为模板,在BnaA06FAH和BnaC05FAH上游引物的5′添加Xba I(TCTAGA)限制性内切酶和保护碱基(GC)以及下游引物5′添加Sac I(GAGCTC)限制性内切酶和保护碱基(C)(引物见表1),再次进行CDS序列的PCR扩增,目的片段大小预期为1 266 bp,经1.0%琼脂糖凝胶电泳检测、回收并纯化,测序。

表1 试验所用引物Table 1 Primers used in the experiment
在NCBI中获得BnaA06FAH和BnaC05FAH翻译起始位点ATG上游1.8 kb左右的DNA序列,根据启动子序列,利用软件Primer premier 5.0分别设计扩增引物(表1),在上下游引物的5′端分别加上Xba I和Bgl II酶切位点及其保护碱基,以‘westar’总DNA为模板进行PCR扩增,目的片段大小预期为1 980 bp(BnaA06FAH)和1 708 bp(BnaC05FAH),经1.0%琼脂糖凝胶电泳检测、回收并纯化,测序。
1.2.2.2 35S∷BnaC05FAH和35S∷BnaA06FAH重组载体的构建 用限制性内切酶Xba I和Sac I对已测序验证的BnaA06FAH和BnaC05FAH的CDS序列和pBI121载体分别进行双酶切,然后将目的片段和载体进行连接,使目的基因替换原载体上的GUS,构建35S∷BnaC05FAH和35S∷BnaA06FAH过表达载体,转化大肠杆菌DH5α感受态细胞,挑取菌落进行PCR鉴定,对鉴定的阳性菌落进行测序,以确保载体构建的准确性。
1.2.2.3 pBnaC05FAH∷GUS和pBnaA06FAH∷GUS重组载体的构建 用限制性内切酶Xba I和Bgl II对已测序验证的BnaA06FAH和BnaC05FAH的启动子序列及pCAMBIA1301载体进行双酶切,然后进行连接,用BnaA06FAH和BnaC05FAH启动子替换pCAMBIA1301载体上原有35S启动子。通过热激法将连接产物转化至大肠杆菌DH5α,随机挑选阳性克隆进行菌落PCR及酶切检测,测序。将测序验证正确的阳性克隆进行摇菌和质粒提取。
1.2.2.4 拟南芥的遗传转化及筛选 用CaCl2冻融法将已验证的重组质粒转入农杆菌GV3101,挑选菌落PCR验证正确的农杆菌单菌落进行培养,28℃、220 r/min振荡培养18-24 h。7 352 r/min离心活化菌液2 min,弃上清,用农杆菌悬浮液(5%蔗糖+1/2 MS+0.02% Silwet‑L77+0.01% 6‑BA)将菌体重悬至OD600为0.6-1.0。利用浸花法转化拟南芥,收取T0代种子,在含有潮霉素(25 mg/L)或卡那霉素(50 mg/L)的MS培养基上筛选成功转入表达载体的转基因植株,将筛选到的转基因植株T0代抗性苗移入土中,后代单株收种。挑选T2代抗性符合3∶1分离比的转基因株系,用GUS组织化学法检测启动子活性。
1.2.3 生物信息学分析 PLANTCARE在线分析启动子序列包含的顺式作用元件(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)。用Bioxm2.7软件分析BnaA06FAH和BnaC05FAH序列的开放阅读框(open reading frame, ORF)。从NCBI数据库中下载不同物种FAH蛋白的氨基酸序列,用DNAMAN 6.0软件对氨基酸序列进行比对,用MEGA 11.0软件对氨基酸序列进行系统进化树分析。
1.2.4 GUS组织染色 根据潮霉素抗性在MS固体培养基上筛选pBnaC05FAH∷GUS和pBnaA‑06FAH∷GUS转基因拟南芥至T3代,用GUS染色液(GUS Blue KIT, 北京华越洋生物科技有限公司)对MS培养基上9和14 d的拟南芥进行GUS染色,并将14 d幼苗移栽到土中生长至抽薹开花,剪下茎前端进行染色:将拟南芥被配置好的染色液完全覆盖,抽真空2-3次,每次10 min后,用锡箔纸包好,37℃孵育24 h,70%乙醇脱色3 d,每天更换到脱色完全。染色结束后将植株置于体式显微镜下(Nikon SMZ800N)观察并拍照记录。
1.2.5 RT‑qPCR 采用SYBR qPCR混合试剂盒(Toyobo)和ABI 7300序列检测系统(Applied Biosystems, Foster City, CA, USA)按照说明书进行实时定量PCR。RT‑qPCR检测的基因引物见表1,以ACTIN2作为内参。每个样本的基因表达量在3次分析重复中计算,相对表达量用2-ΔΔCt方法定量。所有试验至少重复3次。表中的数据表示为RT‑qPCR中3次生物重复的平均值±SE。
2 结果
2.1 BnaA06FAH和BnaC05FAH的CDS序列扩增
根据AtFAH氨基酸序列,通过BnIR(Brassica napus multi‑omics information resource)进行BLAST比对,获得同源性最高的2个甘蓝型油菜(Brassica napus L.)FAH基因:BnaA06g38260D(BnaA06FAH)和BnaC05g49430D(BnaC05FAH)。根据基因cDNA序列设计引物,以甘蓝型油菜品种‘westar’叶片cDNA为模板进行扩增,获得BnaA06FAH和BnaC05FAH的CDS序列(图1),测序。
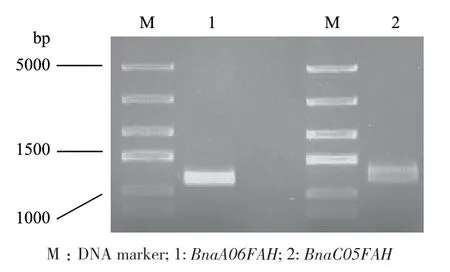
图1 BnaA06FAH和BnaC05FAH CDS序列的PCR扩增Fig. 1 PCR products of CDS sequences of BnaA06FAH and BnaC05FAH
2.2 BnaA06FAH和BnaC05FAH的CDS序列生物信息学分析
测序后的CDS序列翻译成氨基酸序列,与拟南芥AtFAH(NP 172669.2)进行同源比对,同源性分别为93.11%和92.40%(图2‑A)。基于BnaA06FAH和BnaC05FAH的氨基酸序列,与萝卜、拟南芥、荠菜、亚麻芥、玉米和短花药野生稻的FAH基因全长预测氨基酸序列构建系统进化树,结果(图2‑B)显示,甘蓝型油菜中该基因与白菜和甘蓝的亲缘关系最近,其次是萝卜,再而是拟南芥,与单子叶植物的亲缘关系较远。

图2 BnaA06FAH和BnaC05FAH氨基酸序列比对(A)和进化树分析(B)Fig. 2 Amino acid sequences alignment(A)and phylogenetic tree(B)of BnaA06FAH and BnaC05FAH
2.3 BnaA06FAH和BnaC05FAH的功能验证
为了验证BnaA06FAH和BnaC05FAH的功能,构建35S∷BnaA06FAH和35S∷BnaC05FAH过表达载体,通过浸花法转入拟南芥sscd1突变体,以T2代纯合株系的莲座叶cDNA为模板,分别选择4个独立株系进行荧光定量PCR分析,结果(图3)显示,BnaA06FAH和BnaC05FAH在sscd1突变体中本身无表达,其相对表达量为0;拟南芥突变体sscd1转基因植株中35S∷BnaA06FAH‑sscd17‑2和35S∷BnaC05FAH‑sscd14‑11的相对表达量最高,作为后续试验的研究材料。

图3 过表达拟南芥株系中BnaA06FAH和BnaC05FAH的相对表达量Fig 3 Relative expressions of BnaA06FAH and BnaC05‑FAH in overexpressed A. thaliana line
当在拟南芥sscd1突变体中过表达甘蓝型油菜BnaA06FAH和BnaC05FAH,sscd1突变体在短日照下的模拟病斑完全被抑制(图4)。结果表明,甘蓝型油菜BnaA06FAH和BnaC05FAH的功能都与拟南芥AtFAH相似。
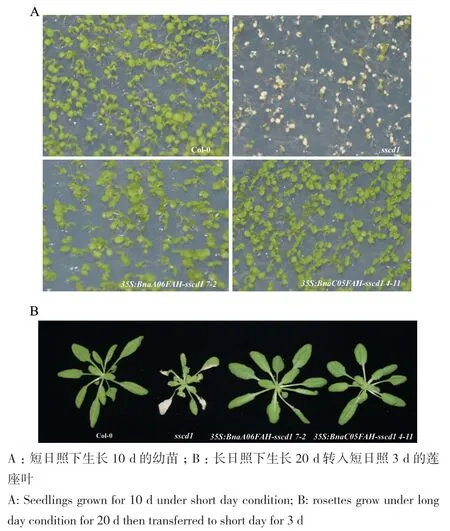
图4 短日照下过表达BnaA06FAH和BnaC05FAH抑制拟南芥突变体sscd1的模拟病斑Fig. 4 Overexpressions of BnaA06FAH and BnaC05FAH repress the simulated disease spot in Arabidopsis mutant sscd1 under short-day condition
2.4 BnaA06FAH和BnaC05FAH启动子序列的扩增和生物信息学分析
在甘蓝型油菜数据库和NCBI中获得BnaA‑06FAH和BnaC05FAH对应的基因组序列,选取ATG上游1.8 kb左右的序列。以甘蓝型油菜‘westar’基因组DNA为模板,设计特异性的引物进行PCR扩增(表1),分别获得BnaA06FAH和BnaC05FAH的启动子片段(图5)。在TAIR(http://www.arabi‑dopsis.org/)网站获得拟南芥AtFAH基因(AT1G12050)ATG上游1.8 kb的启动子序列,通过PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)数据库在线分析,并与BnaA06FAH和BnaC‑05FAH启动子顺式作用元件进行比较。结果发现,BnaA06FAH、BnaC05FAH和AtFAH启动子序列除了都含有基本转录元件CAAT‑box、TATA‑box外,还含有多种应答元件。应答元件又可分为生长发育、光响应、胁迫响应和激素响应4类元件(图6),说明甘蓝型油菜BnaA06FAH和BnaC05FAH和拟南芥AtFAH的表达都可能响应光、植物激素和胁迫的诱导。生长发育类别中,涉及胚乳表达(AAGAA‑mo‑tif)、昼夜节律(circadian)和玉米醇溶蛋白代谢(O2‑site)等,其中O2‑site占比例最高,为43%。光响应有12种顺式作用元件,包括AE‑box、AT1‑motif、ATCT‑motif、Box 4、G‑Box、G‑box、GA‑motif、GT1‑motif、Sp1、TCT‑motif和MRE,其中G‑box占比最大,为21%。胁迫响应类别有6种顺式作用元件,分别与防御应激(STRE、as‑1)、厌氧诱导(ARE)、脱水(DRE core)、创伤(WRE3和WUN‑motif)和病原诱导(W‑box)相关,其中as‑1和WRE3所占的比例最高,为32%。激素响应类别中的元件包括脱落酸(ABRE、ABRE3a、ABRE4)、生长素(TGA‑element、TGA‑box)、赤霉素(GARE‑motif)、茉莉酸甲酯(CGTCA‑motif、TGACG‑motif)应答元件,其中响应茉莉酸甲酯的顺式作用元件占比最大,为25%。另外,这些应答元件还参与抗病响应,如W‑box、ERE、GT1‑motif、G‑box、as‑1、TGACG‑motif和CGTCA‑motif,其中BnaA06FAH、BnaC05FAH和拟南芥AtFAH共有的启动子顺式作用元件有as‑1、GT1‑motif、TGACG‑motif和CGTCA‑motif,说明无论拟南芥还是甘蓝型油菜FAH基因的表达很可能与植物抗病性相关。
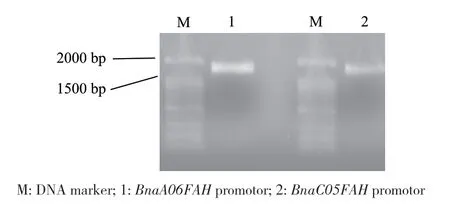
图5 BnaA06FAH和BnaC05FAH启动子的PCR扩增产物Fig. 5 PCR products of BnaA06FAH and BnaC05FAH promotors

图6 AtFAH、BnaC05FAH和BnaA06FAH启动子应答元件分析Fig. 6 Analysis of promoter response elements of AtFAH, BnaC05FAH and BnaA06FAH
BnaA06FAH相比BnaC05FAH与拟南芥AtFAH启动子共同拥有更多顺式作用元件,如激素响应顺式作用元件(ABRE、ABRE3a、ABRE4)、光响应元件(Sp1和G‑box)、脱水响应元件(DRE core)和创伤响应元件(WRE3, 表2)。除了两者共同的启动子顺式元件,两者都存在特异的启动子顺式作用元件:BnaC05FAH特异的大部分都是光响应元件(如AE‑box、GA‑motif和AT1‑motif);而BnaA06FAH没有光响应元件,有激素防御相关(GARE‑motif、TGA‑element、W‑box)诱导和与生长发育相关的顺式调控元件(表3)。说明甘蓝型油菜BnaA06FAH和BnaC05FAH的表达调控可能存在差异。
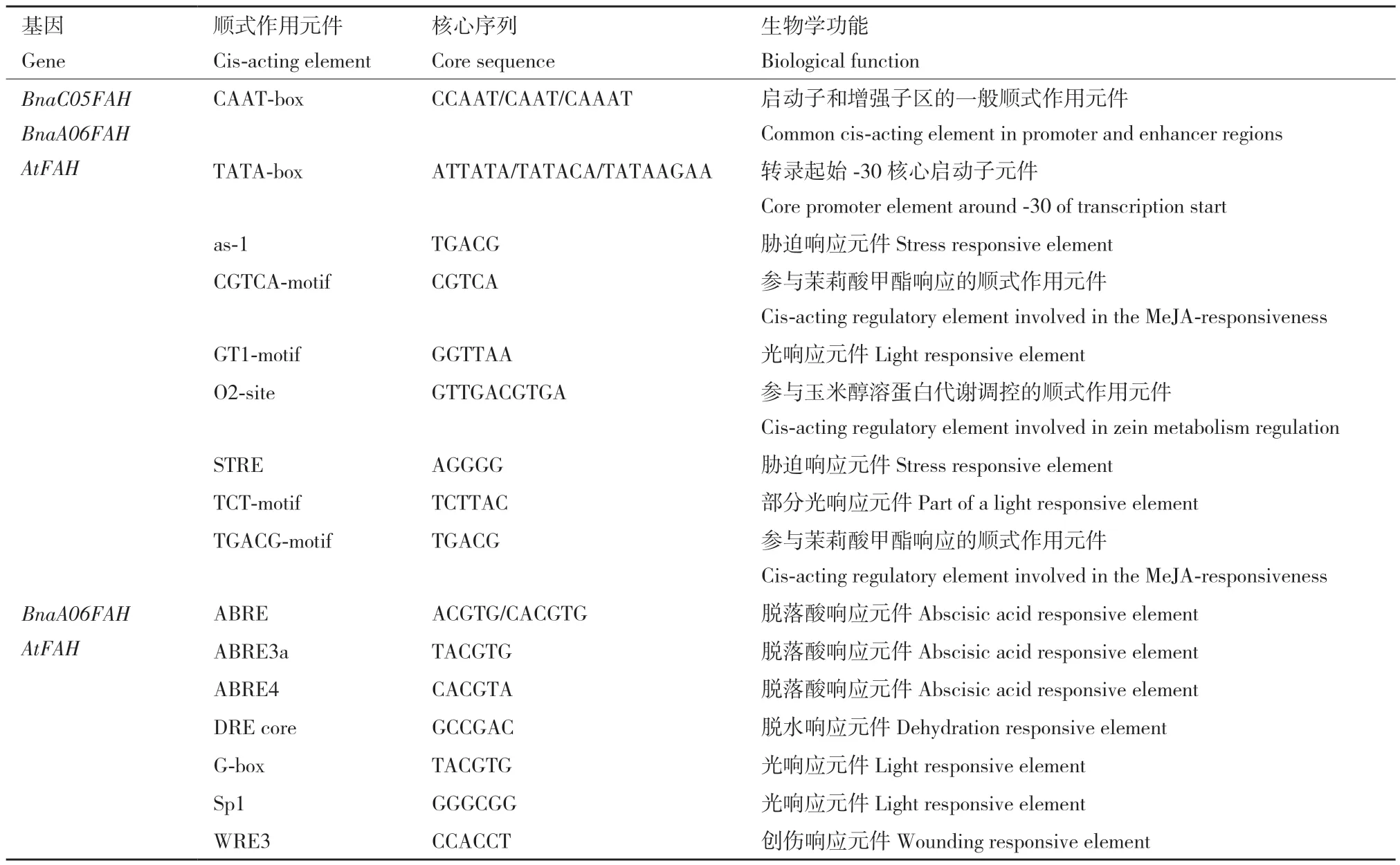
表2 BnaC05FAH、BnaA06FAH和AtFAH启动子区共同顺式作用元件Table 2 Common cis-acting elements in BnaC05FAH, BnaA06FAH and AtFAH promoter regions

表3 BnaC05FAH、BnaA06FAH和AtFAH启动子区包含的不同顺式作用元件Table 3 Different cis-acting elements in BnaC05FAH, BnaA06FAH and AtFAH promoter regions
2.5 BnaA06FAH和BnaC05FAH表达模式分析
为了探明BnaA06FAH和BnaC05FAH的表达模式,构建BnaA06FAHPro∷GUS和BnaC05FAH‑Pro∷GUS融合表达载体,通过电击法转入根癌农杆菌GV3101中,并通过农杆菌介导的浸花法转化野生型拟南芥Col‑0,利用潮霉素抗性筛选转基因拟南芥至T3代,同时以未转入任何载体的GV3101菌株侵染的拟南芥作为阴性对照(CK)。分别对生长9和14 d的T3代阳性和阴性植株幼苗、花和角果进行GUS组织化学染色,在实体显微镜下观察染色情况。结果(图7)显示,在9 d的幼苗中,转化BnaC05FAHPro∷GUS和BnaA06FAHPro∷GUS的阳性植株都在子叶、叶柄、下胚轴和根部位检测到GUS的表达;待植株生长至14 d,BnaC05FAHPro驱动的GUS几乎在所有部位都有表达,而BnaA06FAHPro∷GUS转基因植株中GUS表达集中在子叶、幼嫩的真叶、下胚轴以及根。对花的染色结果显示,BnaC05FAHPro∷GUS转基因植株中GUS在茎秆、花萼、花丝,雌蕊的柱头、花柱和子房中表达,相比之下,BnaA06FAHPro∷GUS转基因植株的表达部位只集中在茎秆、花萼、花柱和子房,而柱头、花药、花丝和花瓣都没有表达;二者幼嫩角果里的胚珠都可以染色,但BnaC05FAHPro∷GUS转基因植株角果的心皮上也有染色。表达强度上,转化BnaA06FAH启动子的阳性苗组织蓝色斑点颜色在所有时期均比转BnaC05FAH启动子的阳性苗浅,说明BnaC05FAH启动子对GUS的驱动强度明显比BnaA06FAH强。综上所述,BnaA06FAH和BnaC05FAH启动子驱动GUS在拟南芥中的表达在无论其组织部位还是强度上都存在明显差异。

图7 甘蓝型油菜BnaC05FAH、BnaA06FAH启动子驱动GUS在拟南芥中的表达Fig. 7 GUS expressions driven by BnaC05FAH and BnaA‑06FAH promoters from B. napus in Arabidopsis seedlings
3 讨论
油菜是仅次于玉米和油棕的第三大重要油料作物[39]。甘蓝型油菜具有株型高大或较高大,单产高和适应性强等优良特性,成为我国和全世界主要栽培和种植的油菜类型[40]。但是,在甘蓝型油菜的生长过程中会遭受很多病害的威胁,目前,生产上主要釆用栽培和化学的方法防治病害,但其效果十分有限[41-42]。因此,选育抗病品种无疑成为油菜抗病育种最根本也是最有效的方法。然而,当前栽培的甘蓝型油菜品种缺少相关抗性基因,严重制约着油菜抗病育种进程。近年来,植物功能基因组学和基因工程的研究发展迅猛,特别是在模式植物拟南芥中抗病相关基因以及抗病分子机制研究取得了突破性进展。在与拟南芥同科的甘蓝型油菜中,克隆和研究抗病相关基因,对提高甘蓝型油菜的抗病性具有重要的理论和实践意义。
油菜与拟南芥同属十字花科芸薹属植物,研究证明二者基因组的同源性很高。课题组前期研究证实酪氨酸降解途径在植物中具有生物功能,编码酪氨酸降解途径FAH的基因SSCD1突变后导致拟南芥在短日照下产生模拟病斑[8],并激活JA/ET途径和病程相关基因的表达[11]。本研究克隆两个与拟南芥高度同源的甘蓝型油菜FAH基因BnaA06FAH和BnaC05FAH,分析发现其编码的氨基酸序列与拟南芥ATFAH的氨基酸序列相似性高达93.11%和92.40%,分子进化分析表明,BnaA06FAH和BnaC05FAH虽然分别与白菜和甘蓝同源性最高,进化关系最近,但与拟南芥同样具有较高同源性,并且BnaA06FAH和BnaC05FAH在双子叶植物中亲缘关系较近,而与单子叶植物的亲缘关系较远。通过构建过表达载体,进一步验证2个甘蓝型油菜FAH基因的过表达都能抑制拟南芥突变体sscd1在短日照下模拟病斑的形成,说明FAH基因在甘蓝型油菜中的功能很可能与拟南芥非常相似。另外,对甘蓝型油菜和拟南芥FAH基因启动子区域顺式作用元件的分析表明,AtFAH和BnFAH的启动子中包含7种参与抗病响应的顺式作用元件(W‑box、ERE、GT1‑motif、G‑box、as‑1、TGACG‑motif和CGTCA‑motif)以及植物激素响应元件。W‑box是一类植物病原诱导相关基因的顺式作用元件[43-44],ERE元件能够调控真菌诱导表达,分别存在于BnaA06FAH和BnaC05FAH启动子中。G‑box能与bZIP蛋白结合[45],分别存在于BnaA06FAH和AtFAH的启动子中。三者的启动子中都含有GT1‑motif和as‑1元件,GT1‑motif的表达由病原体诱导,部分与GT‑1‑like转录因子相互作用,GT‑1‑like转录因子结合病程相关PR‑1a启动子,影响水杨酸诱导基因的表达水平[46]。另外,三者启动子都含有响应JA的TGACG‑motif和CGTCA‑motif。JA响应死体型病原菌的侵入,并且能诱导许多植物产生防卫应答反应。在拟南芥中,酪氨酸代谢相关基因TAT3、HGO、MAAI以及FAH(SSCD1)的表达已证实受到JA的诱导[11]。综上所述,甘蓝型油菜FAH基因BnaA06FAH和BnaC05FAH的功能很可能与拟南芥相似,并且都与抗病和JA相关。
芸薹属是十字花科中包含许多重要经济作物的一个属,包括白菜、甘蓝、油菜等常见的蔬菜和油料作物,是农业育种研究中非常重要的研究材料。甘蓝型油菜由二倍体祖先种白菜(B. rapa, 2n=20,AA)和甘蓝(B. oleracea, 2n=18, CC)经过自然杂交形成的[27]。萝卜是十字花科植物中与芸薹属亲缘关系最近的物种[47],研究者普遍认为芸薹属及其近缘属萝卜属起源于一个共同的祖先种,因此在进化树分析中,甘蓝型油菜FAH基因与白菜和甘蓝亲缘关系最近,其次是萝卜,再者是拟南芥。白菜是芸薹属第一个完成基因组测序的栽培种,通过与拟南芥的比较基因组分析发现,它们有着很好的共线性关系。甘蓝也是一种重要的蔬菜作物,与白菜比较发现其基因组局部上存在着大量的染色体重排,特定通路内基因的保留以及同源基因的表达也存在显著差异[48]。甘蓝型油菜BnFAH基因一个来源白菜(BnaA06FAH),另一个来源甘蓝(BnaC05FAH)。启动子顺式作用元件分析结果表明,与BnaC05FAH相比,BnaA06FAH和拟南芥拥有更多相同的顺式作用元件,此外,它们存在各自的特异顺式元件。GUS组织化学染色结果显示,BnaA06FAH和BnaC05FAH启动子驱动GUS在不同生长时期拟南芥中表达的部位和强度都存在差异,BnaC05FAH在各种生长时期拟南芥中的表达都比BnaA06FAH强;在14 d莲座叶、花及果荚中,不仅表达强而且表达的部位更多。综上所述,甘蓝型油菜BnaA06FAH和BnaC05FAH无论是启动子顺式元件还是启动子驱动的组织表达上都存在差异,这些结果为深入研究甘蓝型油菜BnaA06FAH和BnaC05FAH的功能奠定基础,为油菜抗病育种工作提供种质资源。
4 结论
克隆获得与拟南芥AtFAH同源性最高的2个甘蓝型油菜FAH基因BnaA06FAH和BnaC05FAH,其编码的氨基酸序列与拟南芥的同源性高达93.11%和92.40%。过表达BnaA06FAH和BnaC05FAH都能够完全抑制拟南芥sscd1突变体在短日照下的模拟病斑表型。二者可能都与模拟病斑形成相关。甘蓝型油菜FAH基因BnaA06FAH和BnaC05FAH的功能与拟南芥AtFAH高度相似,但两者的启动子在拟南芥中对下游基因的驱动无论在强度还是部位上均存在显著差异。

