烟草半胱氨酸蛋白酶家族和相应miRNAs的鉴定及其对PVY的响应
尹国英 刘畅 常永春,3 羽王洁,4 王兵 张盼 郭玉双
(1. 贵州省烟草科学研究院,贵阳 550081;2. 西南大学农学与生物科技学院,重庆 400715;3. 山西农业大学农学院,晋中 030800;4. 黑龙江大学现代农业与生态环境学院,哈尔滨 150006)
植物半胱氨酸蛋白酶是一类水解蛋白质和多肽的酶,广泛影响着植物的生理过程和逆境胁迫响应[1]。CPs基因家族包括6个亚家族,C1A、C2A、C12、C13、C14、C15。C1是木瓜类蛋白酶,是6个亚家族中最大的一类,具有广泛的底物特异性,与叶片衰亡过程密切相关[2-3],分为C1A和C1B两个亚类。其中,C1A携带用于分泌的信号肽并含有二硫键[4];C1B位于细胞质中,不具有二硫键[5]。C2属于钙依赖半胱氨酸蛋白酶,是一种不含信号肽且主要为胞浆蛋白的多肽[6],其中只包含C2A一个亚类。C12又称泛素C‑末端水解酶,对泛素C末端Gly形成的键的水解具有高度选择性[7]。C13是液泡加工酶,参与许多生理生化过程中的蛋白质加工[8]。C14属于天冬氨酸特异性的半胱氨酸蛋白酶,可以调控细胞凋亡级联反应机制[9],包括C14A和C14B两个亚类。C15为焦谷氨酰肽酶I(PGP‑1),在哺乳动物中可以介导焦谷氨酸的释放[9]。
植物依赖半胱氨酸蛋白酶活性来应对各种外部刺激,包括生物和非生物胁迫[10]。研究发现,半胱氨酸蛋白酶能增强植物对病原物的免疫力,通过识别病原物的特定结构域来激发植物体产生多种免疫反应,诱发植物产生程序性死亡[11]。例如,半胱氨酸蛋白酶AtRD19缺失引起拟南芥对青枯病(bacterial wilt)的抗病性明显减弱[12],烟草半胱氨酸蛋白酶NtC14沉默后对疫霉(Phylophthora capsici)的感病性显著增强[13]。烟草半胱氨酸蛋白酶NtCP6,可以与控制胚胎基底细胞系中程序性死亡的半胱氨酸蛋白酶抑制剂基因NtCYS互作[14]。马铃薯Y病毒属(Potyvirus)的病毒是植物中已知的种类最多的一类RNA病毒,在世界各地许多作物中造成较大的产量损失[15-16]。烟草是公认的植物遗传学和功能基因组学研究的模式植物,也是我国重要的经济作物,PVY可引起烟草叶脉坏死病,发病严重时减产可达80%以上。
近几年来,miRNA在植物病毒侵染过程中的作用也成为了病毒研究热点[17-18],很多miRNA可以参与抗病毒调控[19],这些miRNA可以通过调控植物病原物相关分子模式触发的免疫反应进行抗病毒应答[20-21]。烟草中nta‑miR6019/6020等能够切割烟草的N基因从而降低烟草对烟草花叶病毒(Tobacco mosaic virus, TMV)的抗性[20]。尽管miRNA参与植物病毒调控的研究相继出现,但与PVY互作调控的研究十分有限。2016年,Iqbal等[22]发现了86个靶向PVY基因组151个不同位点的miRNAs,PVY基因组的CI基因被32个miRNAs靶向,但尚未对调控PVY的miRNA进行功能验证。对烟草small RNA测序发现,携带PVY病毒的烟草体内的大量miRNAs表达量发生了显著变化[23-24]。本研究使用生物信息学方法,在全基因组水平上对烟草半胱氨酸蛋白酶家族以及靶向该基因家族的miRNAs进行鉴定,分析其在PVY感染后的表达特性。旨在阐明半胱氨酸蛋白酶基因家族及其对应的miRNAs互作调控烟草PVY的响应过程。
1 材料和方法
1.1 材料
1.1.1 植物材料 普通烟草(Nicotiana tabacum L.)栽培品种K326。
1.1.2 病原微生物 PVYN(potato virus Y‑vein necro‑sis strain,烟草叶脉坏死型)病毒,该病毒以机械摩擦的方式接种到健康的烟草活体植株以保存病毒毒源。
1.1.3 基因组及数据库文件 Pfam_A 来源于 Pfam数据库(http://ftp.ebi.ac.uk/ pub/data bases/Pfam/curre nt_release/);烟草K326的基因组文件来源于茄科数据库(ftp://ftp.solgenomics.net/)。
1.1.4 试剂 RNA提取试剂盒(ER601‑01)和反转录试剂盒(AT311)均购自北京全式金生物技术股份有限公司;定量PCR试剂盒(FP210422)购自天根生化科技(北京)有限公司,其他常规试剂均为国产分析纯。
1.2 方法
1.2.1 半胱氨酸蛋白酶基因家族鉴定 从MEROPS数据库(Release 12.0)(http://www.ebi. ac.uk/merops)获得半胱氨酸蛋白酶氨基酸序列及Pfam登录号。在Pfam数据库中下载人工标注的结构域文件Pfam‑A.hmm(http://ftp.ebi.ac.uk/pub/databases/Pfam/current_release/),并在茄科基因组网络数据库(ftp://ftp.solgenomics.net/)中下载Nicotiana tobacum_K326的基因组文件,包括蛋白序列(prot)、基因序列(fa)、全基因组注释信息(gff3),作为原始数据。根据MEROPS数据库的Pfam信息,在Pfam上查找相关结构域的登录号,分别为:C1A(PF00112)、C2A(PF00648)、C12(PF01088、PF12252、PF13898)、C13(PF01650)、C14A(PF00656)、C15(PF06162、PF01470),并分别将6个结构域及其登录号放进新建文本中。利用TBtoolsv1.0987的hmm search功能,将对应的蛋白序列、Pfam‑A.hmm文件、目标结构域列表放到对应位置,输出结果文件,所得结果中会包括两部分,分别是序列得分和结构域得分。对得到的结果进行筛选,首先利用Excel将数据分列,取同时满足e‑value在e-10以下,Domain覆盖度在90%以上和bits得分在60以上的基因,并与MEROPS数据库下载的半胱氨酸蛋白酶氨基酸序列进行BLAST,得到70个目标序列;利用TBtoolsv1.0987的Fasta Extract工具,输入蛋白文件和目标基因的蛋白序列,提取蛋白序列和基因序列;将筛选得到的半胱氨酸蛋白酶基因家族成员的基因名称、蛋白名称、起始位点、亚家族分类整理到Excel表中,并对其重命名。
1.2.2 构建系统发育进化树 按照重命名后的基因ID将K326的蛋白序列整理成一个fasta文件,用MEGA11打开该文件,通过Alignment‑Align by MUSCLE进行序列比对,选择默认参数,将结果输出为meg文件。点击Phylogenetic Analysis构建进化树,选择邻接法(neighbor‑joining),设置参数Test of Phylogeny为Bootstrap Method,重复数设为1 000。得到进化树,保存为Newick格式。将Newick格式的文件输入到EvolView网站(https://www.evolgenius.info/)进行美化,将美化后的进化树输出为PDF。
1.2.3 结构域分析 将筛选后的半胱氨酸蛋白酶基因家族蛋白序列文件输入到MEME网站(https://meme‑suite.org/meme/tools/meme)中,Motif数量设为20,其余参数默认。下载Motif图和结果文件中的Mast.xml文件。利用TBtoolsv1.0987的Visualize Domain Pattern功能将mast文件可视化,得到结构域分析结果利用PhotoshopCS6将系统进化树与结构域一一对应。
1.2.4 启动子分析 利用TBtoolsv1.0987的GXF Sequence Extract功能处理从数据库中得到的全基因组注释文件和基因组文件,选择上游的2 000 bp序列,输出结果。利用TBtoolsv1.0987的Fasta Extract or Filter(Quick)功能,输入上一步的结果文件和目标基因序列。将上述结果文件放到Plantcare的Search for CARE中,等待网站分析结果,下载汇总文件(https://bioinformatics.psb.ugent.be/webtools/plantcare/html/)。用Excel打开结果文件,筛选保留最后一列中有一定查看目的的元件,将基因名称、起止位点、Domain名称单独提取出来,并将目标基因ID和长度(2 000 bp)创建到一个新的文件中。利用TBtoolsv1.0987的Basic Biosequence View功能得到启动子元件展示图。
1.2.5 基因表达模式分析 使用Guo等[25]2017年发表的K326的RNAseq数据,分析感染PVYN后半胱氨酸蛋白酶基因在烟草叶片中的表达情况。首先,提取鉴定的半胱氨酸蛋白酶基因的在PVYN感染前后的FPKM数据,然后利用TBtools的HeatMap进行可视化。为了分析靶向烟草半胱氨酸蛋白酶家族基因的miRNAs,根据课题组前期在PVY感染后small RNA测序和转录组测序[25],利用psRNATarget软件预测miRNA的靶基因,筛选和鉴定靶向半胱氨酸蛋白酶家族基因的miRNAs。使用Cyctoscape软件对miRNAs与烟草半胱氨酸蛋白酶基因之间的调控关系进行可视化展示。
1.2.6 PVY接种 所有烟草植株均种植于温室,确保植株处于无菌无毒的环境中,待4叶期取一半植株作为实验组,另一半作为对照组。实验组用实验室保存的PVYN毒源通过摩擦接种法接种烟草从上往下数第二片和第三片叶,接种过的烟草在温室中隔离种植。15 d后收取出现感染症状的烟叶,保存于‑80℃冰箱备用,每个处理取3次生物学重复。对照组用磷酸缓冲液进行模拟接种,15 d后用同样的方法取接种叶片保存备用。
1.2.7 RT‑qPCR 利用全式金RNA提取试剂盒(ER601‑01)的实验步骤提取实验室保存的K326无毒叶片和接有PVY病毒的叶片样本的RNA。根据反转录试剂盒(AT311)的实验步骤合成cDNA的第一条链,进行PCR扩增,利用琼脂糖凝胶电泳进行检测。根据附表1中候选基因RT‑qPCR引物,用RT‑qPCR试剂盒(FP210422)进行RT‑qPCR扩增,以Actin(Accession: XM_009589609.3)作为内参基因,然后将反转录所得的cDNA稀释后,应用SYBR Green PCR反应体系于荧光定量PCR仪中进行扩增。RT‑qPCR反应条件为:95℃,5 min;95℃,20 s,58℃,20 s,共40个循环;72℃,40 s。RT‑qPCR反应体系:cDNA 1 μL,2×Talent qPCR PreMix(SYBR Green)10 μL,50×ROX Reference Dye 0.2 μL,上、下游引物各1 μL,RNase‑free Water补充至20 μL。用2-ΔΔCT公式进行计算表达量。
2 结果
2.1 烟草半胱氨酸蛋白酶基因家族成员的鉴定
从MEROPS数据库获得烟草和拟南芥CPs氨基酸序列及6个结构域对应的Pfam,对烟草蛋白序列进行HMM分析和BLAST检索,经过筛选后在烟草K326中共得到70个目标CPs基因。将这些基因按照顺序重命名为Nta_CP_1-Nta_CP_70。基因对应的信息汇总在附表2中,包括蛋白ID、基因ID、分类和重命名信息,以及基因在染色体上的起止位点、Domain的起止位置。
2.2 烟草半胱氨酸蛋白酶系统发育进化分析
根据已发表文献和MEROPS数据库获得拟南芥的半胱氨酸蛋白酶氨基酸序列,将烟草K326的半胱氨酸蛋白酶氨基酸序列进行MUSCEL比对,构建系统发育进化树(图1),结果表明烟草K326的半胱氨酸蛋白酶基因家族可以分为5个亚家族,分别是C1A、C2A、C12、C13、C14A,值得注意的是,根据文献半胱氨酸蛋白酶基因家族可以被分为6个亚类,除了上述5个之外还有C15,而K326的原始数据中属于C15结构域的基因不符合筛选要求,所以被移除,因此最终的进化树中没有C15结构域。

图1 烟草半胱氨酸蛋白酶家族的系统发育进化树Fig. 1 Phylogenetic tree of cysteine protease family in tobacco
在得到的目标基因中,有39个基因属于C1A结构域(Nta_CP_1-Nta_CP_39),它的亚家族成员数量最多,符合C1A是半胱氨酸蛋白酶基因家族中最大的亚类,形成了最大的分支;2个属于C2A结构域(Nta_CP_40和Nta_CP_41),是最小的进化枝;5个属于C12(Nta_CP_42-Nta_CP_46);8个属于C13(Nta_CP_48-Nta_CP_54);16个属于C14A(Nta_CP_55-Nta_CP_70)(图1)。
2.3 烟草半胱氨酸蛋白酶保守结构域分析
利用MEME搜索并分析半胱氨酸蛋白酶基因家族的20个保守基序(图2),其中Motif14(GDELBHGVLAVGYGT)出现了46次,是出现最多的结构域;Motif20出现次数最少为7次;Motif1、Motif5、Motif11、Motif12、Motif13、Motif20最长;结构域长度最小的是Motif14、Motif16、Motif17。从中可以看出,尽管Motif14出现次数最多,但结构域小;而在最大的几个结构域当中,除了Motif1外其他5个保守性相对较低,出现次数明显少于其他Motif。
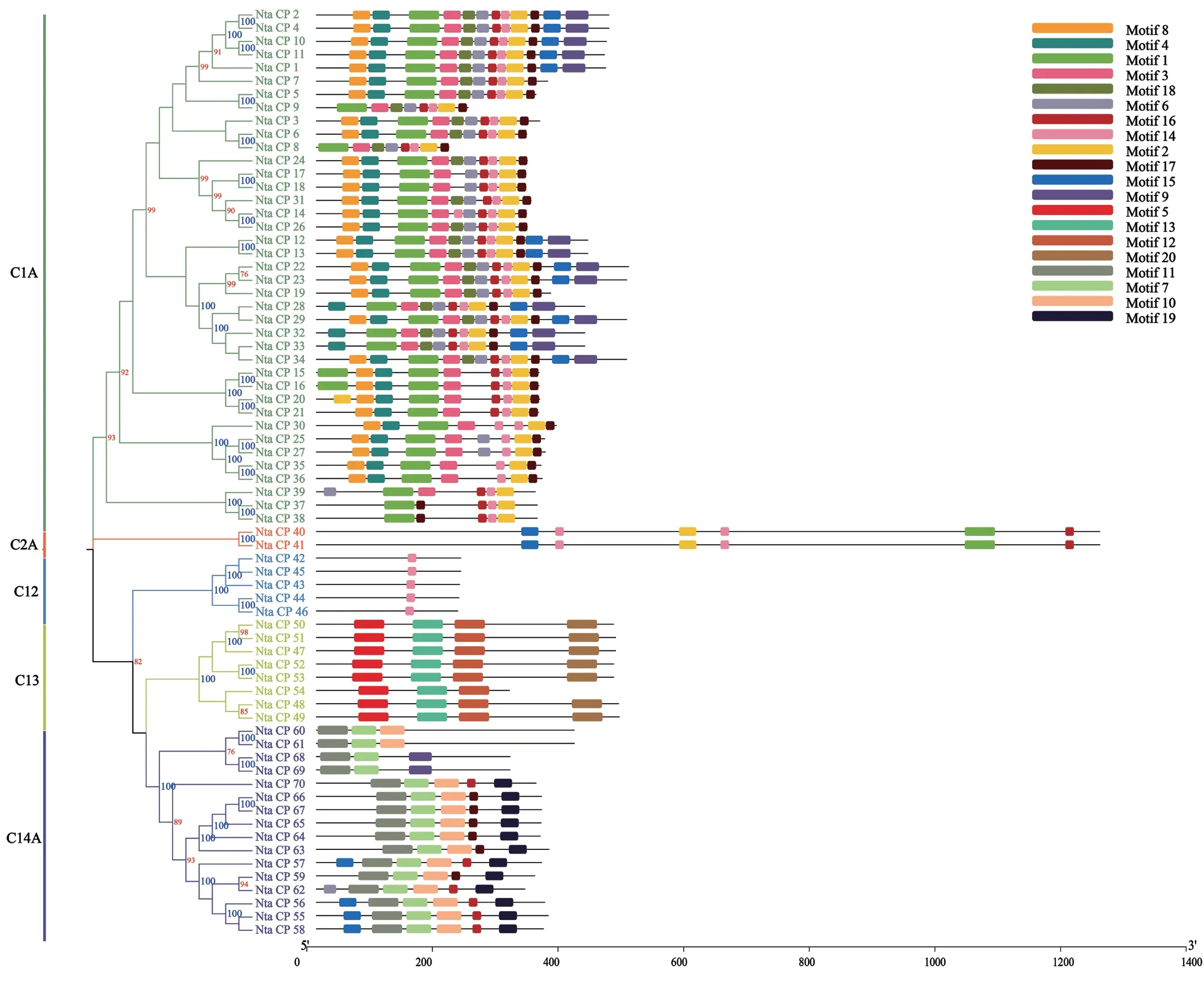
图2 烟草半胱氨酸蛋白的保守结构域模式图Fig. 2 Conserved domain pattern of cysteine protein in tobacco
将结构域可视化之后,与进化树按照基因ID一一对应后,从图2可知,Motif 8、Motif 4、Motif 3、Motif 18、Motif 9是C1A亚家族特有的结构域,而Motif 1和Motif 2是C1A亚类的39个基因成员所共有的。C2A亚家族的成员的结构域组成相同,并且均按照Motif 15、Motif 14、Motif 2、Motif 14、Motif 1、Motif 6的顺序排列。C12亚家族成员只包含了Motif14。Motif 5、Motif 13、Motif 12、Motif 20为C13所特有,并且C13亚类成员都包含有相同的结构域组成,只有Nta_CP_54缺少Motif 20。Motif 11、Motif 7、Motif 10、Motif 19只存在于C14A亚类中。
这些亚家族各自特有的保守结构域很可能与他们各自发挥的功能有很大的联系。如C12亚家族的Motif14可能与C12,即泛素C‑末端水解酶,对泛素C‑末端Gly形成键的特异性识别有关;C13亚家族的特有保守结构域可能共同发挥作用,实现降解液泡中的蛋白质;C14A的特有基序可能共同作用控制细胞凋亡级联反应。
总体来看,同一进化树分支上的基因结构域的组成与位置相同或相似,且距离越近的基因相似度越高,如Nta_CP_1、Nta_CP_2、Nta_CP_4、Nta_CP_10、Nta_CP_11,进一步验证了类群分类的可靠性,而这些保守结构域的功能还需要进一步探究和发现。
2.4 烟草半胱氨酸蛋白酶启动子顺式作用元件分析
为研究烟草中的半胱氨酸蛋白酶是否参与逆境胁迫和植物抗病调控,利用半胱氨酸蛋白酶基因转录起始位点上游2 000 bp的序列,在PlantCARE网站中查找顺式作用元件,由图3可知,K326的半胱氨酸蛋白酶家族基因含有42个不同的顺式作用元件,大多数基因都含有光应答元件。此外,半胱氨酸蛋白酶基因家族中还含有胁迫响应元件,如MeJA响应元件、赤霉素响应元件、脱落酸响应元件、水杨酸响应元件等,同时也在其中发现了参与低温、脱水、高温、盐胁迫响应、防御和应激反应的顺式作用元件、参与干旱诱导的MYB结合位点、创伤反应元件等。

图3 烟草半胱氨酸蛋白酶顺式作用元件模式图Fig. 3 Cis-acting element mode diagram of cysteine protein in tobacco
其中,Nta_CP_21含有赤霉素响应元件,Nta_CP_11、Nta_CP_7、Nta_CP_9等含有脱落酸响应元件,这些基因可能与植物的生长进程调控逆境胁有关。Nta_CP_6、Nta_CP_8等含有参与干旱诱导的MYB结合位点,推测与抗旱胁迫有关。Nta_CP_27、Nta_CP_56等含有低温调控响应元件,可能与植物在低温环境下的生理反应有关。Nta_CP_9、Nta_CP_14等含有创伤反应元件,可能会在植物体受到外部损伤后发挥作用。而Nta_CP_10和Nta_CP_11除了含有生长素、脱落酸等响应元件外,还含有最大激发子介导的激活元件(maximal elicitor‑mediated)和参与防御和应激响应的元件(图3),说明它们可能参与烟草生长发育调控及多种逆境胁迫调控途径。综上,烟草中的半胱氨酸蛋白酶可能与烟草的生长发育、逆境响应、胁迫调控等多种生理过程密切相关。
2.5 烟草靶向半胱氨酸蛋白酶家族基因的miRNAs
基于实验室前期烟草PVY感染后small RNA测序数据,筛选烟草K326半胱氨酸蛋白酶基因家族中对应的miRNAs,由图4和附表3可以看出,共预测到28个半胱氨酸蛋白酶基因受51个miRNAs调控。miRNAs与半胱氨酸蛋白酶基因的靶向互作存在着多对一和一对多的关系。其中,Nta_CP_26和Nta_CP_14对应的miRNAs数量最多,达15个,均为nta‑miR169家族的成员。Nta_CP_41和Nta_CP_40对应的miRNAs数量也为15个,分别为nta‑miR166家族的8个成员,nta‑miR395家族的3个成员,nta‑miR614家族的2个成员,nta‑miR172a和nta‑miR6019a。Nta_CP_44和Nta_CP_46对应8个miRNAs,均为nta‑miR166家族成员。受烟草半胱氨酸蛋白酶调控最多的miRNA是nta‑miR172a,共靶向8个基因,分别为Nta_CP_67、Nta_CP_66、Nta_CP_65、Nta_CP_64、Nta_CP_40、Nta_CP_41、Nta_CP_59和Nta_CP_17。Nta_CP_10和Nta_CP_11受nta‑miR396a/b/c调控。

图4 烟草半胱氨酸蛋白酶家族基因及其对应 miRNAs 调控的网络图Fig. 4 Networks of corresponding cysteine protease family genes and their relatived miRNAs in tobacco
2.6 烟草PVY感染后半胱氨酸蛋白酶基因及对应miRNAs的表达谱分析
基于实验室前期在烟草PVY感染过程的转录组测序数据和smallRNA测序数据,对烟草PVY感染后半胱氨酸蛋白酶家族基因的表达谱进行分析并利用R语言绘制表达热图和散点图。结果表明,在PVY感染后,CPs基因大多数呈上调的趋势,其中,Nta_CP_19、Nta_CP_27、Nta_CP_52、Nta_CP_28等38个CPs在PVY感染后上调表达,Nta_CP_19、Nta_CP_27、Nta_CP_28、Nta_CP_52等18个成员下调表达(图5‑A)。其中显著上调的有14个,显著下调的有7个(图5‑C)。对应的miRNAs中,nta‑miR172h、nta‑miR169t、nta‑miR156g、nta‑miR6161a等38个在PVY感染后表达上调,nta‑miR398、nta‑miR172f、nta‑miR6019a、nta‑miR396b等13个miRNAs表达下调(图5‑B),其中显著上调的有34个,显著下调的有5个(图5‑D)。

图5 烟草半胱氨酸蛋白酶家族基因及对应miRNAs在PVY感染后的表达Fig. 5 Expressions of cysteine protease family genes and miRNAs infected PVY in tobacco
2.7 烟草PVY感染后半胱氨酸蛋白酶家族基因及对应miRNAs的负调控关系分析
由上述分析可知,PVY感染后可以激活大多数烟草半胱氨酸蛋白酶及对应miRNAs的表达,有6个miRNAs及对应的7个半胱氨酸蛋白酶基因在PVY感染后表达量呈负相关,其中nta‑miR172a、nta‑miR396a、nta‑miR6161a和nta‑miR6161b在PVY感染后表达量上调,对应的靶基因Nta_CP_66、Nta_CP_59、Nta_CP_7和Nta_CP_5下调;nta‑miR390a和nta‑miR396b/c在PVY感染后表达量下调,对应的靶基因Nta_CP_38、Nta_CP_10和Nta_CP_11上调(图6)。

图6 烟草半胱氨酸蛋白酶家族基因及对应miRNAs在PVY感染后表达量负相关调控图Fig. 6 Negative correlation network of expressions of cysteine protease family genes and corresponding miRNAs after PVY infection in tobacco
2.8 烟草PVY感染后半胱氨酸蛋白酶家族基因的RT‑qPCR分析
利用实验室在烟草PVY感染过程的mRNA测序数据,挑选25个差异倍数在2以上的半胱氨酸蛋白酶基因进行RT‑qPCR分析,取PVY感染15 d后的叶片组织进行检测。结果(图7)表明,PVY感染后,表达量上调的半胱氨酸蛋白酶基因有15个,显著变化的有11个,其中Nta_CP_9、Nta_CP_14、Nta_CP_18、Nta_CP_24、Nta_CP_26、Nta_CP_31、Nta_CP_50上调明显,差异极显著。染病后Nta_CP_24、Nta_CP_26、Nta_CP_31表达量都上升了30-40倍;Nta_CP_14变化最大,接近150倍,其次是Nta_CP_18,接近60倍。PVY感染后表达量下调的半胱氨酸蛋白酶基因有10个,显著变化的有8个,其中Nta_CP_4差异极显著。

图7 PVY感染后烟草半胱氨酸蛋白酶基因RT-qPCR分析Fig. 7 RT-qPCR analysis of the cysteine protease genes in PVY-infected tobacco
3 讨论
3.1 利用新方法鉴定烟草半胱氨酸蛋白酶基因家族成员
关于半胱氨酸蛋白酶基因全家族的分析与鉴定,目前仅在水稻、小桐子等植物中正式报道,更多的集中于对C1A亚家族的鉴定[8,26-27],且大多基于MEROPS数据库中收录的条目和BLAST进行分类汇总,缺少半胱氨酸蛋白酶基因家族鉴定的完整流程。本研究对烟草半胱氨酸蛋白酶全基因家族进行分析,在MEROPS数据库的基础上,利用半胱氨酸蛋白酶亚家族各个亚家族的Pfam信息在全基因组水平进行HMM鉴定,通过Domain得分和覆盖度筛选,再经BLAST检索在烟草中共获得70个半胱氨酸蛋白酶基因家族成员,可分为C1A、C2A、C12、C13和C14A五个亚家族,包括39个C1A,16个C14A,8个C13,5个C12和2个C2A。经比较,MEROPS数据库共收录45个烟草半胱氨酸蛋白酶基因家族包括26个C1A和19个C13亚家族成员[11]。可以看出,MEROPS数据库收录的烟草半胱氨酸蛋白酶数量有限,本研究方法可以更全面地鉴定烟草基因组中的半胱氨酸蛋白酶基因家族,为烟草及植物半胱氨酸蛋白酶基因家族的鉴定和研究提供保障。
3.2 烟草半胱氨酸蛋白酶基因家族参与抗病和抗逆响应
半胱氨酸蛋白酶作为植物蛋白水解酶的主要组分,可以参与植物多种生物和非生物抗逆调控[10]。半胱氨酸蛋白酶能增强植物对病原物的免疫力,通过识别病原物的特定结构域来激发植物体产生多种免疫反应。烟草半胱氨酸蛋白酶编码基因NtC14参与调控疫霉的抗病性[13];NbCYP1和NbCYP2参与调控炭疽病(Colletotrichum destructivum)的抗病性[28]。拟南芥半胱氨酸蛋白酶编码基因AtRD19缺失引起青枯病的抗病性明显减弱[12]。玉米半胱氨酸蛋白酶编码基因ZmCP1A、ZmCP1B和ZmCP2受黑穗病菌(Ustilago maydis)效应蛋白Pit2抑制[29-30]。番茄半胱氨酸蛋白酶编码基因SlCYP1受番茄黄曲叶病毒(Tomato yellow leaf curl virus, TYLCV)的RNA沉默抑制子V2抑制[31]。此外,植物半胱氨酸蛋白酶还参与低温、高温、干旱、盐胁迫等多种非生物胁迫[32]。例如,小麦半胱氨酸蛋白酶编码基因TaCP在高温、低温、干旱和盐胁迫下表达量明显上升[33],柑橘半胱氨酸蛋白酶编码基因CsCysP在受干旱、低温和盐胁迫下诱导表达[34]。
植物半胱氨酸蛋白酶编码基因的启动子序列大多含有胁迫响应元件[35],拟南芥AtRD19的启动子含有干旱应答元件DRE和ABRE,使得该基因通过ABA信号途径参与胁迫调控[36]。本研究对70个烟草半胱氨酸蛋白酶基因家族成员构建系统发育进化树,搜索并分析了半胱氨酸蛋白酶基因家族的20个保守基序发现,同一亚类中的半胱氨酸蛋白酶基因家族成员结构域组成和排列分布高度相似,预测它们参与了相似的生物学功能。通过启动子顺式作用元件分析可以发现,在烟草半胱氨酸蛋白酶基因家族包含大量光刺激、低温、干旱、盐胁迫、外部损伤等响应元件,同时还存在许多响应水杨素、茉莉酸和脱落酸等与抗病和抗逆相关的激素元件。例如Nta_CP_10和Nta_CP_11等基因包含生长激素响应元件,同时也包含了参与防御和应激响应的元件,说明烟草半胱氨酸蛋白酶可能在烟草多种逆境胁迫调控途径中扮演了重要作用。
3.3 烟草半胱氨酸蛋白酶参与PVY调控
马铃薯Y病毒属(Potyvirus)的病毒是植物中已知的种类最多的一类RNA病毒,在世界各地的许多作物中造成毁灭性的流行病和重大的产量损失[37]。研究表明,本氏烟半胱氨酸蛋白酶编码基因NbCP8作为正调控因子抑制植物RNA病毒的侵染,沉默NbCP8可以促进TMV侵染,而过表达NbCP8可以抑制TMV侵染[38]。本研究在前期研究的基础上,对感染PVY后的K326半胱氨酸蛋白酶基因家族进行了表达谱分析发现,感染PVY后,栽培烟草中有38个半胱氨酸蛋白酶基因家族成员表达上调,18个下调,表明半胱氨酸蛋白酶基因家族的部分成员可能参与烟草对PVY的响应。但半胱氨酸蛋白酶是一个大家族,由许多成员组成,其成员如何差异化地响应植物不同阶段的生长发育及生物与非生物胁迫尚不清楚,值得深入研究。本研究根据转录组测序结果挑选烟草半胱氨酸蛋白酶基因家族中对PVY强响应的基因,利用RT‑qPCR鉴定PVY感染后的表达情况,结果发现,PVY感染后11个半胱氨酸蛋白酶基因明显上调,8个明显下调。其中Nta_CP_14、Nta_CP_18等5个基因上调倍数超过30倍,而下调的基因变化倍数均较小。这些研究证明,大部分半胱氨酸蛋白酶基因在PVY感染后被激活,从而响应PVY调控。
3.4 烟草半胱氨酸蛋白酶与miRNA互作参与PVY调控
已有研究表明,miRNAs参与大量基因的调控,但miRNAs参与半胱氨酸蛋白酶家族基因调控的研究十分有限。本研究基于烟草small RNA测序和转录组测序发现,28个半胱氨酸蛋白酶基因受51个miRNAs调控。比较PVY感染后miRNAs与其靶向的半胱氨酸蛋白酶基因的表达谱发现,对应的miRNAs中上调的有38个,下调的有13个,其中有7个成员及其对应miRNAs表现为负相关。表明这些miRNAs参与烟草半胱氨酸蛋白酶基因的调控,且其调控作用与PVY应答有关,但具体调控机理还有待深入研究。
4 结论
本研究在栽培烟草中共鉴定到70个CPs基因家族成员,并将其分为5个亚家族,同一亚家族CPs具有相似的motif分布,CPs家族基因含有多种响应元件。基于测序结果发现,28个CPs基因受51个miRNAs调控,其中 7个在PVY感染后与miRNAs负相关。RT‑qPCR结果证明PVY感染后,15个CPs基因表达量显著上调。
文章所有附表数据请到本刊官网下载(http://biotech.aiijournal.com/CN/1002‑5464/home.shtml)。

