饲料DHA与EPA质量比对斜带石斑鱼稚鱼生长性能、体组成及消化酶活力的影响
袁禹惠,龚 埜,黄 岩,李松林,2
(1.上海海洋大学农业农村部鱼类营养与环境生态研究中心,上海 201306;2.上海海洋大学水产科学国家级试验教学示范中心,上海 201306)
n-3 长链多不饱和脂肪酸(LC-PUFA)中的C22:6n-3(DHA)和C20:5n-3(EPA)是海水鱼的必需脂肪酸[1],在维持细胞膜结构和功能的完整性方面起着重要作用[2]。DHA大量存在于脊椎动物神经组织的磷脂中,对于神经系统及感觉器官的正常发育至关重要[3-4];EPA 可作为环氧合酶(COX)-2 和5-脂氧合酶(5-LOX)的底物,转化为炎症性较低的类二十烷酸[5-6]。然而,因脂肪酸酯化形成磷脂的酰化酶和转酰酶不具备底物的特异性,DHA 和EPA 在参与磷脂合成过程中存在一定的竞争性[2]。因此,饲料n-3 LC-PUFA 总量及适宜的DHA 与EPA 质量比(下称“DHA/EPA”)对于海水鱼正常生长发育均至关重要。已证实饲料DHA/EPA 在尖吻鲈(Lates calcarifer)[7]、大黄鱼(Larmichthys crocea)[8]等海水鱼中的重要性。目前,在海水仔稚鱼研究中,主要通过生物饵料营养强化的方式确定其适宜DHA/EPA[9-11],但该营养强化方式难以形成营养素浓度梯度,且生物饵料通常营养不均衡。因此,探究海水仔稚鱼适宜DHA/EPA应以微颗粒饲料为载体。
斜带石斑鱼(Epinephelus coioides)是我国东南沿海重要的养殖鱼类,有关其营养学研究主要集中在幼鱼阶段[12-14]。已有n-3 LC-PUFA 对斜带石斑鱼稚鱼生长发育影响的研究[15],但未见关于适宜DHA、EPA 比例的报道。本研究通过调整微颗粒饲料中DHA/EPA,探究DHA/EPA 变化对斜带石斑鱼稚鱼生长性能、脂肪酸组成及消化酶活力的影响,为开发高效的斜带石斑鱼微颗粒饲料提供支撑。
1 材料方法
1.1 实验饲料
以白鱼粉、虾粉、磷虾粉和水解鱼粉为主要蛋白源,以DHA 纯化油、EPA 纯化油、花生四烯酸(20:4n-6,ARA)纯化油、棕榈酸甘油酯及大豆卵磷脂为主要脂肪源,通过调整DHA、EPA 纯化油含量,配制5 种等氮(粗蛋白质量分数58%)等脂(粗脂肪质量分数16%)的微颗粒饲料,其中DHA/EPA分别为0.82、1.28、1.67、2.00 和2.33。饲料配方详见表1。
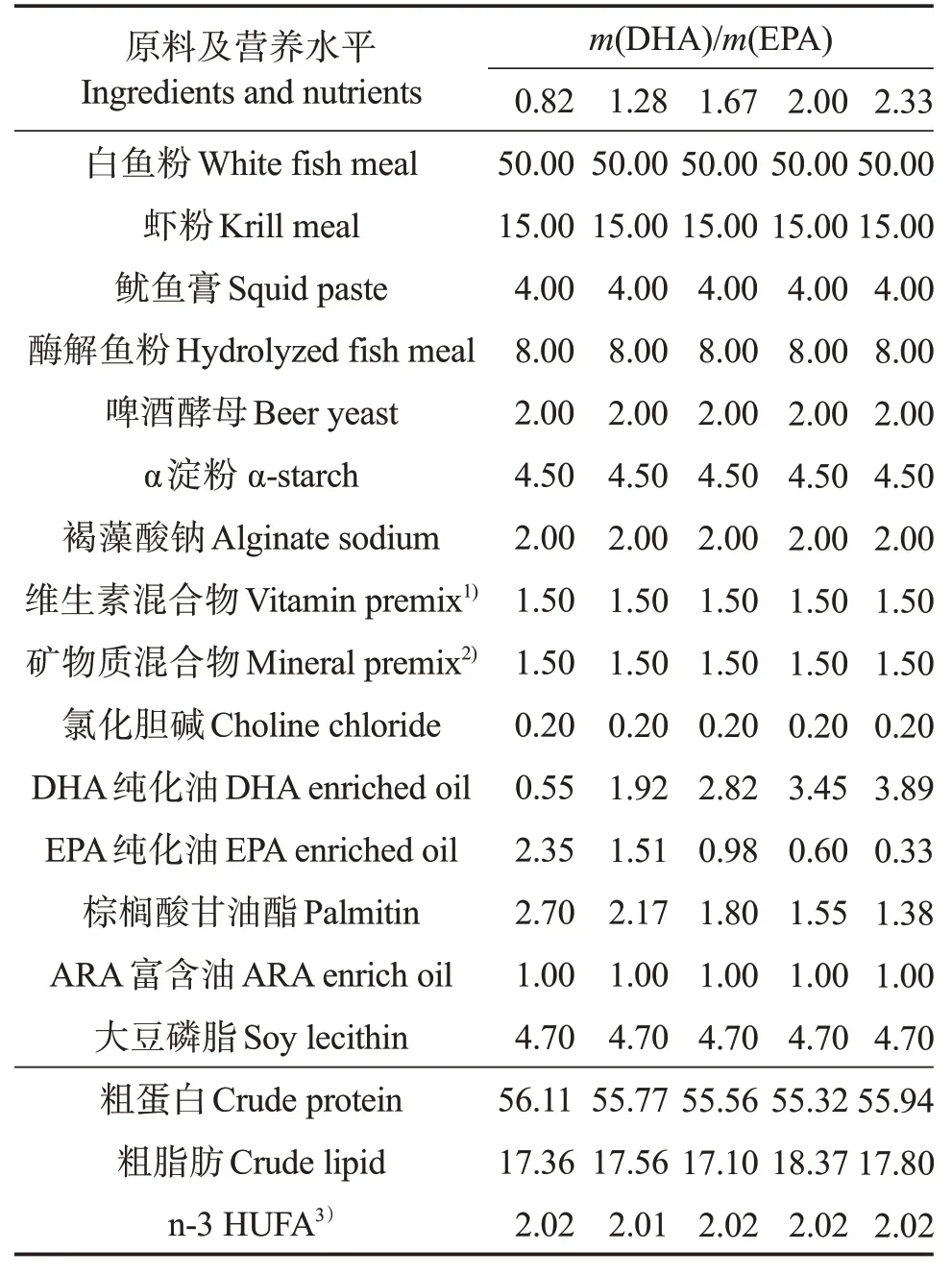
表1 实验饲料配方及营养组成(干基)Table 1 Formulation and chemical composition of experimental diets(dry matter basis) %
将所有原料粉碎,过孔径150 μm 筛网,随后按照配方比例,通过逐级放大的方式进行充分混匀,与充分混合后的脂肪源(DHA 纯化油、EPA 纯化油、ARA 纯化油、棕榈酸甘油酯及大豆卵磷脂)混匀,加水混合,利用单螺杆挤压制粒机造粒,于50 ℃鼓风干燥箱中干燥,破碎,过筛,分为2个规格:规格250~380 μm 饲料用于投喂孵化后29~45 日龄的斜带石斑鱼稚鱼,规格380~550 μm 饲料用于45 日龄后稚鱼养殖。饲料于-20 ℃保存备用,脂肪酸组成由气相色谱仪测定(表2)。
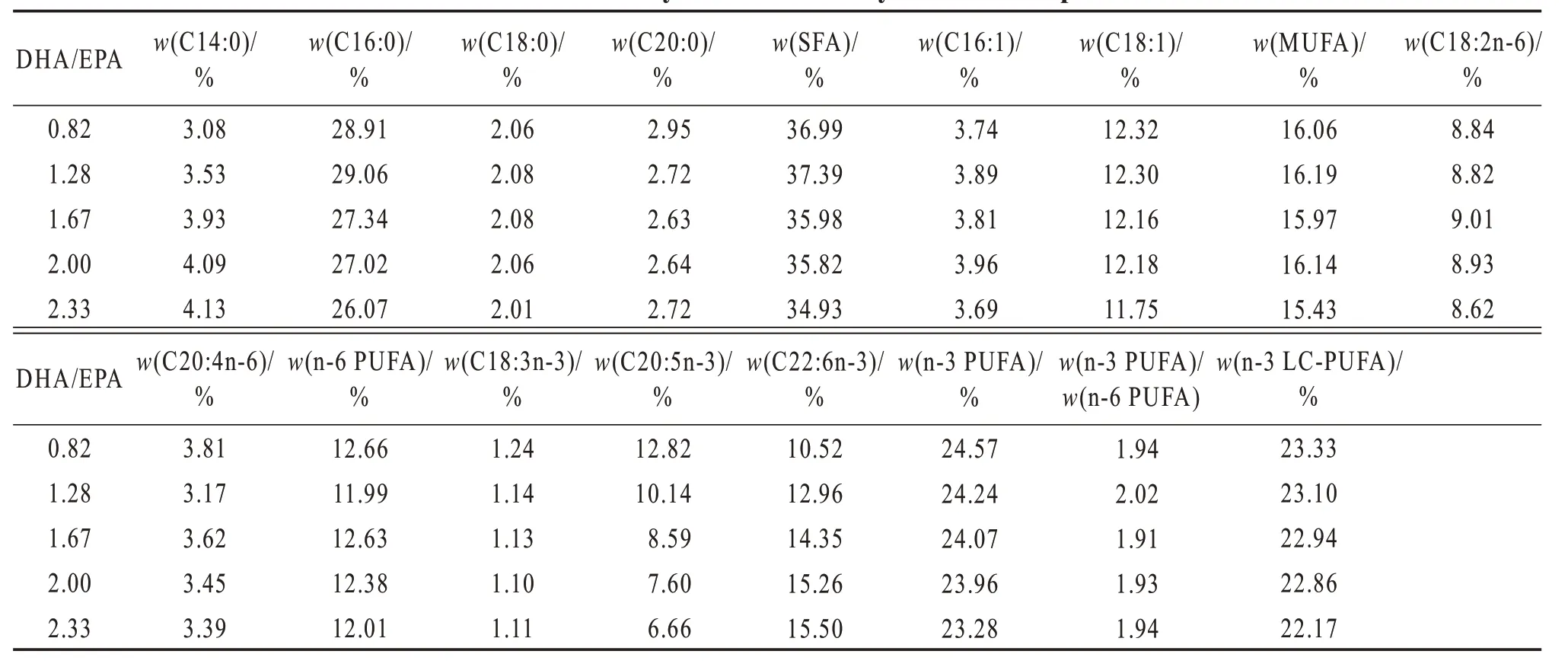
表2 实验饲料脂肪酸占总脂肪酸质量分数Table 2 Mass fraction of fatty acid to total fatty acid of the experimental diets
1.2 养殖管理
养殖实验在上海海洋大学&广东恒兴饲料实业股份有限公司联合实验室控温循环水养殖系统中开展,实验用斜带石斑鱼稚鱼(22 日龄)购自湛江市商业育苗厂。使用初孵卤虫投喂2 d 后,搭配微颗粒配合饲料进行转饵,培养至稚鱼后,投喂配合饲料比例90%以上。30日龄时,稚鱼禁食24 h,按照每桶300尾的密度平均分置到15个600 L养殖桶中。同时,随机取100尾用于计算初始体质量(70.2±0.2)mg,随机取30 尾鱼用于测量初始体长(1.21±0.03)cm,重复测定3次。设置5个实验组,每组3个重复。养殖期4周,每天07:00、10:00、13:00、16:00和18:00 5次表观饱食投喂。养殖实验期间自然光照。养殖用水经海绵和珊瑚沙过滤、紫外线灯消毒后的系统内循环水,每日换水量5%。实验过程中连续曝气,溶解氧质量浓度≥6 mg/L,pH为7.2±0.2,水温(28±1)℃,盐度为30±1,氨氮质量浓度<0.1 mg/L。
1.3 样品采集
养殖实验结束后,稚鱼禁食24 h 后,统计成活率(SR,%)、终末体质量(FBM,g),计算特定生长率(SGR,%/d):SR=终末鱼数/初始鱼数;SGR=(ln终末体质量-ln初始体质量)/饲养时间。
每桶随机取鱼30尾,测定全鱼基本营养成分及脂肪酸组成;取鱼10 尾,剖取胃及肠道测定消化酶活力,剖取肌肉用于脂肪酸分析。所有样品用液氮速冻后置于-80°C冰箱保存。
1.4 生化分析
据AOAC[16]方法测定实验饲料及全鱼的基本营养成分。待测样品水分含量通过105 ℃烘箱烘干至恒重测定,粗蛋白质含量用凯氏定氮法测定,粗脂肪含量利用索氏抽提法测定。全鱼及肌肉样品冷冻干燥后进行脂肪酸甲酯化处理,参照Metcalfe等[17]方法,利用气相色谱仪测定脂肪酸相对含量。
1.5 消化酶活力测定
用组织粉碎机将所取组织样品(胃和肠道)按质量(g)体积(mL)比1∶9 在预冷的磷酸盐缓冲液(PBS,pH=7.4)中充分研磨,以3 000 r/min 离心10 min(4 ℃),取上清液用于消化酶活力测定。以牛血红蛋白为底物,采用福林酚法测定胃蛋白酶活力[18],每mg 组织蛋白每分钟分解牛血红蛋白产生1 μg酪氨酸相当于1个活力单位U(37 ℃)。以苯甲酰精氨酰对硝基苯胺(BAPNA)为底物,参照Holm等[19]方法测定胰蛋白酶活力,每mg组织蛋白每分钟分解BAPNA 产生1 μg 硝基苯胺相当于1 个活力单位U(37 ℃)。以可溶性淀粉为底物参照Métais等[20]方法测定淀粉酶活力,每mg组织蛋白在37 ℃、30 min 能完全水解淀粉1 mg 称为一个活力单位U。采用聚已烯醇橄榄油法测定脂肪酶活力[21],每mg组织蛋白在37 ℃、每min水解脂肪产生1 μg分子脂肪酸为一个活力单位U。利用考马斯亮蓝法测定组织可溶性蛋白含量[22],用于比活力计算。
1.6 数据处理
实验结果以平均值±标准误(Mean ± SEM)表示。利用SPSS19.0 软件,将数据进行单因素方差分析,当处理之间差异显著(P<0.05)时,采用Duncan's检验进行多重比较。
2 结果
2.1 饲料DHA/EPA 对斜带石斑鱼稚鱼生长性能的影响
表3 可见:随着饲料DHA/EPA 的升高,各组间稚鱼成活率无显著变化(P>0.05),终末体质量及特定生长率先升后降(P<0.05)。其中,1.67组中石斑鱼稚鱼终末体质量及特定生长率显著高于其余各组(P<0.05))。
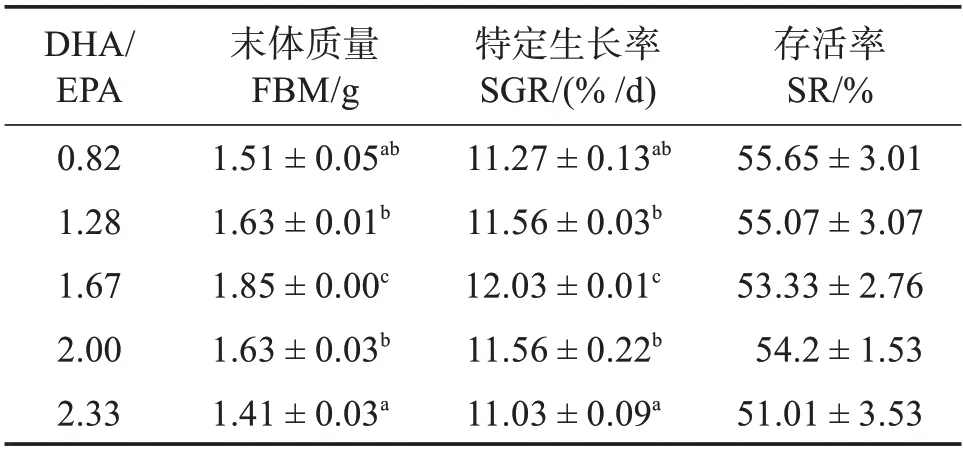
表3 饲料DHA/EPA对斜带石斑鱼稚鱼生长性能的影响Table 2 Effects of dietary DHA/EPA on growth performance of larval Epinephelus coioides
2.2 饲料DHA/EPA对斜带石斑鱼稚鱼体成分的影响
表4 可见:随着饲料中DHA/EPA 的升高,石斑鱼稚鱼全鱼粗蛋白含量先升后降,1.67 组稚鱼粗蛋白含量显著高于其他各组(P<0.05),但该组稚鱼全鱼水分含量显著低于其他各组(P<0.05);稚鱼全鱼粗脂肪的含量随着饲料中DHA/EPA 的升高而升高,2.33组显著高于其他组(P<0.05)(表4)

表4 饲料DHA/EPA对斜带石斑鱼稚鱼体成分质量分数(湿基)的影响Table 4 Mass fraction of nutrients to whole body(wet basis)of larval Epinephelus coioides fed on different DHA/EPA diets %
2.3 饲料DHA/EPA 对斜带石斑鱼稚鱼全鱼及肌肉脂肪酸组成的影响
各处理间全鱼及肌肉脂肪酸数据详见表5 及表6。全鱼及肌肉中EPA含量随着饲料DHA/EPA的升高显著降低,而DHA 含量却显著升高(P<0.05)。同时,饲料DHA/EPA 的升高显著提高了石斑鱼稚鱼肌肉以及全鱼中m(DHA)/m(EPA)(P<0.05),未显著影响全鱼及肌肉组织中n-3 LC-PUFA 的含量(P>0.05)。
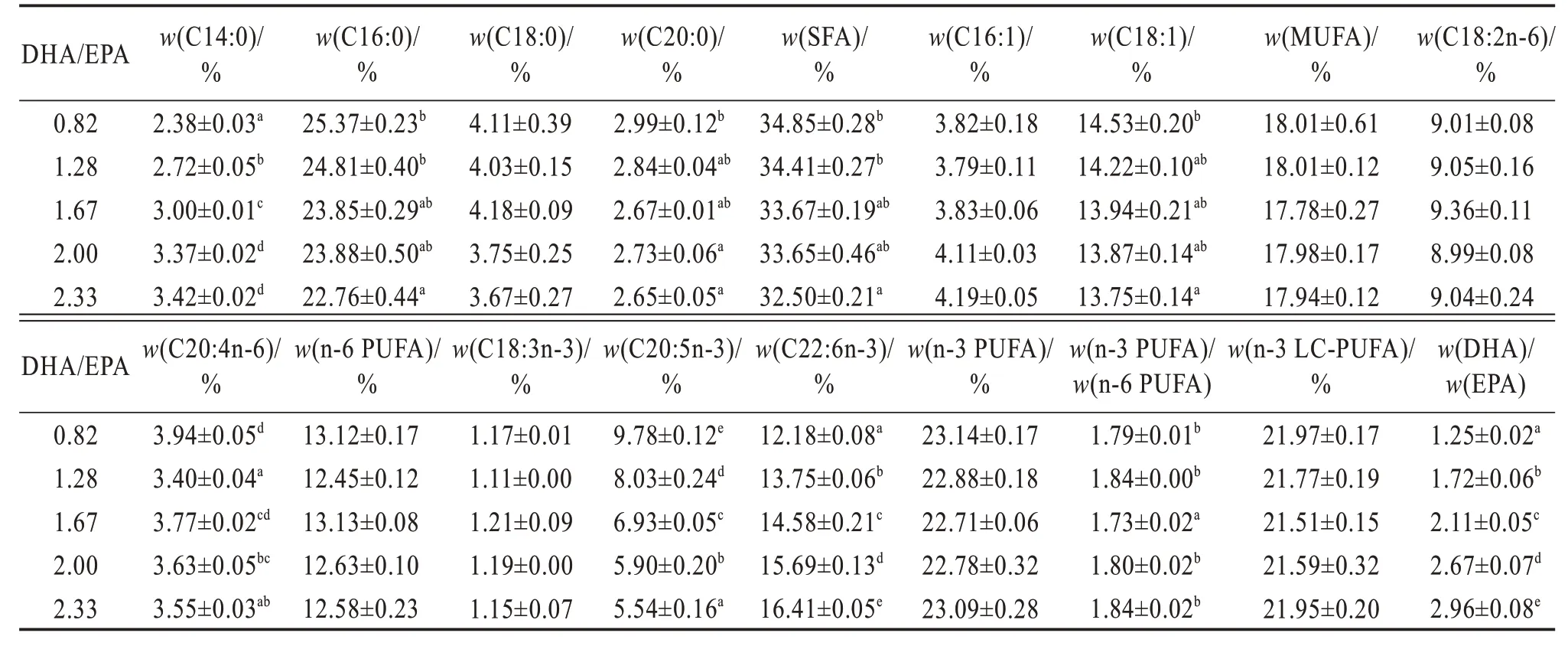
表5 不同饲料DHA/EPA斜带石斑鱼稚鱼全鱼脂肪酸占总脂肪酸质量分数Table 5 Mass fraction of fatty acid to total fatty acid in whole body of larval Epinephelus coioides fed on different DHA/EPA diets
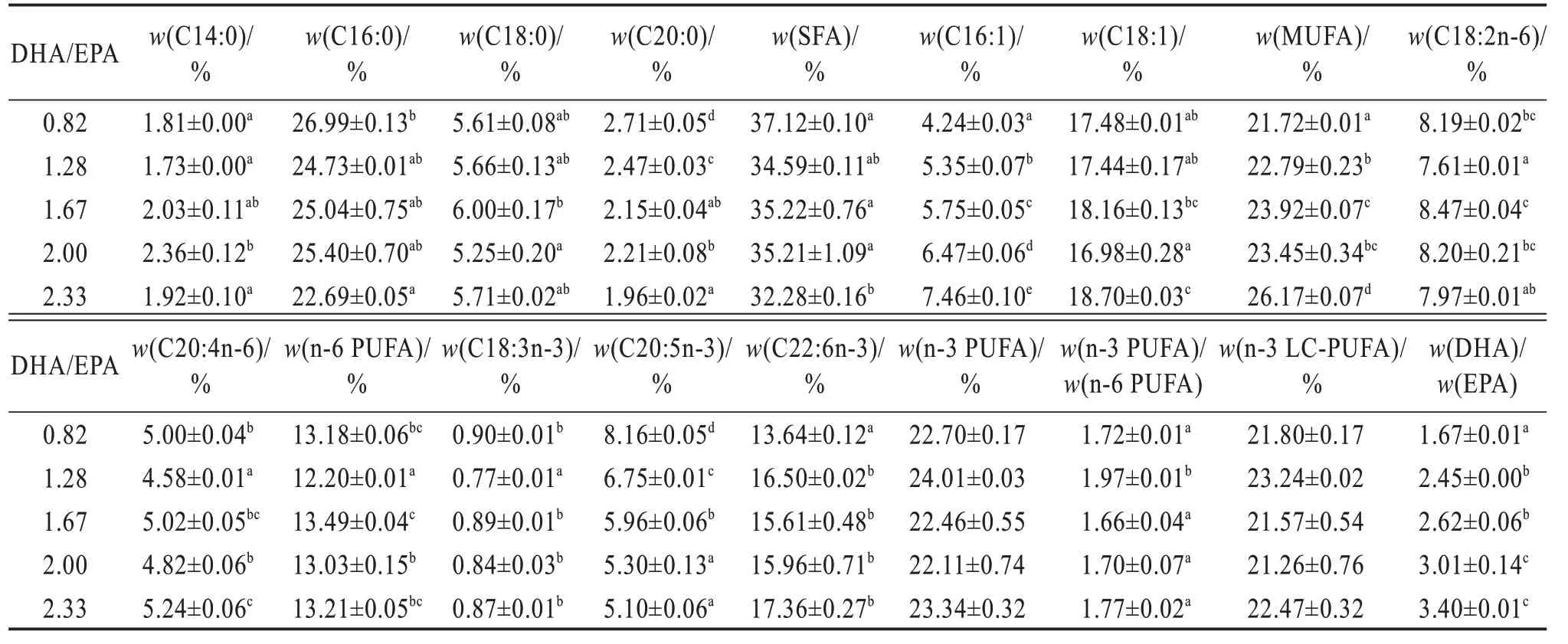
表6 不同饲料DHA/EPA斜带石斑鱼稚鱼肌肉脂肪酸占总脂肪酸质量分数Table 6 Mass fraction of fatty acids to total fatty acid in muscle of larval Epinephelus coioides fed on different DHA/EPA diets
2.4 饲料DHA/EPA 对斜带石斑鱼稚鱼消化酶活力的影响
表7 可见:随着饲料DHA/EPA 的升高,石斑鱼稚鱼胃蛋白酶、肠胰蛋白酶、肠脂肪酶活力呈先升后降的变化趋势,1.67组胃蛋白酶、肠胰蛋白酶升至最高(P<0.05),1.28、1.67、2.00 组肠道脂肪酶活力显著高于其他组(P<0.05);而随饲料DHA/EPA 的升高,石斑鱼稚鱼肠道淀粉酶活力呈降低趋势,2.33组降至最低(P<0.05)。
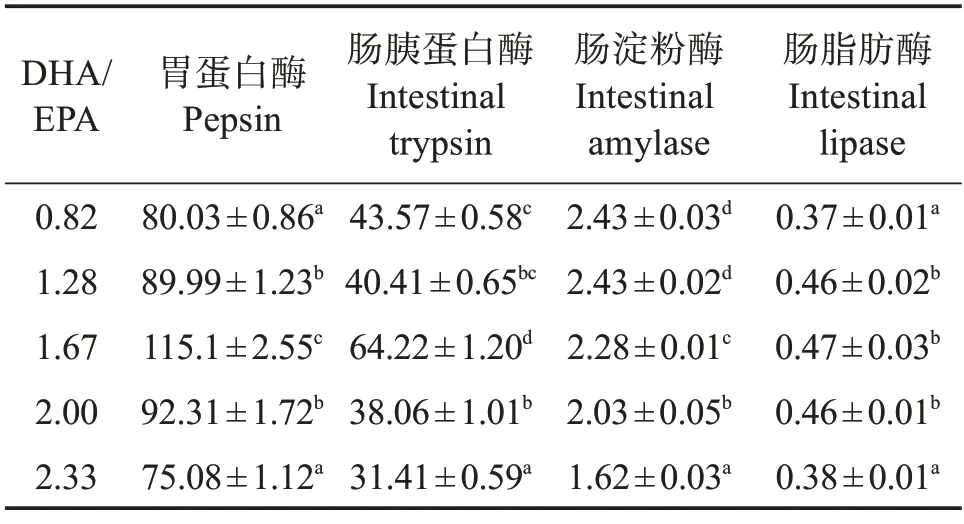
表7 不同饲料DHA/EPA斜带石斑鱼消化酶活力Table 7 Digestive enzyme activity of larval Epinephelus coioides fed on different DHA/EPA diets U/mg
3 讨论
n-3 LC-PUFA 对于海水鱼正常生长发育具有重要的作用。仔稚鱼因其生长快速,对营养物质需求更高,且对营养素感知更为敏感[23]。在真鲷(Pagrus major)[24]及金头鲷(Sparus aurata)[10]等海水仔稚鱼的研究中发现,DHA 的促生长作用优于EPA。然而,对于牙鲆(Paralichthys olivaceus)[25]和大菱鲆(Scophthalmus maximus)[26]而言,DHA/EPA变化对其生长无显著影响。饲料DHA/EPA 的升高却显著降低了金头鲷仔稚鱼的生长[27]。本研究中,尽管饲料DHA/EPA 对于斜带石斑鱼稚鱼存活率无显著影响,但1.67 组稚鱼生长性能显著高于其他各组,表明斜带石斑鱼稚鱼对饲料中DHA/EPA 有特定需求。
本研究中,各处理组石斑鱼稚鱼脂肪酸组成与饲料脂肪酸组成类似。然而,脂肪酸数据分析发现,全鱼和肌肉中DHA的相对含量明显高于饲料中DHA 含量,表明DHA 优先被保留。类似结果已在金头鲷[28]、欧洲鲈(Dicentrarchus labrax)[29-30]及虹鳟(Oncorhynchus mykiss)[31]等研究中证实。然而,全鱼和肌肉EPA 相对含量却明显低于饲料,表明EPA较DHA 更易被利用或分解[32]。EPA 相较于DHA 优先被利用很可能是本研究中饲料DHA/EPA 升高导致全鱼脂肪含量增加的重要原因之一。与DHA 变化趋势类似,肌肉中ARA(20:4n-6)的相对含量明显高于饲料。尽管LC-PUFA 在维持细胞膜的正常发育及其完整性中起重要作用[1],DHA 以及ARA 在肌肉组织中优先保留的特性意味着其作为必需脂肪酸在维持细胞正常功能中的作用。
消化系统在仔稚鱼阶段开始发育,仔稚鱼对营养物质吸收能力与消化酶活力有关[33],消化酶活力也可以作为衡量仔稚鱼消化系统发育的重要指标之一。本研究发现,饲料中DHA/EPA 的变化显著影响了消化酶活力。在仔稚鱼发育过程中,胃蛋白酶表达晚于其他消化酶[34],且胃蛋白酶的分泌在一定程度上反映出仔稚鱼向幼鱼转变的过程[35]。因此,本研究中的胃蛋白酶变化趋势意味着饲料中适宜的DHA/EPA 并可促进斜带石斑鱼稚鱼消化系统发育。一般而言,饲料蛋白质含量及氨基酸组成会影响胰蛋白酶活力[36],而本研究饲料的上述指标却不存在差异。因此,本研究胰蛋白酶活力变化是由饲料DHA/EPA 变化所致,表明适宜的DHA/EPA 看促进胰腺发育。脂肪酶可水解甘油三脂为甘油二酯、单酰甘油及游离脂肪酸,其在中性脂消化中起重要作用[37-38]。本研究中,脂肪酶活力变化同样体现了饲料DHA/EPA 变化对消化系统发育的影响。一般而言,淀粉酶活力降低是肉食性鱼类仔稚鱼阶段消化系统发育成熟的重要指标之一[39-40],本研究中,淀粉酶活力随饲料DHA/EPA的升高而降低。综上,本研究中石斑鱼稚鱼消化酶活力的变化证实,适宜饲料DHA/EPA可有效促进其消化系统的发育。
4 结论
饲料适宜的DHA/EPA 可显著提高斜带石斑鱼稚鱼的生长性能,影响机体组成及脂肪酸组成,促进消化系统的发育。斜带石斑鱼稚鱼微颗粒饲料DHA/EPA 应保持在1.67,这为其高效微颗粒饲料的开发提供理论支撑。
感谢广东恒兴饲料实业股份有限公司谢瑞涛博士在养殖实验以及取样过程中的帮助。

