植物蛋白源诱发鱼类肠炎及修复的研究进展
王晓艳,李宝山,孙永智,王成强,黄炳山
(山东省海洋资源与环境研究院/山东省海水渔用饲料工程技术研究中心/水生动物营养与饲料研发创新示范平台/山东省海洋生态修复重点实验室/烟台市海珍品质量安全控制与精深加工重点实验室,山东 烟台 264006)
随着全球水产养殖业的迅猛发展,鱼粉供不应求,植物蛋白源以产量稳定及价格低廉的优势,在水产饲料中的应用逐年增加,然而豆粕、棉籽粕、菜粕等植物蛋白源中含有多种抗营养因子,且氨基酸不平衡、适口性差,对珍珠龙胆石斑鱼(Epinephelus fuscoguttatus♀×Epinephelus lanceolatus♂)[1]、斜带石斑 鱼(Epinephelus coioides)[2]、花鲈(Lateolabrax maculatus)[3]等不同鱼类研究均表明,饲料中大量使用植物蛋白源对鱼类肠道形态及免疫功能具有负面影响,易引发食源性肠炎(Food induced enteritis,FIE)。FIE是鱼类常见病,典型症状包括黏膜皱襞缩短、杯状细胞数量增加、固有层和上皮下黏膜肿胀以及巨噬细胞、中性粒细胞、淋巴细胞、嗜酸性粒细胞等炎性细胞的强烈浸润,不同于细菌性和病毒性肠炎,FIE 不具有传染性,为非传染性亚急性肠炎[4]。FIE的发生不仅会导致鱼类肠道损伤、严重影响营养物质消化吸收,还会降低饲料利用率、增加水体氮磷排放,严重影响水产养殖业的绿色可持续发展。
鉴于此,本研究梳理国内外近年来相关研究报道,总结鱼类植食性肠炎发生的原因,并阐述益生元、益生菌及功能性氨基酸对食源性肠炎的修复作用,以期为功能性饲料添加剂在鱼类FIE 修复方面的应用提供依据,为植物蛋白源在水产配合饲料中的高效利用提供参考。
1 植物蛋白源引起食源性肠炎的机理
植物蛋白源引起食源性肠炎一般归因于其含有大量抗营养因子,如胰蛋白酶抑制因子、大豆凝集素、可溶性非淀粉多糖、植酸、皂甙、游离棉酚等[5],植物蛋白源大量使用能够增加鱼类肠道通透性、造成组织和器官的病理学损伤、降低营养素消化吸收率及免疫力[6]。Hedrera 等分别使用豆粕、大豆分离蛋白和大豆皂甙诱导斑马鱼(Brachydanio rerio)肠炎,证实是大豆皂甙导致肠道炎症而不是大豆蛋白[7]。胰蛋白酶抑制因子主要作用于肠道化学屏障:一方面能与小肠内的胰蛋白酶和胰凝乳蛋白酶结合成稳定的复合物,降低酶活性及蛋白质消化率;另一方面能引起胰蛋白酶和胰凝乳蛋白酶过度分泌,导致含硫氨基酸代偿性丧失[8]。植酸、单宁、可溶性非淀粉多糖等抗营养因子,主要通过影响化学屏障发挥抗营养作用。植酸在适宜的pH 条件下可与蛋白质形成难溶的植酸-蛋白质络合物;单宁分子中有大量酚羟基团和芳香环结构,可与蛋白质形成络合物;可溶性非淀粉多糖溶解后变成有黏性的溶液,包裹在营养素表面,形成凝胶,减少消化酶与营养素的接触[9];络合物的形成及凝胶的束缚均会降低蛋白质利用率,并影响其他营养素的消化吸收。大豆凝集素主要通过机械屏障、化学屏障和生物屏障发挥抗营养作用:1)大豆凝集素与消化道表面结合,通过胞饮作用内化,引起上皮细胞微绒毛萎缩,增加隐窝深度而影响肠道结构;2)大豆凝集素会抑制小肠刷状缘酶活性,并减弱消化酶的合成;3)大豆凝集素与肠上皮细胞的结合改变了肠道黏膜结构,从而改变了某些微生物在肠道表面的附着位点,并为细菌生长提供额外营养物质[10]。游离棉酚由于结构中含有活性醛基和活性羟基而有毒性,进入消化道后,会刺激消化道黏膜引起炎症,还能与营养素形成络合物直接排出,但其排泄比较慢,在体内有明显蓄积作用[9]。
1.1 植物蛋白源对鱼类肠道机械屏障的影响
肠道机械屏障是防御病原体入侵的重要防线,主要由上皮细胞和细胞间紧密连接组成。植物蛋白源对肠道黏膜的机械损伤在很多鱼类上均得到证实:大豆浓缩蛋白和豌豆浓缩蛋白以1∶1 质量比混合替代鱼粉25%以上,圆鳍鱼(Cyclopterus lumpus)前肠黏膜褶皱高度变短,固有层宽度增加[11];豆粕替代30%~60%鱼粉,乌鳢(Channa argus)肠壁厚度不均匀,肠道褶皱短而稀疏[12];豆粕替代量超过50%,花鲈肠道形态和黏膜屏障功能受到损伤[3]。肠道紧密连接的通透性决定整个肠道上皮细胞的屏障功能[13],闭锁蛋白(Occludin)、闭合蛋白(Claudins)等跨膜蛋白和闭合小环蛋白(ZO)等外周胞浆蛋白,由外向内形成狭窄的带状结构,封闭细胞间隙,阻止肠腔有毒物质进入周围组织,大菱鲆(Scophthalmus maximus)饲料中豆粕替代40%鱼粉,肠道紧密连接蛋白Claudin-4、Occludin 和ZO-1 的表达量显著下调[14],肠道通透性增加,而机械屏障的完整性决定了炎症发生时肠黏膜免疫反应的激烈程度。
1.2 植物蛋白源对鱼类肠道化学屏障的影响
肠道化学屏障主要由黏液、消化酶、胆汁酸、溶菌酶等组成,能够防止有害物质吸收。黏液层由肠黏膜上皮夹杂的杯状细胞分泌,在肠黏膜表面形成一层膜状保护结构,但多种肠道感染的疾病中均伴随着杯状细胞数目的异常增多,在圆鳍鱼[11]和草鱼(Ctenopharyngodon idellus)[15]上均观察到植物蛋白替代鱼粉引起的后肠杯状细胞数量异常增加。据报道,饲料中高水平豆粕能够降低胆汁酸合成及其相关基因(cyp7a1-2,cyp8b1-1和cyp8b1-2等)的表达量,并降低肠道溶菌酶活性[16]。植物蛋白原料中普遍存在的可溶性非淀粉多糖能与胆汁酸结合,减少胆汁酸与脂肪微粒的结合,此外,可溶性非淀粉多糖形成的黏性环境还能阻碍脂肪吸收微粒的形成,影响脂肪消化吸收[17];胰蛋白酶抑制因子可与胰蛋白酶和胰凝乳蛋白酶迅速结合形成不可逆的复合物从而使这两种酶失活[1],对圆鳍鱼的研究表明,饲料中大豆浓缩蛋白和豌豆浓缩蛋白以1∶1质量比混合物替代50%鱼粉,中肠胰凝乳蛋白酶活性降低[11]。
1.3 植物蛋白源对鱼类肠道生物屏障的影响
肠黏膜生物屏障主要由正常肠道菌群构成,肠道微生物能够促进肠道上皮细胞增殖并强化鱼体免疫机能[1]。当肠道黏膜受到外界刺激时,肠道菌群会第一时间作出响应,刺激免疫信号通路,调节相关受体蛋白以及非特异性因子的表达,清除病原体[18]。在大黄鱼(Larimichthys crocea)[19]、珍珠龙胆石斑鱼[1]等鱼类上均报道了植物蛋白源替代鱼粉引起了肠道菌群多样性下降,肠炎致病菌如支原体科(Mycoplasmataceae)丰度上升,而肠道有益菌如从毛单胞菌科(Comamonadaceae)、乳杆菌科(Lactobacillaceae)等丰度下降,替代比例过高时,肠道菌群严重失调。
1.4 植物蛋白源对鱼类肠道免疫屏障的影响
在组织病理学损伤的同时,通常会伴随核转录因子-кB(NF-кB)和下游炎症因子的激活[5]。炎症反应初期,肠黏膜上皮细胞层的中性粒细胞出现大量浸润和脱颗粒反应,巨噬细胞大量增加且浸润,并从M0 或M2 型(圆形)转化为M1(突触状)型,即由稳态转化为促炎态,同时激活肥大细胞,自然杀伤细胞数目急剧增加[18]。对珍珠龙胆石斑鱼的研究证实了饲料高水平豆粕可通过激活NF-κB、吞噬体、自然杀伤细胞介导的细胞毒性等信号通路介导肠炎的发生[6]。肠道黏膜免疫系统局部诱导细胞产生白介素-1(IL-1)、IL-6、IL-8、肿瘤坏死因子-a(TNF-a)等促炎因子,效应细胞产生IL-4、IL-10、IL-13、转化生长因子-β(TGF-β)等抗炎因子,一旦这两部分细胞因子的功能和数量异常,肠道内稳态被打破,鱼体极易受到病原体攻击,病原可以在各组织中诱导更强烈的炎症反应[20],珍珠龙胆石斑鱼豆粕型肠炎发生过程中,IL-6、TNF-α 等炎症标志物表达均上调、抗炎细胞因子TGF-β和IL-10等表达显著下调[6]。
2 功能性饲料添加剂对食源性肠炎的修复
2.1 益生元
益生元一般是指能选择性促进肠道有益菌群增殖,对宿主健康及生长起到直接或间接促进作用的非消化性食物成分[21],在维护鱼类生长代谢、免疫、肠道健康等方面有较好效果。植物蛋白源已被证明会影响肠道菌群[3],益生元可作为肠道中有益菌的营养底物,选择性促进乳酸菌(Lactobacillus)、双歧杆菌(Bifidobacterium)和嗜酸乳杆菌(Lactobacillus acidophilus)等有益菌增殖,使益生菌在数量和作用强度上占优势[22];另外,益生元可通过调节肠道菌群结构影响肠上皮细胞基因表达,修复受损的肠道黏膜[23]。常用的益生元主要是寡糖、多糖和酸化剂。
2.1.1 寡糖 目前水产养殖中应用最广泛的是非消化性功能性低聚糖,又称寡糖,主要包括甘露寡糖(MOS)[24-26]、壳寡糖[27]、果寡糖[28]、低聚果糖、低聚木糖、低聚半乳糖、低聚乳果糖、低聚异麦芽糖等(表1),含有不能被肠道消化酶打断的化学键,在肠道内几乎不能被消化吸收而直接进入肠道后段。MOS 是益生元中最具前景的一类,在鲈(Dicentrarchus labraxL.)[16-17,26]、金头鲷(Sparus aurata)[25]上均验证了MOS能提高肠黏膜褶皱高度和宽度、增加吸收表面积;MOS 对虹鳟(Oncorhynchus mykiss)前肠绒毛形态没有产生显著影响,但在超微水平上观察到了微绒毛长度和密度的增加[24]。寡糖对肠道黏膜的有益作用可能主要是通过调节肠道菌群实现[22],0.4%果寡糖增加了罗非鱼肠道双歧杆菌和乳酸杆菌(Lactobacillaceae)的数量,降低大肠埃希菌(Escherichia coli)和沙门氏菌(Salmonella enteritidis)数量[28];3%木寡糖提高了库图拟鲤(Rutilus frisiikutum)幼鱼肠道内异养需氧菌总活菌数[29];2%半乳寡糖显著提高了里海拟鲤(Rutilus rutilus)肠道原籍乳酸菌水平,肠道菌群朝有益方向发展[30]。
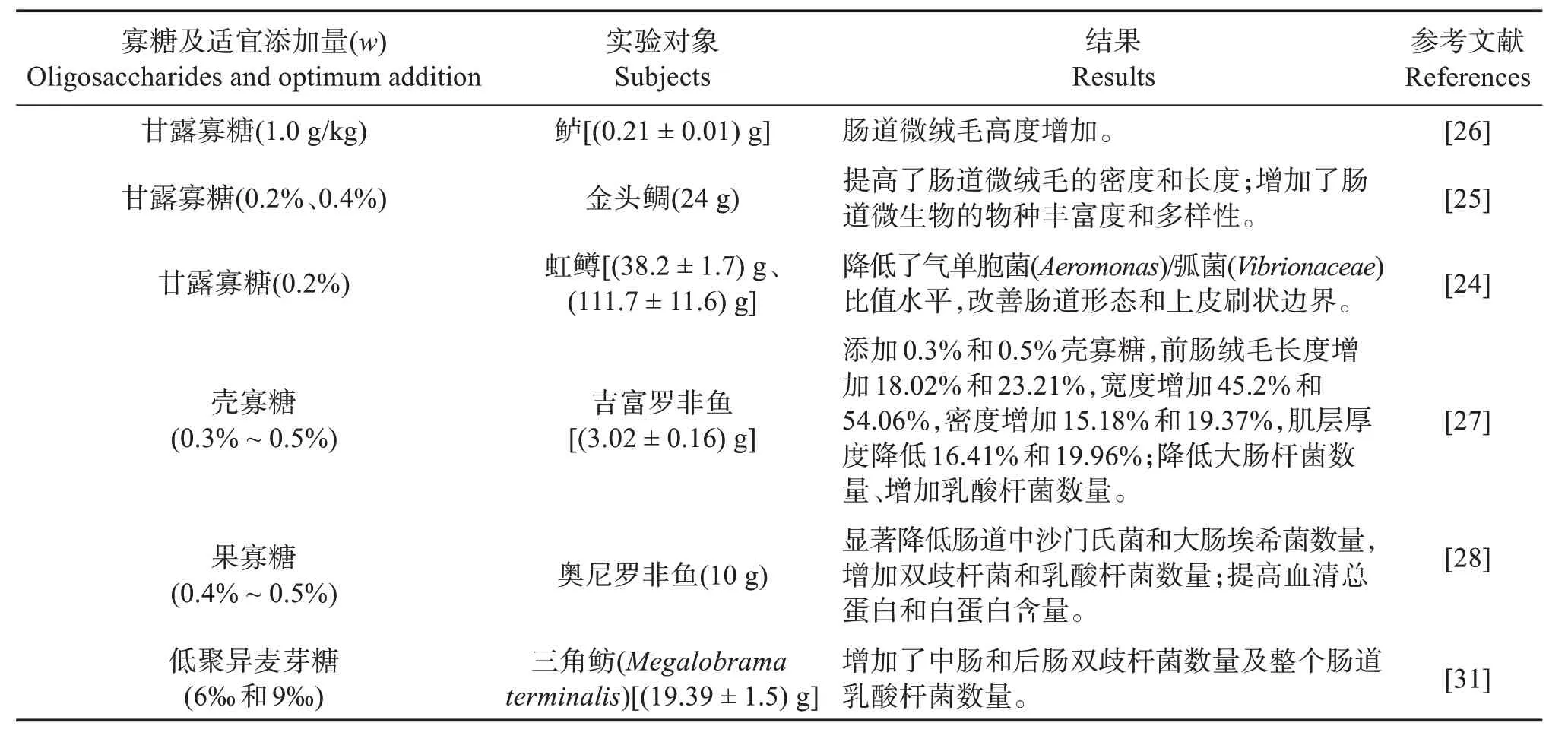
表1 寡糖对鱼类肠道功能的影响Table 1 Effects of oligosaccharides on intestinal function of fish
2.1.2 多糖 多糖被认为是肠道功能调节剂,水产饲料中常用的主要有β-葡聚糖[32,33]、菊粉[34]、壳聚糖[35]和中草药类多糖(如黄芪多糖[36]、茯苓多糖[37]、枸杞多糖[37])等(表2)。多糖对肠道调节主要体现在以下几个方面:1)多糖能影响细菌对细胞的黏附,抑制肠道有害菌生长并促进有益菌生长,改善动物肠道微生态环境[34];2)多糖能不同程度阻断和抑制病毒对细胞的作用,降低病毒引起的细胞凋亡,并抑制病毒复制、阻滞病毒吸附[38],如黄芪多糖可以修复病毒感染导致的黏膜损伤,维持辅助型T 细胞1/辅助型T细胞2(Thl/Th2)细胞动态平衡,上调小肠黏膜组织T-box 基因家族新型转录因子(T-bet)和GATA 基因家族转录因子(GATA-3)蛋白表达并促进分泌型免疫球蛋白A(sIgA)的分泌[39];3)多糖具有清除自由基、减缓脂质过氧化的作用,对珍珠龙胆石斑鱼的研究证实了这一观点[32];4)多糖能够调节炎症反应,对大菱鲆的研究发现,酵母β-葡聚糖和羧甲基葡聚糖能通过降低炎症因子表达量,调节炎症反应[33]。但是,也有研究发现,某些多糖过量使用可能会造成鱼类肠道损伤,大口黑鲈(Micropterus salmoides)低鱼粉(26%)饲料中添加高剂量(12%)菊粉,肠道好氧菌和革兰阴性菌相对丰度显著下降,引发肝、肠组织损伤,而在高鱼粉(52%)组该损伤并不明显[40]。因此,益生元使用时应根据鱼种、规格及植物蛋白添加量确定适宜添加量,以免过量添加对鱼体产生不利影响。
2.1.3 酸化剂 肠道碱度升高会破坏肠黏膜屏障的完整性,有机酸及其盐类能通过H+沉积降低消化道pH[43]。目前鱼类饲料中常用有机酸主要有乙酸、丙酸、丁酸、乳酸和柠檬酸等短链有机酸[43](表3),其中,乳酸有利于增加肠道吸收面积并促进肠道免疫防御系统;乙酸、丙酸和丁酸等短链脂肪酸(SCFAs)在维护肠道屏障、氧化应激、炎症及免疫系统稳态等方面发挥重要作用,SCFAs 作为G 蛋白偶联受体(GPCRs)的配体,可通过调节炎症小体和单磷酸腺苷活化蛋白激酶(AMPK)信号通路增强肠上皮细胞间的紧密连接[44];这些有机酸尤其是丁酸可作为肠细胞的主要能源基质,并有利于免疫细胞的育成和肠上皮细胞的增殖[45];另外,α-酮戊二酸也是肠道的主要能源物质,80%的α-酮戊二酸氧化反应在肠道中进行,氧化产生的大量三磷酸腺苷(ATP)为肠细胞供能[46],松浦镜鲤(Cyprinus carpio)饲料中添加α-酮戊二酸显著提高了肠道消化能力及肠道组织结构[47]。
2.2 益生菌
益生菌通常是指能够促进其他生物健康的细菌或微生物。鱼类饲料常用的益生菌主要有乳酸菌、芽孢杆菌(Bacillus)、乳杆菌(Lactobacillus)、酵母菌(Saccharomycessp.)、乳球菌(Lactococcus)、丁 酸梭菌(Clostridium butyricum)等(表4)。益生菌作用于肠道的主要机制被认为有以下几点:1)益生菌与肠道黏膜上皮细胞相应的糖受体结合,占据黏附位点并形成保护性生物膜,竞争性抑制大肠埃希菌、沙门氏菌等有害菌的黏附与定植[52],阻断病原菌的附着-繁殖-致病途径[53];2)益生菌在肠道内的代谢产物,如乳酸、短链脂肪酸等,会降低肠道pH从而抑制病原菌生长、促进营养物质消化吸收[23];3)肠道内益生菌通过调节炎症过程来维持肠黏膜的完整性[54]。在眼斑双锯鱼(Amphiprion ocellaris)[55]、尼罗罗非鱼(Oreochromis niloticus)[56]、大口黑鲈[57]等鱼上均证实了益生菌对鱼类肠道菌群稳态、黏膜屏障及炎症反应的有利作用。然而尼罗罗非鱼停用植物乳杆菌(Lactobacillus plantarum)后,出现了肠道菌群失调、肠上皮细胞受损的现象,可能是因为该菌在其肠道的黏附性差,停用后短时间内被排出体外,为致病菌提供了黏附位点[58]。因此水产饲料中使用益生菌需充分考虑益生菌在肠道内能否定植及定植时间。

表4 益生菌对鱼类肠道功能的影响Table 4 Effects of probiotics on intestinal function of fish
含有益生菌和益生元混合物的产品被称为合生元。研究发现,与单独摄入益生菌或益生元相比,合生元可能会以更有效方式作用于机体[23]。0.01%枯草芽孢杆菌(Bacillus subtilis)和0.01%低聚木糖配伍,团头鲂(Megalobrama amblycephala)生长性能、消化酶活性、抗氧化性能均优于单独添加[61];100 μg/g 地衣芽孢杆菌(Bacillus licheniformis)与100 μg/g 低聚木糖配伍,异育银鲫(Carassius auratus gibelio)肠道微生物益生菌数量明显多于单独添加[62];但也有研究发现,芽孢杆菌联合菊粉在调节金头鲷促炎因子表达上的效果并不优于芽孢杆菌单一使用组[63]。这提示在益生菌和益生元配伍时,应注意益生元的选择。
后生元是指对宿主健康有益的无生命微生物和/或其成分的制剂,主要包括菌体代谢产物和菌体组成成分,菌体代谢产物包括肽、细菌素、胞外多糖、短链脂肪酸、无细胞上清液、维生素、有机酸、部分生物表面活性剂等,菌体成分包括肽聚糖、脂磷壁酸、磷壁酸、细胞壁多糖、细胞表面相关蛋白等[64]。对小鼠的很多研究均证明,后生元在调节肠道炎症反应及菌群结构等方面具有积极作用:植物乳杆菌MTCC5690、发酵乳杆菌LMTCC5689 和嗜酸乳杆菌(Lactobacillus acidophilus)NCFM 等乳酸杆菌菌株的S 层蛋白可有效改善小鼠结肠炎症状[65];热灭活的戊糖乳杆菌(Lactobacillus pentosus)S-PT84 能够维持小鼠肠道屏障的完整性[66]。近年来,后生元在水产上也逐渐引起人们的重视,对斑马鱼模型的研究发现,0.025%酵母葡聚糖和1%鼠李糖乳杆菌(Lactobacillus rhamnosus)GG 胞外多糖能有效改善斑马鱼肠道菌群结构[67];长双歧杆菌(Bifidobacterium longumReuter)胞外多糖能显著提高镉胁迫下金鱼(Carassius auratus)的蛋白酶活性;有益菌在肠道内发酵生成的乳酸、SCFAs、CO2和氢等有机酸或代谢产物能降低肠道pH,抑制对pH 敏感的大肠埃希菌和沙门氏菌等病原菌繁殖[23],在尼罗罗非鱼[21]、西伯利亚鲟(Acipenser baeriBrandt)和非洲鲇(Clarias gariepinus)[68]等鱼上的研究均报道了饲料中补充益生元后鱼肠道中乙酸盐、丙酸盐、丁酸盐等SCFAs含量的升高及肠道功能的改善。植物乳杆菌CICC6257 的脂磷壁酸能有效抑制鳗弧菌(Vibrio anguillarum)对银鲳(Pampus argenteus)肠道上皮细胞的FIECs 的黏附,通过抑制NF-κB 的活化和NFκB 抑制蛋白的降解,降低IL-8和TNF-α的表达,从而减轻肠道炎症反应[69]。后生元对鱼类肠道的益生功能已经在多种鱼类上得到证实,但其所涉及的作用机制及信号通路有待深入研究。
2.3 功能性氨基酸
功能性氨基酸是指除了合成机体蛋白质外还具有其他特殊功能的氨基酸,饲料中添加晶体氨基酸能改善植物蛋白替代鱼粉后鱼类的生长和健康状况[70],如精氨酸[71]、谷氨酰胺[71-74]、苏氨酸[75-76]、色氨酸[77-78]、赖氨酸[79]等氨基酸都能促进肠道发育,有利于肠黏膜损伤后的修复(表5)。NF-кB 的触发会刺激炎症因子的表达,而精氨酸能通过激活AMP活化蛋白激酶a1(AMPKa1)信号分子,抑制NF-кB p65信号分子,从而保护肠黏膜屏障功能[74],对大菱鲆[71,74]、建鲤(Cyprinus carpiovar.Jian)[73,80]、珍珠龙胆石斑鱼[72]等鱼的研究发现,精氨酸可通过增强肠道黏膜屏障功能减轻食源性肠病,而精氨酸缺乏导致建鲤肠道紧密连接蛋白表达异常[80];对草鱼的研究发现,苏氨酸可能通过Keap1a/Nrf2 信号,调控肠道抗氧化酶及其亚型基因表达,增加相应酶的活性和非酶类抗氧化物质还原型谷胱甘肽(GSH)的含量,从而维持草鱼肠道细胞结构的完整性[75];赖氨酸能通过肌球蛋白轻链激酶(MLCK)和蛋白激酶C(PKC)信号分子调节鱼类肠道紧密连接蛋白基因表达,通过螯合Cu2+阻截由铜应激引起的酶性抗氧化系统损伤[79],赖氨酸缺乏会降低幼建鲤对病原菌的识别、黏附和溶菌能力而导致肠道菌群失衡[81];牛磺酸是含硫非蛋白氨基酸,其调节肠道的可能机理被认为与赖氨酸类似,通过MLCK 调节肠细胞间紧密连接蛋白基因表达[82]。
3 小结和展望
益生元、益生菌、功能性氨基酸等添加剂本身具有绿色、无毒、无污染、不产生抗性等特点,在饲料禁止使用抗生素及鱼粉供不应求背景下,配合饲料中大量添加植物蛋白的同时,应适时添加功能性添加剂,以改善鱼类肠道环境,增强机体免疫,减少食源性肠炎的发生。
使用过程中应注意以下问题:
1)使用益生元应该根据不同养殖品种、规格确定适宜添加量,以免过量使用带来副作用;
2)针对特定物种,筛选在肠道中定植时间久的菌种,并在生产中根据其定植周期定期投入,防止停止添加后肠道菌量快速减少甚至失效,以便维持其益生优势;
3)两种或多种类型添加剂联合使用时,应根据各添加剂的稳定性、安全性及协同/拮抗作用来确定种类和比例。
目前,益生元、益生菌、功能性氨基酸等添加剂对鱼类食源性肠炎修复作用的评价多聚焦于对实验动物生长性能、肠道消化酶活性、肠道菌群、炎症因子和抗炎因子基因表达等层面的影响,对益生菌的定植缺乏理论认知,对添加剂的作用机理研究不够深入,今后应该针对不同益生菌的定植机制及有效添加剂的作用机理作深入解析,为开发更有效的水产饲料添加剂提供理论基础,以促进水产养殖业的健康可持续发展。

