复配添加剂对模拟运输斑点叉尾鮰幼鱼生化指标和组织结构的影响
李豪华,廖 涛,白 婵,邱 亮,鉏晓艳,李海蓝,陈丽萍,熊光权,王炬光
(1.农业农村部农产品冷链物流技术重点实验室/湖北省农业科学院农产品加工与核农技术研究所,湖北 武汉 430064;2.兰州理工大学,生命科学与工程学院,甘肃 兰州 730050;3.湖北省农业科技创新中心农产品加工研究分中心,湖北 武汉 430064;4.武汉市东西湖区农业技术推广中心,湖北 武汉 430044)
斑点叉尾鮰(Ictalurus punctatus)隶属鲇形目鮰科,是世界知名的淡水养殖鱼类,也是我国主要的淡水经济鱼品种之一[1]。斑点叉尾鮰幼鱼在运输过程中应激反应明显,常导致其免疫力下降、造成皮肤黏液流失等损伤;且长途运输过程中需要经常换水来避免水质恶化,这会造成水资源和时间成本浪费[2]。
牛磺酸不仅促进鱼类生长,还参与渗透调节、膜稳定性和抗氧化防御系统等[3]。维生素C(VC)能够影响不饱和脂肪酸的过氧化,促进胆固醇代谢,并降低皮质醇的含量[4]。维生素E(VE)有着较高的生物活性,具有调节鱼类新陈代谢的能力[5]。谷氨酰胺被可为生物体(包括鱼类)提供碳源和氮源[6,7]。谷氨酸钠溶于水后解离成的钠离子和谷氨酸,不仅可以为鱼类调节渗透压,而且谷氨酸能与血浆中的氨结合生成谷酰胺,缓解氨中毒[8]。上述五种水溶性化合物常被添加到养殖饲料中来改善鱼类的健康[9-13],但目前将其作为运输水中添加剂用于提高鱼类运输抗应激能力的研究报道较少。本研究通过向运输水体添加不同体积分数的复配水溶性添加剂,通过测定模拟运输水质,幼鱼应激、抗氧化能力和组织形态(皮肤、鳃)等指标,探讨复配水溶性添加剂对斑点叉尾鮰幼鱼运输应激的影响,验证添加剂使用是否能够减少换水时间、提高鱼类抗运输应激能力,以期在实际运输中缩短时间成本,为提高斑点叉尾鮰幼鱼运输质量提供参考依据。
1 材料与方法
1.1 材料
斑点叉尾鮰幼鱼体质量(16.22 ± 0.82)g,体长(13.40±0.35)cm,购于嘉鱼县三湖渔业有限责任公司。实验开始前,幼鱼被放置在直径1.5 m、高1.3 m的圆柱形塑料循环缸组成的循环水养殖系统中进行为期2 周的适应,养殖水为经过2 d 曝气的自来水,养殖密度为8.33 g/L,温度为(23.0±0.5)℃,氨氮质量浓度<0.02 mg/L,溶解氧质量浓度>6 mg/L,pH为7.12 ± 0.21,保持12 h/12 h 的明暗周期并每天监测幼鱼健康状况,以2%幼鱼体质量的用量饲喂斑点叉尾鮰专用商品饲料(购自通威股份有限公司),每日2 次(9:00 和16:00)。正式实验开始前禁饲24 h,以清空幼鱼消化道。
1.2 复配添加剂配制
根据文献[14-18]及预实验结果,确定复配水溶性添加剂溶液由70 mg/L 牛磺酸、40 mg/L VC、18 mg/L VE纳米乳液、20 mg/L 谷氨酰胺和0.6 mg/L 谷氨酸钠混合制成。其中,由于VE是脂溶性维生素,需先参考马愈迪等[19]方法制备纳米乳液,具体配制方法为VE(1.17 g)、吐温80(0.7 g)、无水乙醇(3.3 g)、水(7.8 g),以800 r/min 的转速搅拌30 min,即得到复合维生素E纳米乳液。
1.3 实验设计
设置6 个实验组,按照复配水溶性添加剂的不同体积分数(20%、40%、60%、80%、100%)分别为复配添加剂组,即F-20%组、F-40%组、F-60%组、F-80%组、F-100%组。以不进行任何添加剂处理的为对照组(Control)。将复配添加剂组和对照组进行模拟运输。参考企业运输鱼水质量比m鱼∶m水=1∶4密度进行模拟近、中、远3 个业内典型时长(5、9、14 h)运输;每个实验组设置3 个平行,共12 组。实验采用塑料盒(21 cm×13.9 cm×8.5 cm)开放式充氧的运输方式,每个盒子中注入曝气水1 L,使用空气泵持续供氧以模拟装箱开放式运输,模拟运输温度为20 ℃。暂养结束后,取规格相同的3 尾鱼根据比m鱼∶m水=1∶4的密度放置在含有不同浓度的复配添加剂运输水体中作为静息组(BT)。实验结束后,将各运输组幼鱼分别置于不同水族箱中,监测其72 h死亡率。
1.4 样品采集与测定
1.4.1 水质指标 在模拟运输前静息状态时(BT)和不同模拟运输时间段(0、5、9、14 h)分别取200 mL水样,使用HQ40哈希HACH 多参数数字化分析仪(上海哈希水质分析仪器有限公司)测定溶解氧(DO)和温度(℃),PHS-25 pH计(巩义市子华仪器有限责任公司)测定pH,按照HJ 535—2009《水质氨氮的测定纳氏试剂分光光度法》进行总氨氮浓度的测定。
1.4.2 生化指标 在每个采样时间点用渔网捕捞3 尾斑点叉尾鮰幼鱼,用1 mL 一次性无菌注射器采用尾部静脉取血的方式收集血液。然后将血液在冷冻离心机中以3 000 r/min 在4 ℃条件下离心10 min,将上清液(血清)移入1.5 mL 离心管中并保存于-80 ℃冰箱直至分析。血清中皮质醇和葡萄糖含量测定试剂盒均购自南京建成生物工程研究所。
每个处理组取3 尾鱼,收集(1.1±0.5)g 肝脏组织放入15 mL 离心管中,按照m组织∶m生理盐水=1∶9 的比例(质量分数0.9%的生理盐水)在冰上使用匀浆机进行匀质,后在4 ℃、10 000 r/min 条件下离心10 min,收集上清液,保存于-80 ℃待分析。肝脏中过氧化氢酶(CAT)活性、丙二醛(MDA)浓度、总抗氧化能力(T-AOC)均采用南京建成生物工程研究所试剂盒进行测定。
1.4.3 组织切片 取新鲜的鳃、皮肤,大小在1 cm2以内,固定在质量分数4%的多聚甲醛中备用。用体积分数70%~100%的乙醇溶液以体积分数10%的增加量进行梯度脱水处理。使用二甲苯进行透明处理,石蜡包埋,切片机进行连续切片,厚度约5 μm,通过苏木精-伊红染色后脱水,最终封片,置于显微镜下观察并记录。
1.5 统计分析
通过SPSS 19.0 软件对实验数据进行统计学处理分析,结果以平均值± 标准差表示。采用误差正态性(偏度-峰度检验法)和方差齐性检验(Levene's test)后,对复配添加剂浓度和运输时长进行双因素方差分析(Two-way ANOVA),对于交互作用显著的因素进行简单效应分析(One-way ANOVA),并采用邓肯(Duncan's)事后检验进行差异显著性比较。各组之间的显著性水平α=0.05。使用GraphPad Prism 9.0软件绘制相关图表。
2 结果与分析
2.1 复配添加剂对幼鱼模拟运输存活率的影响
所有参与实验的斑点叉尾鮰幼鱼在模拟运输14 h和实验结束72 h后无死亡记录。
2.2 复配添加剂对幼鱼模拟运输水质的影响
实验组水质参数如表1 所示,不同实验组的总氨氮水平经过14 h 的模拟运输后显著上升(P<0.05),在模拟运输5 h、9 h 时,F-60%组和F-100%组的总氨氮水平显著高于对照组(P<0.05)。在整个模拟运输过程中,F-40%组的复配添加剂组总氨氮水平显著低于对照组(P<0.05)。随着模拟运输时间的增长,不同实验组的pH 值显著下降(P<0.05),但经过模拟运输14 h 后,各复配添加剂组的pH值都高于对照组,其中F-40%组pH值最高。
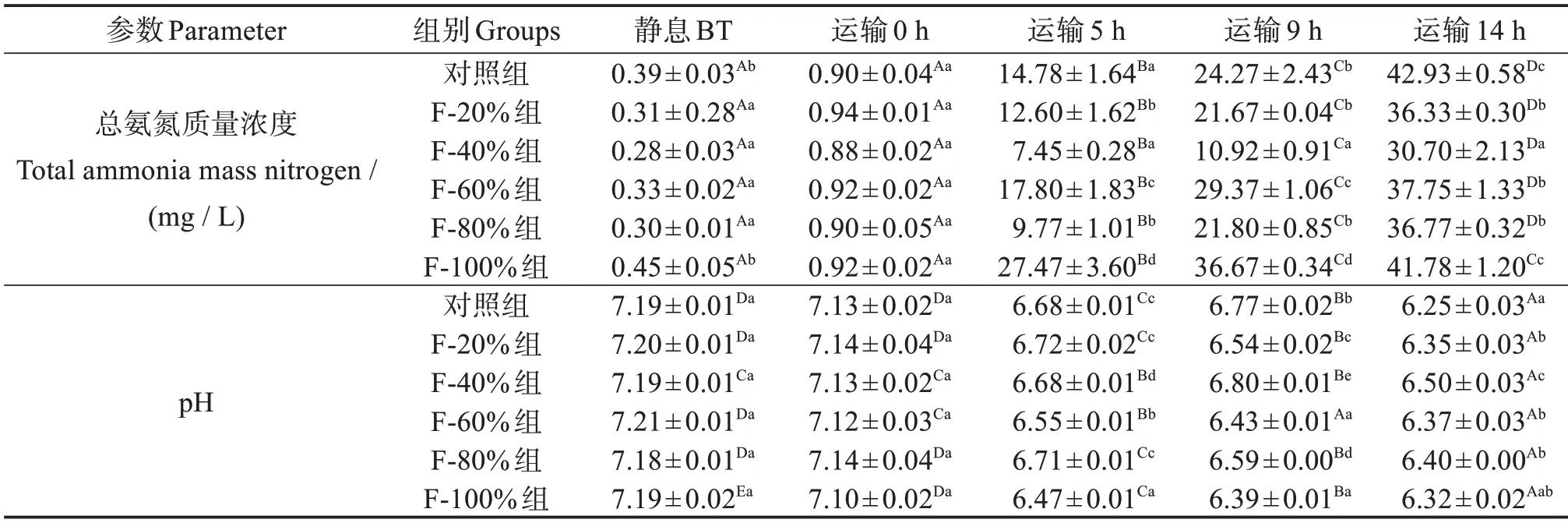
表1 不同浓度的复配添加剂下斑点叉尾鮰幼鱼模拟运输过程中水质变化Table 1 Changes in water quality during simulated transport of juvenile Ictalurus punctatus under different concentrations of compound additive
2.3 复配添加剂对幼鱼模拟运输应激指标的影响
复配添加剂实验血清皮质醇(COR)变化如图1(A)所示,在整个模拟运输过程中,各实验组的血清COR 含量与运输前相比显著上升(P<0.05),复配添加剂组血清COR 含量低于对照组。在模拟运输结束后,F-40%组的复配添加剂组COR 质量浓度最低(112.71 ng/mL),较运输前上升34.25%。图1(B)表示不同实验组血清葡萄糖(GLU)含量变化情况,运输5 h,对照组组、F-20 组、F-60 组和F-100 组GLU含量均显著上升,F-40组较其他各运输组GLU含量显著降低(P<0.05),在模拟运输9 h 时各实验组GLU 含量达到最低。经过14 h 的模拟运输,对照组、F-20 组、F-60 组和F-100 组较运输9 h 时GLU 含量显著上升(P<0.05),F-40%组和F-80%复配组血清GLU含量显著低于其他实验组(P<0.05)。
2.4 复配添加剂对幼鱼模拟运输抗氧化指标的影响
不同复配添加剂组模拟运输过程中CAT 活性如图2(A)所示,随着模拟运输时间的增加,对照组肝脏中CAT 活性显著上升(P<0.05),并始终高于不同复配添加剂组。模拟运输5 h,F-20%组复配组肝脏CAT 活性显著低于其他实验组(P<0.05)。模拟运输结束14 h,F-40%组复配组肝脏CAT 活性最低。由图2(B)可知复配在模拟运输5 h,对照组MDA含量显著高于不同复配添加剂(P<0.05),而各复配添加剂组MDA含量无显著差别。在整个模拟运输过程中,与静息BT组相比,各运输组MDA含量显著上升(P<0.05)。经过14 h 的模拟运输,F-40%组MDA含量最低。如图2(C)所示,与静息BT组相比,各运输组经过14 h模拟运输其肝脏组织中T-AOC水平显著上升(P<0.05)。在模拟运输14 h 时,F-40%组的T-AOC水平显著低于其他实验组(P<0.05)。
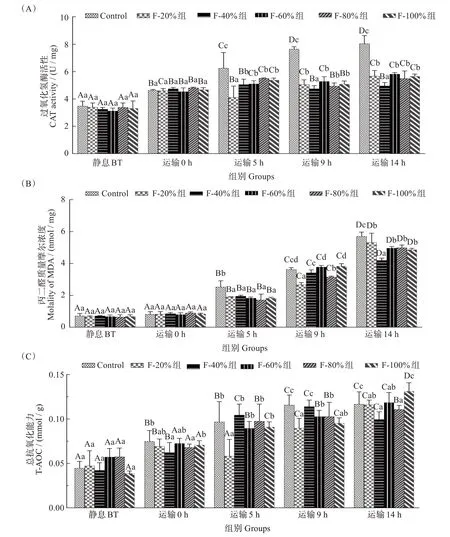
图2 复配添加剂对斑点叉尾鮰幼鱼模拟运输抗氧化指标的影响Fig.2 Effects of compound additive on antioxidant indices of juvenile Ictalurus punctatus during simulated transport
2.5 复配添加剂对斑点叉尾鮰幼鱼鳃、皮肤组织结构的影响
组织学结果显示,静息BT 组幼鱼的鳃、皮肤结构正常,而运输组幼鱼的鳃、皮肤出现不同程度的损伤。如图3 所示,F-20%组鳃小片排列方向左右不一致,且发生了弯曲现象。F-40%组鳃小片结构完整,但鳃丝内出现了细胞增生现象。F-80%组鳃小片中血细胞出现了不同程度的空泡化现象,鳃丝内黏液细胞肿胀。F-100%组鳃丝内出现了严重的细胞增生现象,黏液细胞出现了一定程度肿胀。各复配添加剂组鳃组织虽然出现了破损现象,但损伤程度都低于对照组。
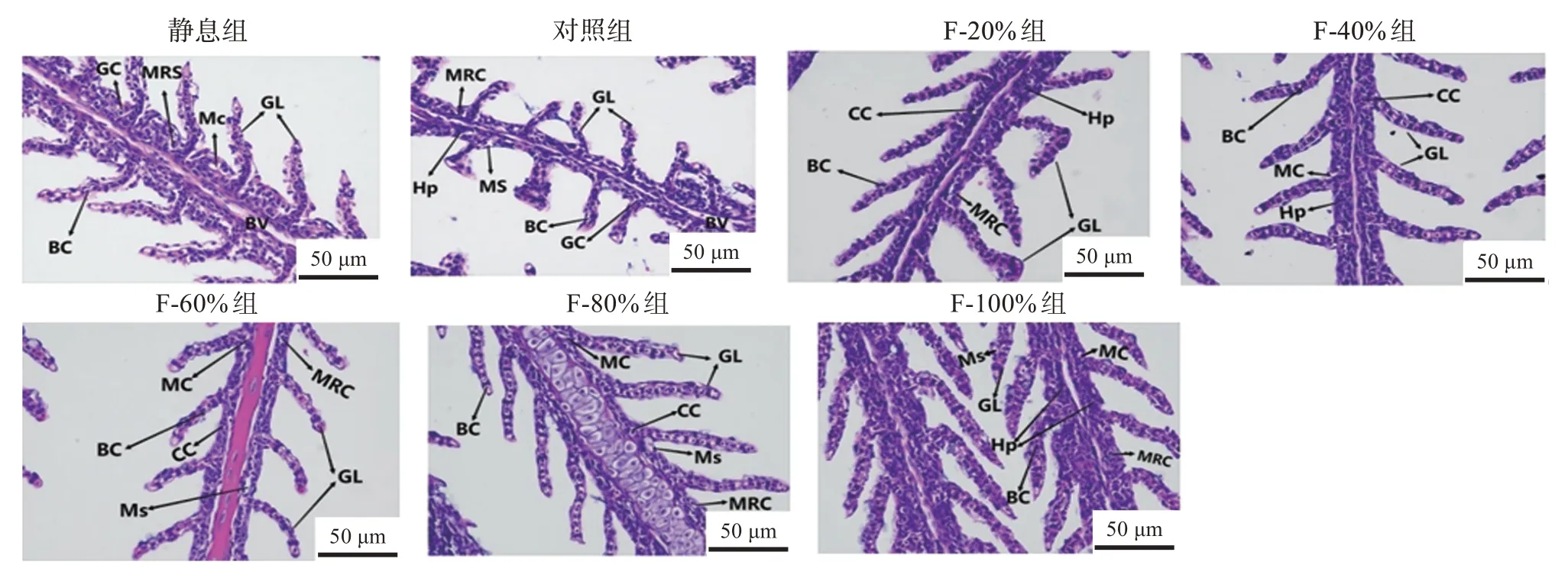
图3 不同复配添加剂组经过14 h模拟运输斑点叉尾鮰幼鱼鳃的形态Fig 3 Gills morphological changes of juvenile Ictalurus punctatus of different treatment groups after 14 h simulated transport
如图4所示,静息BT组幼鱼的皮肤结构完整,经过14 h模拟运输后,对照组表皮糜烂、上皮细胞严重脱落,黏液细胞大量分泌,上表皮层变薄。F-20%、F-60%和F-100%组的表皮都出现了脱落变薄现象。F-80%组皮肤结构完整,但出现了一定程度的黏液细胞肥大现象。F-40%组皮肤结构完整,黏液细胞数量增多。
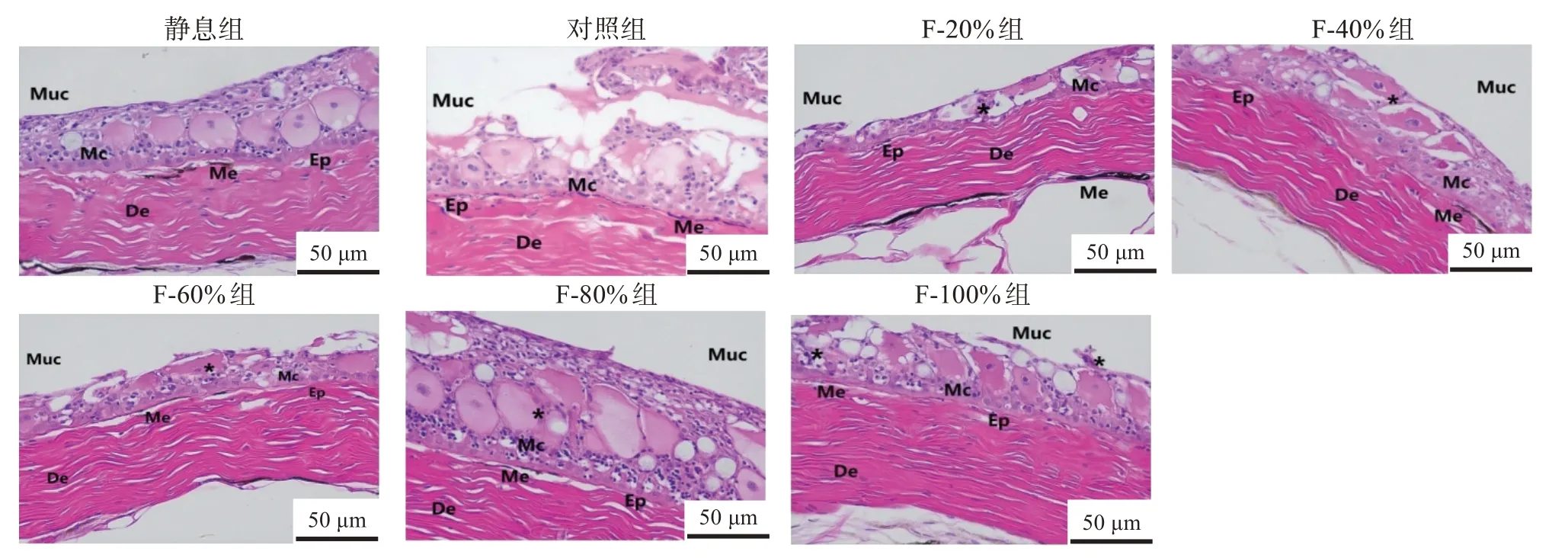
图4 不同复配添加剂组经过14 h模拟运输斑点叉尾鮰幼鱼皮肤的形态Fig.4 Morphological changes of skin of juvenile Ictalurus punctatus of different treatment groups after 14 h simulated transport
3 讨论
3.1 复配添加剂对幼鱼模拟运输水质的影响
溶解氧、温度、pH值、总氨氮等参数是评估水质的最常用、最有效标准[[20]。鱼类运输过程中一般均处在一个较为封闭的环境,水质易朝坏的方向发展,最终水质恶化导致鱼体发生应激[21]。鱼类氧呼吸作用产生的二氧化碳会溶解到水中,导致运输水体酸化并降低pH值[22]。本研究结果显示,运输导致各实验组的总氨氮水平随着时间的延长而升高。F-20%组、F-40%组和F-80%组水体中总氨氮水平在整个运输期间显著低于对照组(P<0.05),而F-100%组水体中总氨氮水平高于对照组,表明一定浓度的复配添加剂可以降低幼鱼的新陈代谢,从而减少氨类物质的排泄,过高浓度的复配添加剂可能会影响水质,导致幼鱼代谢速率加快,释放大量氨类物质到水中,最终导致水中氨氮含量增加。然而,pH 值则呈现出相反的趋势,这可能是因为一定浓度的复配添加剂能够降低幼鱼的应激水平,使代谢水平升高速率减缓,相对减少二氧化碳在水中的积累。Biswal 等[23]也发现使用质量分数0.2%葡萄糖使南亚野鲮(Labeo rohita)幼鱼在运输过程中的氨排泄减少,同时运输水质的pH 值降低减缓。本研究也发现,通过向水中加入添加剂可以减少鱼体在运输过程中氨氮、二氧化碳等代谢废物的排泄,能够达到在减少或取消中途换水操作的同时,还能将水质维持在较好水平的目标。目前常规鱼苗实际运输中一般需要进行数次换水,每换水一次耗时0.5~1.0 h,而通过本研究复配水添加后对斑点叉尾鮰幼鱼进行14 h 长距离运输时,可免除换水操作,缩短运输时长1~2 h。
3.2 复配添加剂对幼鱼模拟运输应激指标的影响
鱼类应激程度指数可以通过皮质醇的增加和持续时间来表示[24],皮质醇含量是常用来评估运输初级应激的一个重要生理指标[25]。在本研究中,经过14 h 模拟运输,各实验组的皮质醇含量显著上升,这与大盖巨脂鲤(Colossoma macropomum)的研究结果相似[26]。本研究结果表明,与对照组相比,通过使用复配添加剂可以减少运输过程中幼鱼血清皮质醇的产生,提高抗应激能力。血清葡萄糖常用来评估鱼类次级应激参数[27],血清葡萄糖的变化主要由神经和内分泌系统调节,是鱼类代谢活动的重要功能物质[28]。本研究结果表明,在模拟运输初始阶段(0~5 h),对照组血清葡萄糖含量显著上升,而复配添加剂组血清葡萄糖含量低于对照组,这说明运输应激导致幼鱼代谢水平紊乱,复配添加剂减小了幼鱼的运输应激,缓解了体内能量代谢的失衡。在模拟运输中后期(5~9 h),长时间运输应激导致幼鱼消耗大量能量,致使对照组血清葡萄糖含量降低。但添加剂的使用提高了幼鱼的抗应激能力,在整个模拟运输过程中其血清葡萄糖变化趋势低于对照组,这与WANG 等[29]对团头鲂(Megalobrama amblycephala)的研究结果类似。
3.3 复配添加剂对幼鱼模拟运输抗氧化指标的影响
运输已被证明可诱发鱼类的氧化应激,使机体内迅速产生大量氧化自由基(ROS)破坏细胞的正常生理活动[30]。CAT是生物抗氧化防御系统中的一种关键酶,通过清除ROS,产生无毒的分子氧和水[31]。机体内ROS 会与生物膜发生脂质过氧化反应(LPO),而LPO 的最终产物MDA 是鱼类体内抗氧化能力的重要指标[32]。T-AOC 是生物体整体抗氧化能力,可以较为全面地衡量生物体的抗氧化能力[33]。本研究中,斑点叉尾鮰幼鱼的CAT 活性和MDA 含量随着运输时间的延长而显著增加,可能是水中总氨氮水平升高、pH值下降以及长时间的运输应激,导致幼鱼产生过多的ROS,通过激活体内抗氧化系统,诱导负反馈机制调节额外CAT 的分泌和提高LPO 生成更多的MDA,来清除体内产生的过多ROS 以维持体内氧化还原平衡。牛磺酸、VC、VE和谷氨酰胺均有抗氧化作用,能够清除机体内过量的ROS,从而缓解氧化应激[15,34-36]。谷氨酸钠虽然是鱼类非必需氨基酸,但其分解产生的谷氨酸可以促进谷胱甘肽的合成。谷胱甘肽具有清除ROS的能力,因此谷氨酸钠可以间接提高鱼类的抗氧化能力[37]。在整个运输过程中,复配添加剂组的CAT 活性和MDA 含量低于对照组,表明复配添加剂添加能够提高幼鱼的抗氧化能力。对照组T-AOC 经过14 h 的模拟运输显著升高,表明通过向运输水中加入适当浓度的复配添加剂,可以缓解幼鱼的运输应激,减少过量活性氧的生成,进而降低鱼体T-AOC 水平。应激条件改变能量消耗和氧需求,从而影响氧化状态,本研究结果表明,通过向水中加入含牛磺酸、VC、VE纳米乳液和谷氨酰胺和谷氨酸钠的复配添加剂可以提高斑点叉尾鮰幼鱼的抗氧化应激能力,而F-40%组的CAT 活性、T-AOC最低,说明该浓度添加剂对幼鱼抗氧化应激保活效果最佳,此条件下幼鱼体内生成的ROS 较少或能够被及时清除,进而受到的氧化损伤较小。
3.4 复配添加剂对斑点叉尾鮰幼鱼鳃、皮肤组织结构的影响
鱼类的鳃组织参与许多重要的生理活动,如有氧呼吸、渗透调节、氮废物排泄和pH 调节等[38]。水产养殖生产中鱼类会受到某些环境因子引起的胁迫,会产生活性氧和含氮物,诱导鳃组织发生生理和形态改变[39]。在本研究中,经过14 h运输,各实验组幼鱼的鳃组织发生了不同程度的损伤,且对照组损伤最为严重。这可能是因为复配添加剂具有抗氧化能力,减少了氧化自由基的产生,提高了幼鱼在运输过程中的抗应激能力。
鱼类皮肤在自身免疫方面具有重要的作用,皮肤表面分泌的黏液是抵御外来病原体入侵的第一道防线[40]。本研究结果显示,运输应激会导致幼鱼皮肤结构发生一定的破坏,对照组皮肤表面变薄,可能是由于碰撞、颠簸等不利环境引起的运输应激所导致的。复配添加剂组的皮肤结构较为完整,损伤程度低于对照组,表明复配添加剂可以有效缓解运输应激。
4 结论
本实验发现,各添加剂组在运输过程中肝脏抗氧化指标(CAT 活性、MDA 含量)低于对照组,皮肤和鳃组织结构较为完整,说明向运输水中加入复配添加剂能够维持幼鱼在运输过程中体内氧化还原反应的动态平衡,缓解了无氧代谢水平以及减少氧自由基的产生,减轻运输胁迫对斑点叉尾鮰幼鱼的损伤。其中F-40%组可有效缓解运输胁迫导致的水体总氨氮、血清COR、GLU 含量的升高及水体pH值的降低。
综上,复配添加剂能够提高斑点叉尾鮰幼鱼有水运输过程中的抗应激能力,减少甚至免除换水操作,缩短运输时间且维持幼鱼的健康状态,这为鱼类长途运输提供新思路。

