哈维氏弧菌可视化LAMP快速检测方法的建立及应用
李 涛,周永灿,曹贞洁,孙 云
(海南大学海洋生物与水产学院/海南省热带水生生物技术重点实验室/南海海洋资源利用国家重点实验室,海南 海口 570228)
石斑鱼(Epinephelus)主要在我国东南沿海一带养殖,是我国南方渔民重要的经济来源之一[1]。哈维氏弧菌(Vibrio harveyi)是一种广泛分布于海洋中的嗜盐性条件致病菌,可严重威胁石斑鱼、卵形鲳鲹(Trachinotus ovatus)、矛尾复虾虎鱼(Synechogobius hasta)、方斑东风螺(Babylonia areolata)等多种水产动物的健康[2-5]。由哈维氏弧菌引起的弧菌病被认为是石斑鱼养殖过程中主要的疾病之一,流行时间多处于夏季高温期,当外界条件适宜,哈维氏弧菌大量繁殖,并通过石斑鱼的伤口、鳃或消化道侵染机体,导致机体组织器官发生病变,最终导致石斑鱼的死亡[6]。随着水产动物病害问题的日益突出,“早发现早治疗”变得尤为重要,因此,加强病原早期的快速诊断和筛查,研发病原的快速检测手段迫在眉睫。
环介导等温扩增(Loop-mediated isothermal amplification,LAMP)技术是目前等温扩增领域应用最多的方法,其具有高特异性、高灵敏度、设备简单(简易恒温装置即可)、反应快速(可在1 h内对靶序列实现109倍的扩增)等诸多优势[7]。此外,LAMP技术已实现扩增产物的可视化,即可通过在扩增产物中加入钙黄绿素、SYBR Green I、Neutral red、SYTO-9 等染料后直接肉眼观察颜色变化来判定反应情况,避免通过电泳检测、浊度仪等方法的费时现象,突破了该技术使用场合的局限性,在病原快速检测方面具有巨大的发展潜力[8]。目前,LAMP技术已在斑点叉尾鮰(Ictalurus punctatus)病毒(CCV)[9]、迟缓爱德华氏菌(Edwardsiella tarda)[10]、鳗弧 菌(Vibrio anguillarum)[11]、柱状黄杆菌(Flavobacterium columnare)[12]以及华支睾吸虫(Clonorchis sinensis)[13]等诸多病原的检测上得到广泛应用。Toic是革兰阴性菌广泛存在的一种保守蛋白,在细菌致病性、耐药性、生物被膜形成以及维持细菌胞内环境稳定等方面发挥重要的作用[14]。为加强对哈维氏弧菌的早期快速诊断和筛查,本研究以哈维氏弧菌Toic为靶基因,设计LAMP 扩增引物,以钙黄绿素染料为扩增结果指示剂,建立一种可视化的哈维氏弧菌LAMP快速检测方法。
1 材料与方法
1.1 材料
菌株:哈维氏弧菌分离自海南某养殖场患病珍珠龙胆石斑鱼(Epinephelus lanceolatus♂×Epinephelus fuscoguttatus♀),经16S RNA 测序鉴定后保存。副溶血弧菌(Vibrio parahemolyticus)、溶藻弧菌(Vibrio alginolyticus)、霍乱弧菌(Vibrio cholerae)、创伤弧菌(Vibrio vulnificus)、拟态弧菌(Vibrio mimicus)、阿尔法克弧菌(Vibrio alfacsensis)、坎氏弧菌(Vibrio campbellii)、欧氏弧菌(Vibrio owensii)与金黄色葡萄球菌(Staphylococcus aureus)均由海南大学海洋生物与水产学院经16S RNA测序鉴定后保存。
试剂:Bst DNA 聚合酶(大片段,8 U/μL)、MgSO4购自New England Biolabs 公司;甜菜碱、钙黄绿素、MnCl2购自北京索莱宝科技有限公司;Taq DNA 聚合酶购自宝生物工程(大连)有限公司;dNTPs(10 mmol/L)购自南京诺唯赞生物科技股份有限公司;细菌基因组DNA快速提取试剂盒购自天根生化科技(北京)有限公司。钙黄绿素混合液母液:将钙黄绿素溶于二甲基亚砜(DMSO)配制成5 mmol/L 溶液,再加入20 mmol/L MnCl2溶液进行淬灭。
仪器与设备:恒温水浴锅(常州越新仪器制造有限公司,中国);PCR 扩增仪(Bio-red,美国);凝胶成像系统(上海天能科技有限公司,中国);-80 ℃超低温冰箱(Thermo Fisher Scientific,美国);高速台式离心机(Eppendorf,德国);超微量分光光度计(Biodrop,英国);恒温震荡摇床、电泳仪(北京六一仪器厂,中国)。
1.2 方法
1.2.1 引物设计 从美国国家生物技术信息中心(NCBI)数据库(https://www.ncbi.nlm.nih.gov/)中获取多株哈维氏弧菌及其他多种病原菌的Toic基因序列,基于局部比对算法搜索工具(BLAST)分析比对,选取哈维氏弧菌Toic(GenBank 登录号:APP06536.1)高度保守的部分,通过在线程序软件Primer Explorer version 5.0(http://www.http://primerexplorer.jp)设计Toic-1、Toic-2 和Toic-3 共3套特异性引物组,每套引物组中均包括两个外引物(F3、B3)和两个内引物(FIP、BIP),另外再使用引物设计软件Primer 5.0 设计两个环引物LF 和LB。引物序列见表1,所有引物均由北京擎科生物科技股份有限公司合成。
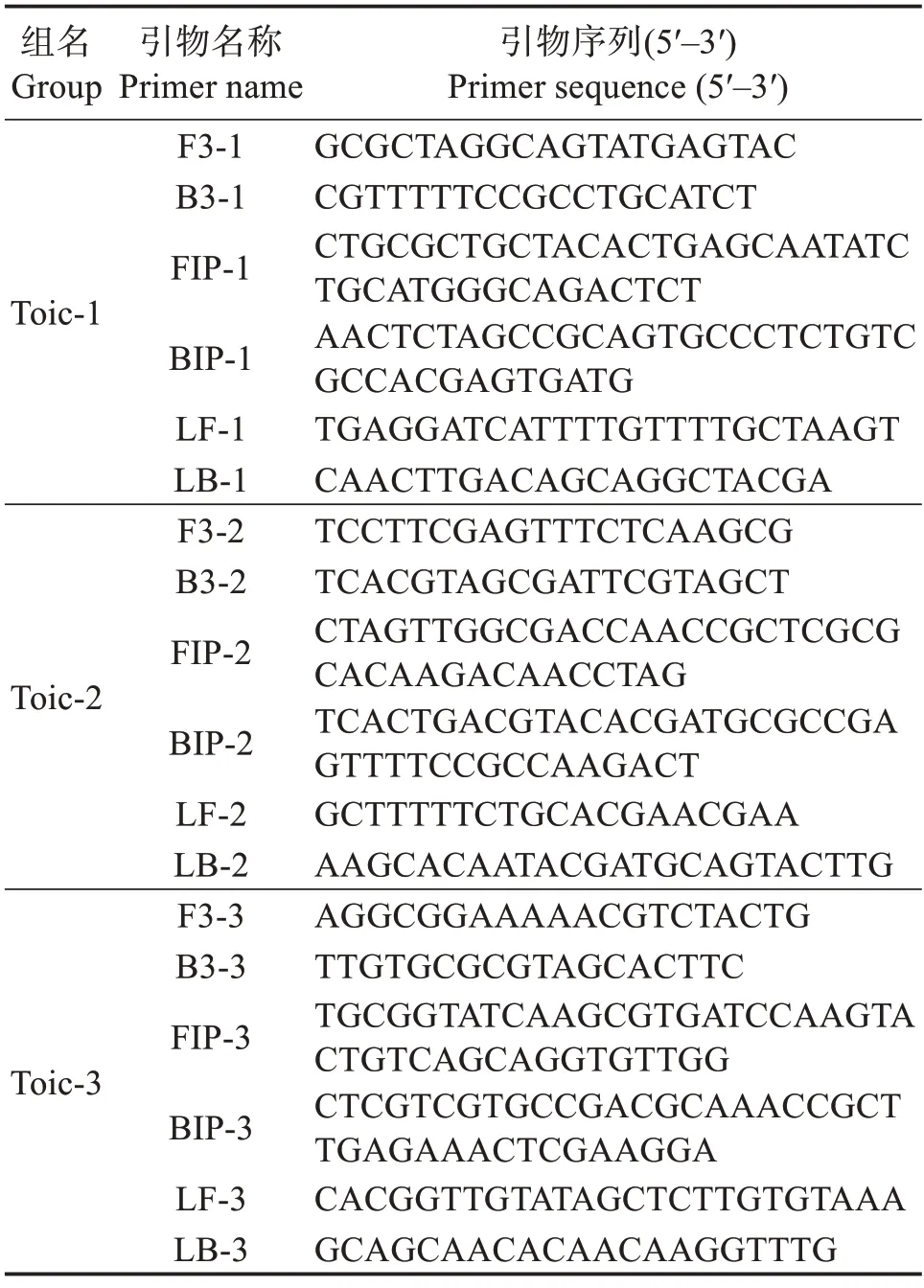
表1 LAMP扩增引物及其序列Table 1 Primer sequences used for LAMP
1.2.2 细菌培养和基因组DNA的制备 将哈维氏弧菌、副溶血弧菌、溶藻弧菌、霍乱弧菌、创伤弧菌、拟态弧菌、阿尔法克弧菌、坎氏弧菌、欧氏弧菌、金黄色葡萄球菌划线接种于Luria-Bertani(LB)固体培养基上,金黄色葡萄球菌在温度37 ℃下,其余弧菌在温度30 ℃下培养12~16 h 后,挑取单菌落于LB 液体培养基中,37 ℃或30 ℃下震荡培养至光密度D600nm≈0.8。使用细菌基因组DNA提取试剂盒提取各菌株的基因组DNA,作为LAMP扩增反应体系中的模板。
1.2.3 LAMP基本扩增体系及最佳引物组筛选 以提取的哈维氏弧菌基因组DNA 为模板,将3 套扩增引物组分别加入以下LAMP基本扩增体系中。基本扩增体系总体积为25 μL,其组分包括:10×ThermoPol Buffer 2.5 μL,MgSO4(100 mmol/L)1.5 μL,dNTPs(10 mmol/L)3.5 μL,内引物FIP、BIP(10 μmol/L)各2 μL,外引物F3、B3(10 μmol/L)各0.5 μL,环引物LF、LB(10 μmol/L)各1.5 μL,Bst DNA聚合酶(8U/μL)1 μL 和基因组DNA 模板(1 ng/μL)1 μL,ddH2O 补齐至25 μL。在恒温水浴锅中进行扩增反应,程序为:60 ℃,60 min;80 ℃,5 min。反应产物经20 g/L的琼脂糖凝胶电泳检测,以筛选出最佳引物组。
1.2.4 LAMP 扩增反应体系优化 在使用1.2.3 节筛选出的最佳引物组的基础上,采用单一变量法对LAMP 扩增反应体系进行优化。固定Mg2+浓度为6 mmol/L,dNTPs 浓度为1.4 mmol/L,外内引物比例为1∶4,环引物浓度为0.6 μmol/L,甜菜碱浓度为0 mmol/L,对钙黄绿素混合液浓度(20、50、100、150、200 μmol/L)进行优化;固定钙黄绿素混合液浓度100 μmol/L,dNTPs 浓度为1.4 mmol/L,外内引物比例为1∶4,环引物浓度为0.6 μmol/L,甜菜碱浓度为0 mmol/L,对Mg2+浓度(2、3、4、5、6、7、8 mmol/L)进行优化;固定钙黄绿素混合液浓度100 μmol/L,Mg2+浓度为6 mmol/L,外内引物比例为1∶4,环引物浓度为0.6 μmol/L,甜菜碱浓度为0 mmol/L,对dNTPs 浓度(0.8、1.0、1.2、1.4、1.6、1.8 mmol/L)进行优化;固定钙黄绿素混合液浓度100 μmol/L,Mg2+浓度为6 mmol/L,dNTPs浓度为1.4 mmol/L,环引物浓度为0.6 μmol/L,甜菜碱浓度为0 mmol/L,对外内引物比例(1∶1、1∶2、1∶3、1∶4、1∶5、1∶6、1∶7、1∶8)进行优化;固定钙黄绿素混合液浓度100 μmol/L,Mg2+浓度为6 mmol/L,dNTPs浓度为1.4 mmol/L,外内引物比例为1∶4,甜菜碱浓度为0 mmol/L,对环引物浓度(0.2、0.4、0.6、0.8、1.0、1.2 μmol/L)进行优化;固定钙黄绿素混合液浓度100 μmol/L,Mg2+浓度为6 mmol/L,dNTPs 浓度为1.4 mmol/L,外内引物比例为1∶4,环引物浓度为0.6 μmol/L,对甜菜碱浓度(0、2、4、6、8、10、12 mmol/L)进行优化。在恒温水浴锅中进行扩增反应,反应程序为:60 ℃,60 min;80 ℃,5 min。反应结束后,产物通过钙黄绿素荧光显色法和20 g/L的琼脂糖凝胶电泳进行结果判定:一方面直接通过肉眼观察反应液颜色变化来判断是否有靶序列进行扩增(阳性为亮绿色,阴性为橙黄色),另一方面用20 g/L 的琼脂糖凝胶电泳检测,最后结合实际应用及后期集成,确定合适的LAMP 扩增反应体系。
1.2.5 LAMP 扩增反应温度优化 以1.2.4 节中优化的LAMP 扩增反应体系为基础,设计不同的反应温度:58、59、60、61、62、63 ℃,进行扩增反应。反应结束后,产物参照1.2.4节通过钙黄绿素荧光显色法和20 g/L 的琼脂糖凝胶电泳进行结果判定,最后结合实际应用及后期集成,确定适宜的LAMP 扩增反应温度。
1.2.6 LAMP 扩增反应时间优化 以1.2.4节与1.2.5节中优化的LAMP 扩增反应体系和反应温度为基础,设计不同的反应时间:30、35、40、45、50、55、60 min,进行扩增反应。反应结束后,产物参照1.4.4节通过钙黄绿素荧光显色法和20 g/L的琼脂糖凝胶电泳进行结果判定,最后结合实际应用及后期集成,确定最短的LAMP扩增反应时间。
1.2.7 哈维氏弧菌Toic 基因质粒标准品的制备 以哈维氏弧菌基因组DNA 为模板,以1.2.3 节筛选出的最佳引物组中的外引物F3、B3 为引物,进行常规PCR 扩增。PCR 反应体系总体积为25 μL,其组分包括:2×Rapid Taq Master Mix 13 µL,引物F3 和引物B3 各1µL,DNA 模板(1 ng/μL)1µL,ddH2O 补齐至25 μL。反应程序:1)95 ℃预变性5 min;2)95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸10 s,共30个循环;3)72 ℃延伸5 min。反应结束后,产物使用15 g/L的琼脂糖凝胶电泳进行检测。将PCR 扩增的阳性产物进行切胶回收,并将回收后的Toic目标片段连接到pEASY-T1-simple vector 上,构建重组质粒T1-Toic,并转化至Escherichia coliDH5α 感受态细胞中,经蓝白斑筛选后挑取单克隆,经PCR 检测后送至深圳华大基因科技有限公司测序,测序成功的阳性克隆经扩大培养后用质粒提取试剂盒提取重组质粒作为标准品备用。
1.2.8 LAMP 扩增反应特异性检测 以1.2.2 节中提取的各菌株基因组DNA为模板,同时设置哈维氏弧菌Toic基因质粒标准品为阳性对照,ddH2O 为阴性对照,按照1.2.4—1.2.6 节中优化的LAMP 扩增反应体系和反应条件进行扩增反应。反应结束后,反应产物参照1.2.4节通过钙黄绿素荧光显色法和20 g/L的琼脂糖凝胶电泳进行结果判定,以确定LAMP 扩增反应体系的特异性。
1.2.9 LAMP 及常规PCR 扩增反应灵敏度检测 采用细菌基因组DNA 提取试剂盒提取培养12 h 的哈维氏弧菌的基因组DNA,测量浓度后,用ddH2O 稀释将模板浓度调整为10、100 fg/μL,1、10、100 pg/μL,1、10、100 ng/μL,作为灵敏度检测的模板。按照1.2.4—1.2.6节中优化的LAMP扩增反应体系和反应条件进行扩增反应。反应产物参照1.2.4节通过钙黄绿素荧光显色法和20 g/L的琼脂糖凝胶电泳进行结果判定,以确定LAMP扩增反应体系的灵敏度。
以上述稀释后的哈维氏弧菌基因组DNA 作为模板,以外引物F3、B3为引物,进行常规PCR 反应。反应体系和反应程序参照1.2.7 节进行。反应产物利用20 g/L 的琼脂糖凝胶电泳检测,以确定常规PCR扩增反应体系的灵敏度。
1.2.10 LAMP 检测方法的验证及在石斑鱼中的初步应用 将30 尾健康无病的珍珠龙胆石斑鱼暂养于循环水养殖系统中,随机分为2组(攻毒组和对照组),每组15 尾。震荡培养哈维氏弧菌12 h,调整菌液浓度至1×105CFU/mL,攻毒组的每尾鱼腹腔注射100 μL 哈维氏弧菌悬液。肝脏是哈维氏弧菌侵染鱼体的靶器官之一[15-17],因此,本研究在攻毒24 h后取肝脏进行哈维氏弧菌的检测。具体为:无菌环境下取鱼体肝脏,加入ddH2O 研磨并煮沸5 min,以转速12 000 r/min离心2 min,取上清液并稀释10倍作为LAMP 反应的模板。同时,将100 μL 的磷酸缓冲盐溶液(PBS,浓度10 μmol/L,pH 7.4)腹腔注射入对照组鱼,24 h 后取肝脏,经相同方法处理后作为LAMP反应的模板。
用建立的LAMP 检测方法对上述30 份石斑鱼肝脏组织样品进行检测,同时设置哈维氏弧菌Toic基因质粒标准品为阳性对照,ddH2O 为阴性对照,反应产物通过钙黄绿素荧光显色法和20 g/L的琼脂糖凝胶电泳进行结果判定。同时参照1.2.9 节中的常规PCR扩增方法对30份样品进行检测,检测结果使用20 g/L的琼脂糖凝胶电泳进行分析。
2 结果与分析
2.1 最佳引物组筛选
以哈维氏弧菌的基因组DNA为模板,用设计的3 套引物组进行LAMP 扩增反应,结果显示Toic-2引物组的扩增效果最佳(图1),因此选择Toic-2 引物组作为哈维氏弧菌LAMP扩增反应的引物。
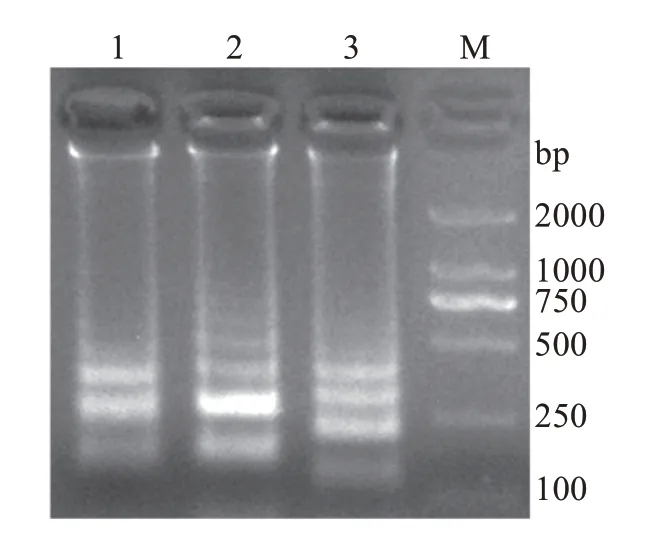
图1 不同引物组的哈维氏弧菌LAMP扩增反应Fig.1 LAMP amplification reaction with different primers
2.2 LAMP反应体系优化
分别对钙黄绿素混合液、Mg2+、dNTPs、甜菜碱、环引物及不同的外内引物比例进行LAMP 扩增体系的优化。结果显示,当钙黄绿素混合液浓度为100 μmol/L,Mg2+浓度为4 mmol/L,dNTPs 浓度为1.6 mmol/L,外内引物比例为1∶7,环引物浓度为0.8 μmol/L,甜菜碱浓度为6 mmol/L 时,特异性梯状条带最为清晰,且产物呈现亮绿色(图2(A~F))。
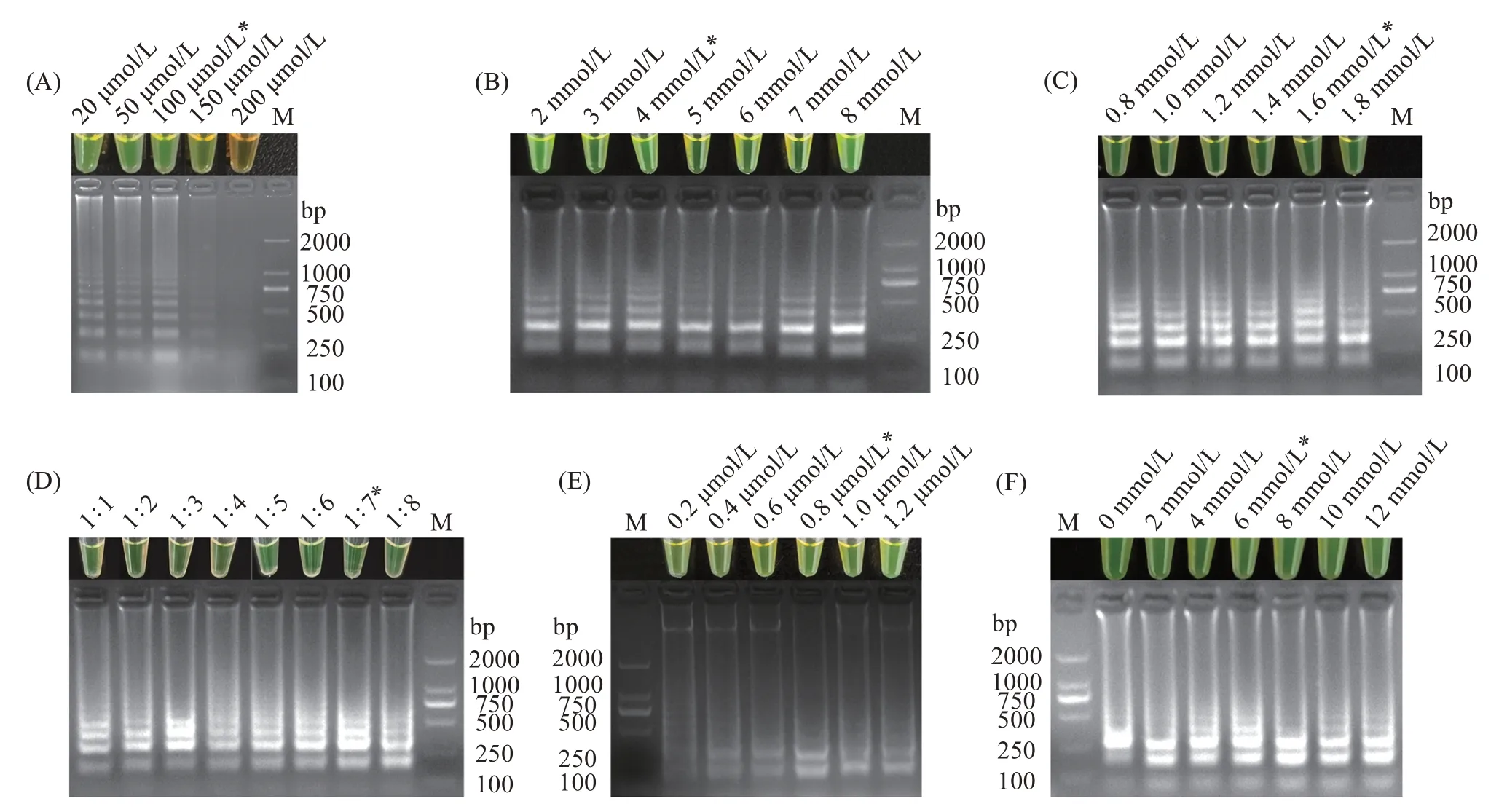
图2 哈维氏弧菌LAMP扩增反应体系优化Fig.2 System optimization of LAMP amplification reaction for Vibrio harveyi
2.3 LAMP反应条件优化
2.3.1 反应温度的优化 设置不同的反应温度进行LAMP扩增反应。结果显示,在所有选定的温度下,均可扩增出特异性梯状条带,且产物均呈现亮绿色。另外,当温度为62 ℃时,特异性梯状条带最清晰,因此哈维氏弧菌LAMP 扩增反应的最佳温度为62 ℃(图3)。
2.3.2 反应时间的优化 设置不同的反应时间进行LAMP 扩增反应。结果显示,当扩增时间为30 min时,并未出现扩增反应;当扩增时间为35~60 min时,产物均出现特异性扩增,且呈现亮绿色;且在35 min 时,即可见LAMP 扩增反应的特异性产物,当扩增50~60 min 时,特异性条带更加清晰、明亮(图4),但结合实际应用,选择50 min 为最优扩增时间。因此,哈维氏弧菌LAMP 扩增反应的最短时间为35 min,而最优扩增时间为50 min。
2.4 特异性检测
以9 种弧菌属菌株及1 种金黄色葡萄球菌的基因组DNA为模板,用优化后的哈维氏弧菌LAMP检测方法进行扩增反应。结果显示,仅哈维氏弧菌和阳性对照的扩增结果呈现清晰的梯状条带,其余9种细菌及阴性对照均未扩增出条带,且有梯状条带的产物颜色均对应呈现出亮绿色(阳性),反之,无梯状条带的产物颜色则对应呈现出橙黄色(阴性),表明本研究建立的哈维氏弧菌LAMP 检测方法具有良好的特异性,不与其他8 种弧菌菌株及金黄色葡萄球菌发生交叉反应(图5)。
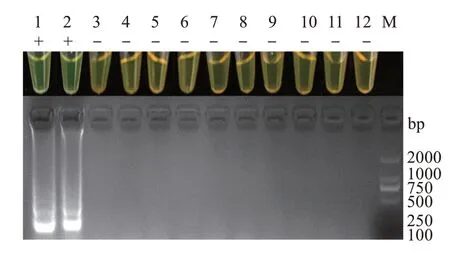
图5 哈维氏弧菌LAMP扩增方法特异性检测Fig.5 LAMP amplification for specific detection of Vibrio harveyi
2.5 灵敏度检测
用梯度稀释的哈维氏弧菌基因组DNA 作为模板,采用优化后的哈维氏弧菌LAMP检测方法及常规PCR方法进行扩增反应。结果显示,LAMP检测方法对哈维氏弧菌的检测灵敏度可达100 fg/μL(图6(A));相比之下,常规PCR法的检测灵敏度为1 pg/μL(图6(B))。由此可见,本研究建立的哈维氏弧菌LAMP检测方法的灵敏度要比常规PCR检测法高10倍。

图6 哈维氏弧菌LAMP扩增方法及常规PCR法灵敏度检测Fig.6 LAMP amplification and common PCR for sensitivity detection of Vibrio harveyi
2.6 哈维氏弧菌LAMP检测方法的应用
为验证本研究所建立的哈维氏弧菌LAMP检测方法的实用性,本研究使用哈维氏弧菌感染15尾石斑鱼,并应用该方法对采集的感染后的石斑鱼肝脏组织样品进行检测。检测结果显示,感染的15份样本均出现阳性扩增,且反应颜色与电泳检测结果一致,均呈亮绿色(图7(A))。另外,检测15 份健康未感染的石斑鱼肝脏组织样品的结果显示,所有样品均未出现阳性扩增,且反应颜色均呈橙黄色,表明这15份样品均为阴性,未感染哈维氏弧菌(图7(B))。
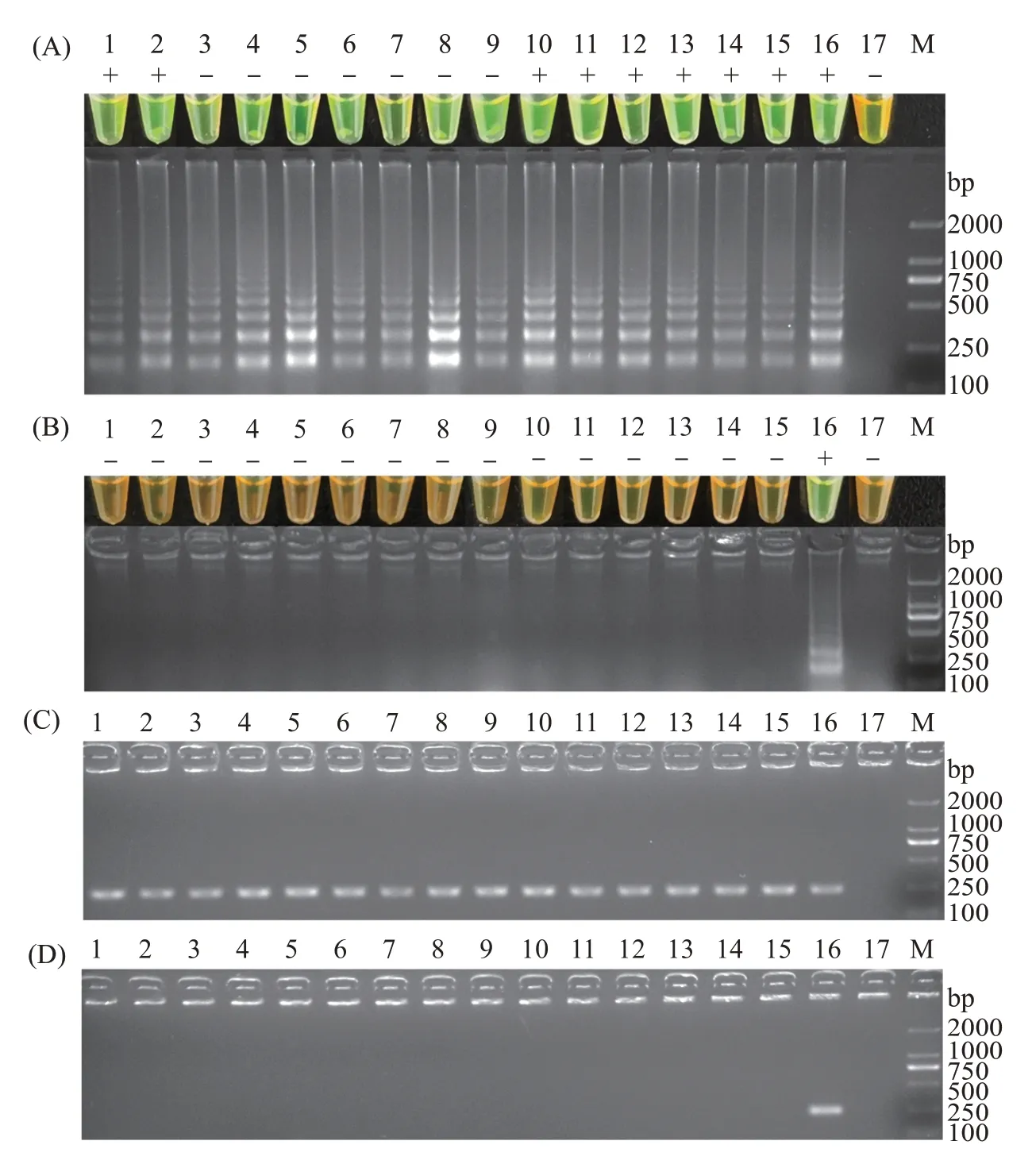
图7 哈维氏弧菌LAMP检测方法在石斑鱼中的应用Fig.7 Application of LAMP amplification method for detecting Vibrio harveyi in grouper
另外,用常规PCR 方法同样检测上述30 份样品,结果显示,15 份感染的样品均扩增出单一的目的条带,表明这些样品均受到哈维氏弧菌的感染;反之,15 份未感染的健康组织样品全部未扩增出条带,说明样品为阴性。由此可见,LAMP检测法和常规PCR法的检测结果符合率为100%(图7)。
3 讨论
哈维氏弧菌是石斑鱼养殖中常见的病原菌之一,是引起石斑鱼“烂尾病”的主要致病菌,也可严重威胁卵形鲳鲹、对虾等其他重要水产动物的健康。鉴于哈维氏弧菌的高致病性、高致死率,加强该病原早期的快速诊断和筛查十分重要。本研究针对哈维氏弧菌的Toic基因设计LAMP 扩增引物,通过优化LAMP 扩增体系及反应时间、温度,检测优化后LAMP 扩增反应的特异性和灵敏度,成功建立一种哈维氏弧菌的可视化LAMP 快速检测技术,并在石斑鱼感染哈维氏弧菌的快速诊断中进行应用。
张静等[18]根据哈维氏弧菌的ToxR基因建立一套针对哈维氏弧菌的LAMP 技术,其反应灵敏度较高,为1 fg/μL,但检测时间为45 min。该技术采用的是SYBR Green I 显色法,需在反应结束后开盖加入SYBR Green I,一定程度上存在气溶胶污染造成假阳性的风险。与之相比,本研究引入一对环引物,缩短了检测时间,最低检测时间仅为35 min,并且舍弃SYBR Green I,引入钙黄绿素染料,避免开盖可能产生气溶胶污染的问题,大大降低假阳性的可能性。涂志刚等[19]根据哈维氏弧菌的ToxR基因建立一套针对哈维氏弧菌的Real-time LAMP 技术,检测灵敏度为100 fg/μL,检测时间为40 min,具备灵敏度高,检测时间短等优点,但该技术需要借助荧光检测仪器方能进行检测。相较之下,本研究具有与其相当的灵敏度,更快的检测时间,检测结果肉眼可见且不需要借助复杂的仪器,仅需一台恒温水浴锅即可完成检测,更适合在生产一线进行临床检测。故对比前人建立针对哈维氏弧菌的LAMP快速检测方法,本研究方法优点更为突出。
此外,与常规PCR 检测方法相比,本研究建立的哈维氏弧菌可视化LAMP 快速检测技术也有较多优势。Pang 等[20]基于哈维氏弧菌toxR基因构建常规PCR快速检测方法,从开始检测到PCR 产物鉴定结束总时长约为2 h。本研究所建立的LAMP 技术可在简单的恒温水浴锅中(62 ℃)进行反应,最快反应时间仅需35 min。因此相较于常规PCR 法,该方法不仅避免使用昂贵的PCR 仪,还可节约时间近1.5 h。另外,在反应开始前即向反应液中加入钙黄绿素染料,当反应结束即可直接用肉眼对结果进行快速判定,这样既可避免反应后开盖加入染料导致的气溶胶污染,大大减少假阳性结果的出现,又可代替琼脂糖凝胶电泳分析实验结果,具有较好的简便性。同时,本研究采用LAMP检测法对30份石斑鱼感染哈维氏弧菌的组织样品进行检测,发现其检测结果与预期结果及PCR 检测结果的符合率均为100%。因此,本方法具有耗时短、特异性强、灵敏度高、仪器简单、操作简单、结果可视化等诸多优点,非常适合在生产现场进行哈维氏弧菌的快速检测,为进一步推广该技术在石斑鱼及其他水生动物哈维氏弧菌感染监测中的现场大规模应用提供了有用的技术支撑。
4 结论
本研究以哈维氏弧菌外膜通道蛋白基因Toic为靶基因,以钙黄绿素为检测结果指示剂,通过对反应体系和反应条件进行优化,成功建立一种针对哈维氏弧菌的可视化LAMP 检测方法。该方法的检测时间最快为35 min,灵敏度为100 fg/mL,特异性强,与8种弧菌及金黄色葡萄球菌均无交叉反应,可准确地检测到鱼体组织中感染的哈维氏弧菌。综上所述,本研究建立的LAMP 检测方法是一种操作简单、反应快速、特异性强、灵敏度高、结果可视化的检测方法,且适用于石斑鱼感染哈维氏弧菌的早期快速诊断。

