糖基化鲐鱼鱼松体外消化产物的抗氧化活性和氨基酸组成
施文正,陈 晴,冯 倩,姜 昕,陆佳怡
(1.上海海洋大学食品学院,上海 201306;2.国家淡水水产品加工技术研发分中心(上海),上海 201306)
鲐(Scomber japonicus),鲈形目鲭科鲐属,是海洋中上层鱼类[1],属于红肉鱼类,富含蛋白质、脂肪、多种矿物质(钙、磷、铁)、核黄素等[2]。目前,中国鲐鱼的消费依旧以直接销售为主,但鲐鱼体内含有大量的组氨酸,极易被酶催化为组胺,引起中毒。因此,鲐鱼产业需加强精深加工制品的开发,提高鱼肉保藏期,促进鱼肉制品的多样化。鱼松是以鱼为原料,经预处理、蒸、炒松等工序加工而成的一种精深加工鱼制品[3],是一种传统休闲食品,其营养丰富、风味独特、口感怡人,深受中国和东南亚消费者的喜爱。目前,对于鱼松的研究多关注其生产工艺的优化,但对鱼松在人体内消化吸收等方面的研究较少。
糖基化作用主要基于美拉德反应,利用蛋白质和糖反应生成糖蛋白[4]。目前,有关美拉德反应中蛋白的消化率不尽一致。MAJID 等[5]用乳果糖糖基化修饰乳清分离蛋白发现,糖基化后的接枝产物胃消化率更高,在模拟胃液中被全部水解。而赵谋明等[6]研究添加葡萄糖对花生分离蛋白体外消化的影响时,发现发生美拉德反应的糖蛋白胃蛋白消化率提高,而胃蛋白酶-胰酶体外消化率降低。鱼松制作过程中,糖是必要的辅料,添加糖的质量分数一般为4%~12%,加工过程中糖与蛋白质的美拉德反应对鱼松产品风味、色泽等品质的形成有重要影响,但是关于美拉德反应对鱼松消化的影响研究较少。
本研究以添加不同糖进行美拉德反应的鲐鱼鱼松为研究对象,通过体外模拟消化,测定鱼松的蛋白消化率以及消化产物的抗氧化性和氨基酸组成,探究鱼松对人体的营养价值,为开发营养性、功能性鱼松提供理论参数。
1 材料和方法
1.1 材料和试剂
鲐鱼体长(25.0±2.0)cm,购自上海市浦东新区临港新城农工商超市,于-20 ℃冻藏,随机选取20尾用于实验。碳酸氢钠、六水合氯化镁、碳酸铵、氯化钙、体积分数30%过氧化氢、铁氰化钾、三氯化铁、乙二胺四乙酸二钠、硫酸亚铁、柠檬酸钠、磺基水杨酸、胃蛋白酶(2 000 U)、猪胰酶(1∶250)购于国药集团化学试剂有限公司;二苯基苦基苯肼(DPPH)购于上海安谱有限公司。
1.2 主要仪器和设备
马尔文激光粒度仪3000,美国马尔文仪器有限公司;ELx800酶标仪,美国Biotek公司;L-8800全自动氨基酸分析仪,日本Hitachi 公司。FiveEasy Plus pH 计,METTLER TOLEDO 仪器有限公司;Mini-PROTEAN Tetra Cell电泳槽,美国伯乐公司。
1.3 方法
1.3.1 鱼松样品制备 根据Chen 等[3]的方法,以鲐鱼为原料制作鱼松。冷冻鲐鱼用流水解冻,去头、尾、内脏,切成宽2.5 cm 鱼块;将鲐鱼块于60 g/L NaCl 中浸泡15 min,用流水清洗(全程控制在10 ℃以下);将鱼块放入15 g/Lβ-环状糊精溶液中,70 ℃下浸泡10 min,腌制后的鱼肉经100 ℃蒸制20 min,去鱼皮、红肉和鱼刺,用绞肉机低速搓开,用电磁炉炒制。炒制过程中分别添加质量分数9.0%的蔗糖(Suc)、葡萄糖(Glu)、木糖(Xyl)、果糖(Fru)和半乳糖(Gal),炒制45 min,鱼肉呈较细纤维状。以不加糖鱼松(Non)作为对照组,共重复3个批次。
1.3.2 体外模拟消化 按INFOGEST 体外模拟消化系统[7]对鱼松进行消化,并制备唾液模拟液(SSF)、胃液模拟液(SGF)和肠液模拟液(SIF)。
提前预热SSF、SGF、SIF 缓冲溶液至37 ℃。鱼松、SSF按质量(g)体积(mL)比1∶3混匀,在37 ℃摇床条件下反应2 min。将口腔反应物与SGF 以体积比1∶1混合,用6 mol/L HCl调pH至2.0。置于37 ℃摇床反应2 h。用3 mol/L NaOH 调pH 至7.0,终止反应。将胃反应物与SIF 以体积比1∶1 混合,用1 mol/L NaOH 调pH 至7.5,置37 ℃摇床反应2 h。消化结束后在100 ℃沸水中加热10 min。
1.3.3 消化率的测定 将胃蛋白酶和胰蛋白酶水解产物离心(12 000 r/min,20 min),取沉淀在105 ℃下烘干至恒重,记录烘干样品质量。消化率(%)计算:
其中:m0,消化前鱼松质量;m1,烘干后沉淀的质量;w,鱼松的水分质量分数。
1.3.4 消化产物粒径的测定 参考张泽等[8]方法,取
1.3.2 胃蛋白酶消化液、胃蛋白酶和胰蛋白酶消化液,采用激光粒度仪测定粒度,D10、D50和D90分别表示微粒的积聚体积占颗粒总体积的10%、50%和90%时的粒径。
1.3.5 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)分析 将消化产物与2×上样缓冲液按照体积比1∶1混合,进行SDS-PAGE凝胶电泳分析。
1.3.6 抗氧化性的测定
1.3.6.1 DPPH 自由基清除测定 参考王乐等[9]的方法,分别将模拟胃、肠消化后所提取的不同糖鱼松消化产物配制成质量浓度分别为1、2、3、4、5 mg/mL的多肽液。取不同质量浓度的多肽液与0.2 mmol/L DPPH 自由基溶液按体积比1∶1 混匀,避光反应30 min,在517 nm 处测光密度(D)。DPPH 自由基清除率(%)计算:
式中,D样品,样品组光密度值;D对照,用去离子水代替样品的光密度值;D空白,用体积分数95%乙醇代替DPPH溶液的光密度值。
1.3.6.2 羟自由基清除测定 参考Chen 等[10]方法,将0.4 mL 磷酸盐缓冲液(0.2 mol/L,pH 7.0)与0.6 mL 5 mmol/L 的邻二氮菲溶液充分混合,加入0.6 mL 的样品溶液、0.6 mL 15 mmol/L 乙二胺四乙酸二钠溶液和0.6 mL 5 mmol/L FeSO4溶液。最后加入0.8 mL 体积分数30%的H2O2溶液,彻底混匀,37 ℃下培养60 min,在536 nm 下测光密度。计算羟自由基清除率(%)。
式中:D样品,样品组光密度值;D对照,以去离子水代替样品的光密度值;D空白,以去离子水代替H2O2的光密度值。
1.3.6.3 还原力的测定 参考蔡俊等[11]方法,测定模拟胃、肠消化后所提取的不同糖鱼松消化产物还原力。
1.3.7 氨基酸组成分析 参考王乐等[9]方法测定消化产物中氨基酸。
1.3.8 数据分析 用SPSS19.0 软件分析实验数据,采用单因素方差分析(ANOVA)和Duncan法进行多重比较,显著性水平α设为0.05,利用Origin 2018b软件作图。
2 结果与讨论
2.1 添加不同糖对鱼松体外胃肠消化率的影响
从图1可见,除添加木糖的鱼松样品外,添加其他糖鱼松在胃蛋白酶水解后的消化率显著高于未加糖鱼松(P<0.05),这可能是因为糖的添加引入了更多的亲水性羟基,致使鱼肉蛋白溶解性提高、蛋白聚集较少,使胃蛋白酶更快地消化热处理后的蛋白[12]。木糖是所有糖中美拉德反应最快且程度最高的还原糖,添加木糖鱼松的胃消化率在加糖鱼松中最低,为32.25%,表明糖基化程度高可导致胃蛋白水解保护作用更高。蛋白质在酸性pH 下的结构稳定[13],它的胃蛋白酶裂解位点(疏水或芳香氨基酸侧链)被埋在蛋白质结构中,形成强大的疏水核心并阻止水解,同时蛋白质中的疏水基团大部分暴露在蛋白表面,增加了疏水相互作用程度,促进了蛋白质聚集,这也可阻止胃蛋白酶进入酶切位点,使木糖鱼松难以消化[13]。
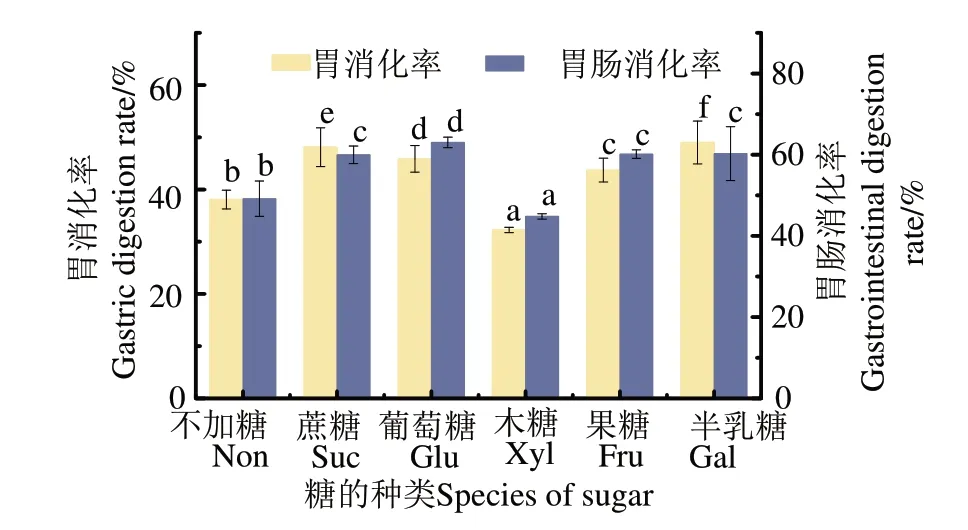
图1 添加不同糖的鱼松体外消化率Fig.1 In vitro digestibility of fish floss with different sugars
采用胰蛋白酶对鱼松的胃蛋白酶水解物进一步水解,图1胃肠消化率结果显示,经胰蛋白酶水解后,木糖鱼松的消化率从38.06%增加到44.81%,其消化率显著低于不加糖样品(49.17%),这表明加热期间木糖的存在限制了这些蛋白质对酶攻击的热诱导敏感性,蛋白质聚集使得胰蛋白酶无法接触酶切位点,从而限制了胰蛋白酶的作用效果[14]。其他加糖鱼松的消化率均显著高于未加糖鱼松,其中加葡萄糖鱼松的消化率从45.86%增加到63.02%,加半乳糖鱼松的消化率从49.00%增加到60.28%,加果糖鱼松的消化率从43.71%提高到60.15%(P<0.05)。这可能是因为糖基化使鱼肉中肌原纤维蛋白二级结构改变,α-螺旋含量降低,无规则卷曲含量升高,导致蛋白质二级结构展开,内部的酶切位点和氨基酸残基暴露,更有利于胰蛋白酶水解[15-16]。
2.2 不同糖基化鱼松消化产物的分子大小
由图2 可见,鱼松胃消化产物的SDS-PAGE 蛋白条带中,木糖样品蛋白条带较少,仅在低分子处有条带,这表明添加木糖鱼松蛋白消化水解量更少,这一结果与前面消化率结果相一致。葡萄糖样品的条带较多,这可能由葡萄糖的加入使糖基化后的鱼松蛋白溶解度升高[15]所致。鱼松胃肠消化产物结果显示,胃蛋白酶消化后出现的大部分条带在胰蛋白酶水解后消失或减弱,说明胰蛋白酶将胃蛋白酶水解出的多肽和部分溶解出的蛋白质分解成游离氨基酸或较小分子的肽。而木糖样品在200 ku和44 ku 处有条带,说明木糖鱼松经过胃蛋白酶和胰蛋白酶水解后,仍有小部分的肌球蛋白重链和肌动蛋白未被水解。
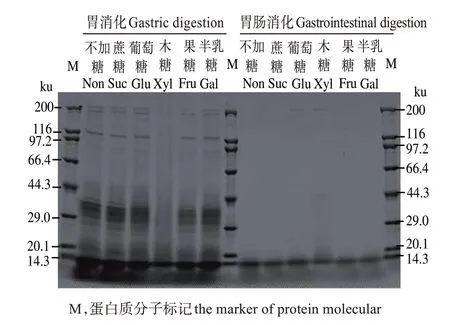
图2 添加不同糖鱼松胃肠消化后蛋白凝胶电泳变化Fig.2 Changes in SDS-PAGE of protein after gastrointestinal digestion of fish floss with different sugars
2.3 不同糖基化对鱼松胃肠消化后粒径的影响
在相同条件下,添加不同糖制作的鱼松粒径有显著差异(P<0.05)。表1 可见,随着糖的加入,除木糖外的其他糖鱼松样品在胃蛋白酶消化后粒径均有所下降,其中葡萄糖和半乳糖样品的粒径较小,可能是因为糖的加入改变了蛋白质的二级结构,使得胃蛋白酶更易接触酶切位点[15-16],这也间接表明添加葡萄糖和半乳糖的鱼松更易被胃消化。从D10、D50和D90数值变化可见,经过胰酶的进一步消化,所有组的粒径值相比于胃蛋白酶消化更小,其中果糖的D10和D50显著低于其他组,而木糖的D90显著高于其他组,这说明木糖鱼松更不易被胃蛋白酶和胰酶水解成更小颗粒,这一结果与消化率结果相一致。
2.4 不同糖基化对鱼松体外模拟胃肠道消化产物抗氧化活性的影响
2.4.1 DPPH·清除能力 鱼松消化产物的抗氧化性可用DPPH·清除能力来表示。DPPH·是一种稳定的自由基,其中心结构中的氮原子可接受多肽中的氢原子而被还原成DPPH-H 非自由基分子,表现为紫色到黄色的颜色变化,以此来判断其清除能力[17]。从图3 可见,6 种样品的DPPH·清除能力均随着消化产物浓度的增加而升高,其中胃肠消化后样品的清除能力均低于胃消化后的。胃消化后,在5 mg/mL 质量浓度下,木糖的DPPH·清除能力最大,为63.23%,这可能是因为木糖与鱼肉中的蛋白质分子发生美拉德反应,生成了较多的挥发性杂环化合物,这些具有芳香特性的五元、六元杂环化合物中π电子非定域分布于环上,碳原子上电子过剩,使碳原子上π 电子云密度提高,更易与自由基的亲核加成[16]。本研究中,DPPH·清除能力从大到小依次为木糖、半乳糖、葡萄糖、果糖、蔗糖、不加糖,说明鱼松消化产物的DPPH 自由基清除能力主要与美拉德反应程度有关,反应程度越高,生成的具有抗氧化性的杂环化合物越多,从而抗氧化性越强。推测在胃蛋白酶的作用下鱼松蛋白质可释放出更多的抗氧化活性肽,或酶水解后更多具有抗氧化性的疏水氨基酸残基暴露出来,使其自由基清除能力增强。胃肠消化后,6 种样品的抗氧化性均有不同程度的下降,这是因为在胰蛋白酶的作用下,具有DPPH·清除能力的活性肽被水解,以及特定的疏水性氨基酸从肽链中释放,导致抗氧化性降低。但是木糖样品仍表现出较高的DPPH·清除能力,再一次说明美拉德反应产物有很强的抗氧化性。
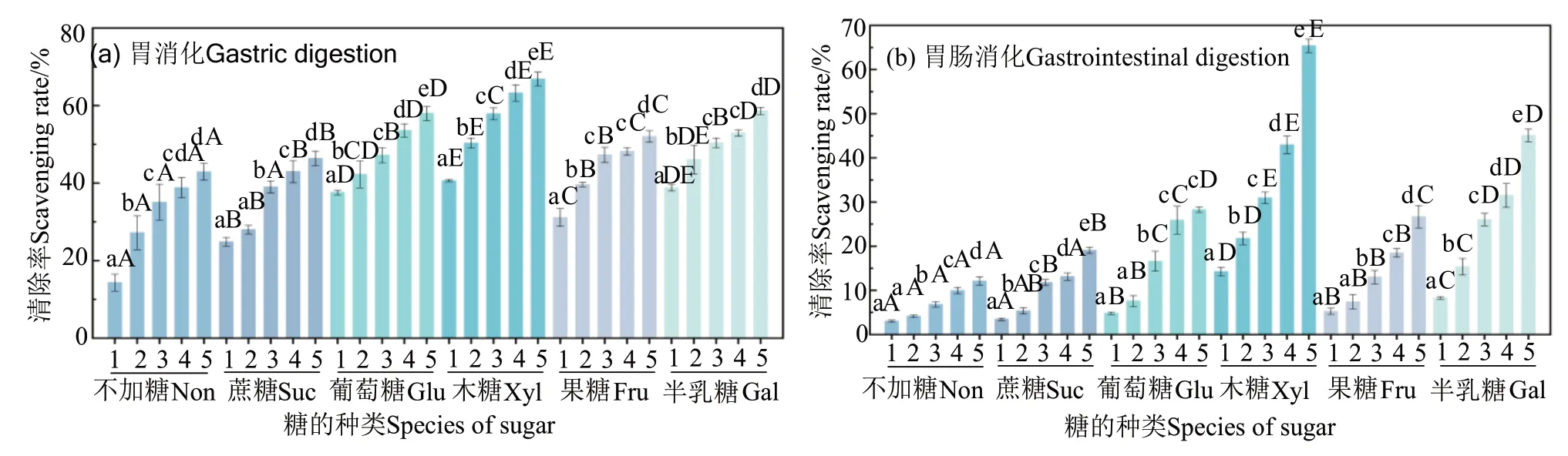
图3 添加不同糖鱼松体外消化后的DPPH自由基清除能力Fig.3 DPPH radical scavenging ability of fish floss with different sugars digested in vitro
2.4.2 羟自由基清除能力 羟基自由基可与活细胞中一些分子发生反应,导致机体组织脂质过氧化,从而对人体细胞造成损伤[17]。
从图4可见,胃消化后葡萄糖、木糖和半乳糖自由基清除能力较高,在5 mg/mL 浓度下,分别为11.98%、19.84%和11.30%。李灵诚[18]研究也发现,木糖与蛋白质反应生成的糖基化接枝产物羟自由基清除能力提高较多。添加葡萄糖、木糖和半乳糖鱼松消化产物的自由基清除能力相较于未加糖样品高,这可能是因为美拉德反应产物有一定的抗氧化性,同时糖的添加可作为氢供体来结合自由基[19]。但是,不加糖鱼松消化产物的抗氧化性高于添加蔗糖和果糖的鱼松,一方面可能是因为蔗糖是二糖,糖链长度的增加,糖基化程度趋弱,生成的糖基化产物少,抗氧化能力趋弱[20];另一方面可能是因为果糖与部分具有抗氧化性的活性肽参与美拉德反应,具有清除自由基能力的氨基基团被消耗,并且其美拉德反应产物的自由基清除能力低于这些抗氧化性肽[21]。胃肠消化后,6种样品的羟自由基清除率表现出与DPPH·清除率相同的降低趋势,但不同样品羟自由基清除能力随样品质量浓度增加而变化的趋势同胃消化后,在5 mg/mL质量浓度下,木糖鱼松样品的羟自由基清除率最大,为14.95%,未加糖和添加蔗糖的鱼松自由基清除率下降比其他样品多。
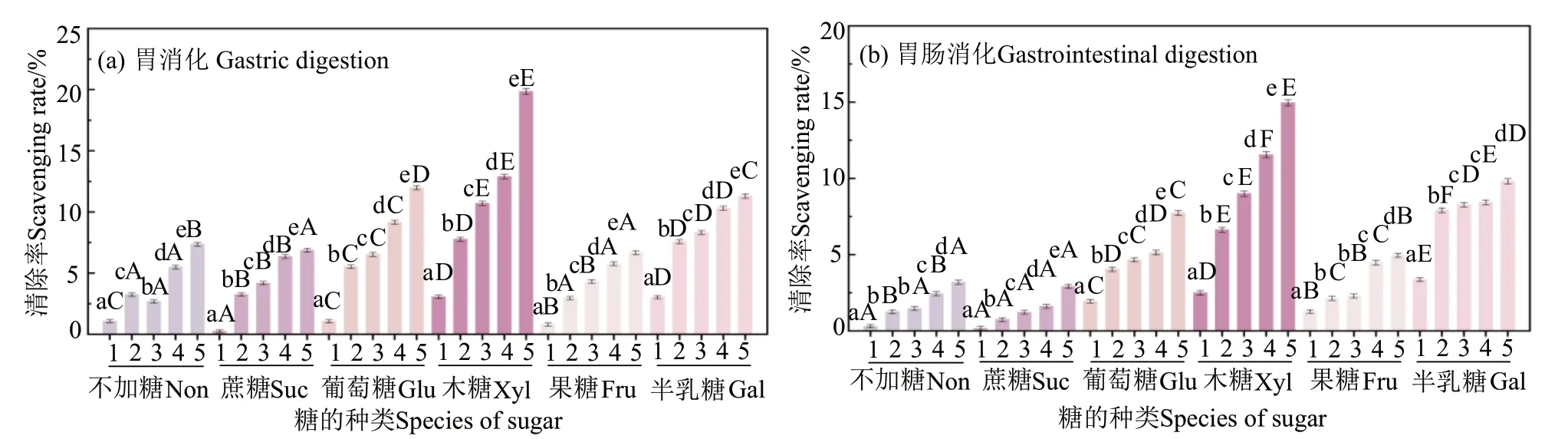
图4 添加不同糖鱼松体外消化后的羟自由基清除能力Fig.4 Hydroxyl radical scavenging ability of fish floss with different sugars digested in vitro
2.4.3 还原力 美拉德反应产物抗氧化能力与还原力密切相关。样品供电子能力越强,其还原能力就越高。供应的电子不仅可将Fe3+还原成Fe2+,同时还可与自由基反应,使其变成更为稳定的物质,从而停止自由基的连锁反应。在700 nm 处光密度越大,样品的还原力越强[22-23]。
图5显示,胃消化后,添加葡萄糖、木糖和半乳糖鱼松的消化产物一直有较高的还原能力,在5 mg/mL质量浓度下达到最大,分别为0.595、1.055 和0.637,相比于未加糖鱼松有一定的提高,一方面是因为美拉德反应迅速生成吡咯和羟基等反应产物,它们可通过氧化还原电位转移电子;另一方面美拉德反应初级阶段产物还原酮的供氢能力可能是提高还原能力的另一个机制[24]。胃肠消化后,6 种样品的还原能力同DPPH·清除率和羟自由基清除率一样有所降低,这可能是因为经过胰蛋白酶水解后,具有抗氧化性的活性肽被水解成小分子氨基酸,从而使还原能力降低。
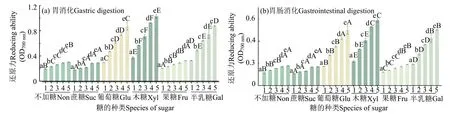
图5 添加不同糖鱼松体外消化后的还原力Fig.5 Reducing ability of fish floss with different sugars digested in vitro
2.5 不同糖基化对鱼松胃肠消化产物氨基酸组成的影响
表2 可见,鱼松胃消化产物中共检测出16 种氨基酸。总氨基酸(TAA)含量从大到小分别为添加半乳糖、蔗糖、葡萄糖、果糖、不加糖和木糖的鱼松,这一结果与消化率一致,说明消化率越大,消化产物中氨基酸的含量越高。胃消化后,必需氨基酸(EAA)占总氨基酸的比例(下称“占比”)较高,不加糖样品的必需氨基酸占比最高,为41.61%。表3 可见,胃肠消化后,所有样品的必需氨基酸占比均超过35%,说明消化产物仍有较高的营养价值。
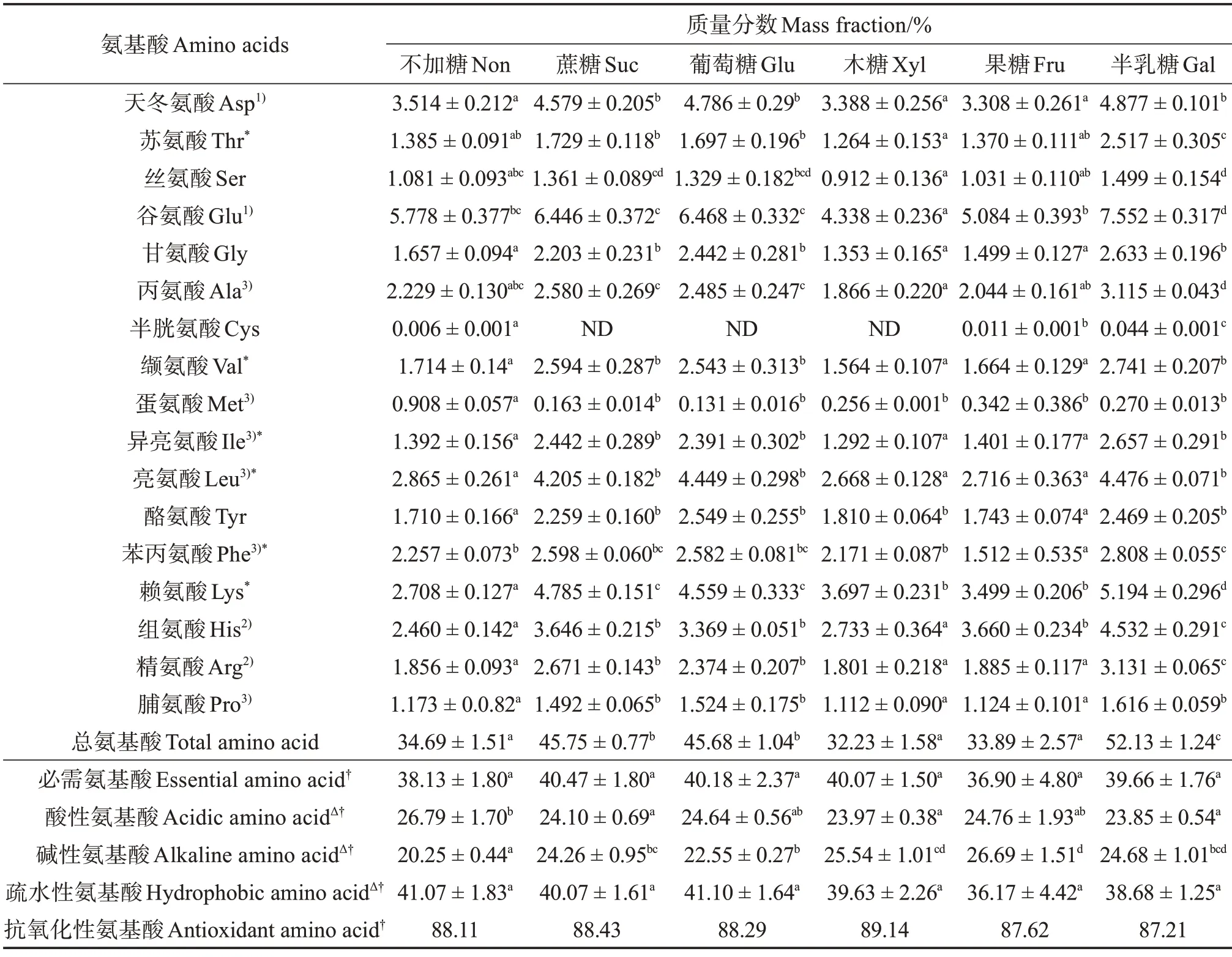
表3 鱼松胃肠消化产物的氨基酸组分Table 3 Amino acid composition of crude peptide after gastrointestinal digestion of fish floss
鱼松消化产物中主要为多肽,其抗氧化性与其氨基酸的组成有紧密联系[25]。有研究发现,多肽中含有的碱性氨基酸(赖氨酸、精氨酸和组氨酸)和酸性氨基酸(天冬氨酸和谷氨酸)可使肽段有较高的自由基清除能力和金属螯合能力,且碱性氨基酸对供氢及金属螯合的贡献高于酸性氨基酸[26]。同时,肽链中的疏水性氨基酸(色氨酸、苯丙氨酸、缬氨酸、亮氨酸、异亮氨酸、丙氨酸、脯氨酸和蛋氨酸)通常可使肽具有抗氧化性或抗氧化性增强。葛晓明等[25]研究发现,海马(Hippocampus)酶解多肽中含酪氨酸、蛋氨酸、苯丙氨酸等疏水性氨基酸的肽对清除DPPH 自由基起关键作用。廖丽琴等[27]发现,西式发酵火腿粗肽中抗氧化性氨基酸(酸性、碱性和疏水性氨基酸)质量分数超过87%,且粗肽的抗氧化活性较高。本研究中,鱼松经过胃和胃肠消化后,消化产物中的多肽含有较多的疏水氨基酸和碱性氨基酸,有利于含有疏水性氨基酸肽链的形成,帮助分子创造疏水环境,同时亮氨酸、缬氨酸和丙氨酸等疏水性氨基酸可作为芳香残基侧链上自由基过氧化的供氢体,增强肽的抗氧化性,因此多肽对于DPPH 自由基的清除能力较高[28]。但胃肠消化后,多肽中仍含有较高的抗氧化性氨基酸,对于自由基的清除能力却显著下降,这可能由紧邻于赖氨酸和精氨酸的肽键是胰酶的酶切位点[29],含碱性氨基酸的肽链被水解所致。多肽中的酸性氨基酸含量也相对较高,酪氨酸的酚羟基可供应电子猝灭自由基,酸性氨基酸天冬氨酸的羧酸根有吸电子的效应,可加强酪氨酸提供质子的能力[30-31]。其中样品胃、胃肠消化后酸性氨基酸占比最高,分别为31.80%(葡萄糖)、26.79%(不加糖),酸性氨基酸可供氢,使得Fe3+还原成Fe2+,同时Fe2+被氨基酸侧链的—NH2和—COOH 结合,从而抑制自由基被金属离子催化生成[11]。肽的抗氧化性与其氨基酸的组成、构象、排列顺序和相对分子质量等相关[32],因此仍需对鱼松经过胃、肠消化产物中多肽的氨基酸结构进行鉴定及分析。
3 结论
采用胃蛋白酶-胰酶对添加不同种类糖炒制的鱼松进行体外消化,以未加糖的鱼松作为对照,除木糖鱼松外,加糖鱼松的消化率均显著提高。模拟消化后,鱼松消化产物抗氧化性随着添加糖浓度的升高而升高,胃消化产物抗氧化性高于胃肠消化产物。木糖鱼松对DPPH 自由基和羟自由基清除能力最强。氨基酸组成可知,胃肠消化产物总氨基酸中必需氨基酸质量分数超过35%,具有一定的营养价值,同时消化产物的抗氧化活性与其氨基酸组成有关,亮氨酸、缬氨酸和丙氨酸等疏水性氨基酸以及酸性氨基酸天冬氨酸对于抗氧化的贡献较高。与未加糖鱼松相比,木糖鱼松抗氧化性氨基酸含量占比最高。

