海洋真菌来源丁内酯I的单胺氧化酶抑制活性及结构类似物虚拟筛选
杨 煜,周龙建,刘亚月,王 远,张 翼,2,3
(1.广东海洋大学食品科技学院/广东省水产品加工与安全重点实验室/广东省海洋生物制品工程实验室/广东省海洋食品工程技术研究中心/水产品深加工广东普通高等学校重点实验室/广东省现代农业科技创新中心/广东海洋大学深圳研究院海洋医药研发中心/湛江市脑健康海洋药物与营养品重点实验室/广东海洋大学海洋药物研究所,广东 湛江 524088;2.南方海洋科学与工程广东省实验室(湛江),广东 湛江 524006;3.海洋食品精深加工关键技术省部共建协同创新中心/大连工业大学,辽宁 大连 116034)
海洋真菌能够产生独特的、具有活性的次级代谢产物以适应复杂多样的海洋环境,海洋真菌越来越成为生物活性先导化合物的重要来源[1]。单胺氧化酶(Monoamine oxidases,MAOs)是一类存在于线粒体外膜上的黄素蛋白,分为单胺氧化酶A(MAO-A)和单胺氧化酶B(MAO-B)两种亚型。MAO-A 的优先反应底物有5-羟色胺、肾上腺素等,MAO-B 优先反应底物有苄胺、β-苯乙胺。运动、情绪调节、感知和认知功能的控制,以及相关疾病的出现均与单胺能信号机制密切相关。在生物体内,MAO-A 主要与抑郁症相关,MAO-B 与帕金森病相关[2-4]。若大脑中单胺氧化酶活性过强,会过量代谢体内的单胺类神经递质,并生成过量的过氧化氢,诱导神经系统紊乱和氧化损伤。氧化损伤是多种神经退行性疾病的诱因之一,如抑郁症、帕金森、阿尔茨海默症等。特别在抑郁症、帕金森患者死后的大脑切片中,都检测到表达含量过高的单胺氧化酶[5]。因此,开发单胺氧化酶抑制剂,能够在抑郁症、帕金森疾病发展中减缓大脑中单胺类神经递质消耗,减缓氧化损伤。采用活性引导的方式,本研究团队从1 株海洋真菌土曲霉(Aspergillus terreus)C23-3 的大豆培养基次级代谢产物中分离得到1个丁内酯类化合物丁内酯I(butyrolactone I),首次在体外实验验证丁内酯I 对MAO-A、MAO-B 具有抑制作用,并通过基于分子对接的虚拟筛选评价其结构类似物。
1 材料与方法
1.1 主要仪器与试剂
高效液相色谱仪(Agilent 1200,美国安捷伦科技有限公司),全波长酶标仪(Biotek Epoch2,美国博腾仪器有限公司),多功能紫外透射仪(WFH-201B,上海精科实业有限公司),冷冻干燥机(FD-1D-50,北京博医康实验仪器有限公司),精密天平(ME204,德国梅特勒托利多公司),旋转蒸发仪(N-1001,上海艾朗仪器有限公司)。5-氮杂胞苷(A800069,上海麦克林生化科技股份有限公司),5-羟色胺盐酸盐(S31021,上海源叶生物科技有限公司),苄胺盐酸盐(S64519,上海源叶生物科技有限公司),Amplex Red(ST010,碧云天生物技术有限公司),常用柱色谱试剂均为分析纯(西陇科学股份有限公司),柱层析用硅胶(青岛海洋化工集团公司)。
1.2 菌种来源及发酵条件
实验所用发酵菌株为海洋真菌土曲霉C23-3,来源于广东省湛江市徐闻珊瑚保护区的牡丹珊瑚,现保藏于广东省微生物菌种保藏中心(GDMCC),菌株保藏编号为No.60316[6]。
制备种子液:将菌株C23-3 冻存管置于28 ℃,湿度80%的霉菌培养箱活化12 h;在生物安全柜中保证严格无菌条件下将菌种接种至装有海水马铃薯葡萄糖固体培养基的培养皿中;置于霉菌培养箱中培养5~6 d 至菌落孢子生长旺盛;每块培养皿中加入10 mL 无菌生理盐水(质量分数0.9%),洗下菌落表面孢子,吸出装于无菌试管,4 ℃冷藏,备用。
大豆培养基:参照已有方法[7],略微修改。先称取大豆500 g,用粉碎机粉碎,加入500 g 盐度2%的盐水,水分完全吸收后,121 ℃高温高压(1.2×105Pa)灭菌20 min,备用。
诱导剂:根据预实验结果,加入诱导剂可提高活性物质产量,诱导剂5-氮杂胞苷用体积分数5% 二甲基亚砜(DMSO)水溶液溶解,浓度为2 mmol/L。
发酵过程:1 L 锥形瓶加入120 g 大豆培养基,均匀喷洒2 mL种子液,待培养基表面覆盖一层菌丝时,加入8 mL诱导剂,喷洒均匀。发酵30 d。
1.3 提取分离
发酵产物经乙酸乙酯萃取、浓缩后,得到粗提物(350.0 g)。将粗提物进行正相硅胶(孔径45~75 μm),常压柱层析,以正己烷、正己烷-乙酸乙酯(两者体积比8∶2、4∶6)、乙酸乙酯-甲醇(两者体积比3∶1)和甲醇作为流动相进行梯度洗脱,得到组分Fr.1~Fr.5。Fr.3 通过正相硅胶(孔径45~75 μm),常压柱层析,以二氯甲烷-甲醇(体积比为17∶1)作为流动相进行等度洗脱,得到组分Fr.3-1~Fr.3-12。Fr.3-7 通过半制备液相(不锈钢C18 柱,填料Sino-Chrom ODA-AP,15 μm,色谱柱规格20 mm ×250 mm,流动相体积分数47% 乙腈-水,流速5 mL/min)分离纯化得到化合物1(保留时间30 min)。分离过程中采用薄层层析活性自显影方法追踪具有单胺氧化酶抑制活性的化合物[8]。
1.4 单胺氧化酶提取
参照Holt 等[9]的单胺氧化酶提取纯化方法,取10 g 猪肝(市购),按质量比1∶40 比例加入预冷至4 ℃的0.3 mol/L 蔗糖溶液,用榨汁杯彻底匀浆,在离心力1 000g(转速2 100 r/min)、4 ℃的条件下离心10 min,去除表面浮沫,取上清液。将上清液在离心力10 000g(转速6 800 r/min)、4 ℃的条件下离心30 min,去除上清,保留沉淀。加入25 mL 预冷的磷酸盐缓冲液(PBS,浓度0.1 mol/L,pH 7.4),分装,-80 ℃保存。相对文献[9]的方法,增加去除表面脂质浮沫步骤,且最终加入PBS体积更小。
1.5 单胺氧化酶抑制剂活性评价
参照Bekircan 等[10]的实验方法,加以改进。反应体系总体积为200 μL,首先添加8 μL 酶液(1.4 节制备),102 μL PBS 溶液(PBS 溶液浓度与pH 值同1.4节一致,评价化合物对单胺氧化酶抑制活性时为100 μL PBS 溶液,2 μL 化合物溶液,设置浓度梯度,DMSO 溶 解),37 ℃孵 育15 min。加 入40 μL Amplex Red 溶液(0.25 mg/mL),10 μL 辣根过氧化物酶溶液(0.3 U/mL),40 μL底物(MAO-A底物为5-羟色胺盐酸盐,MAO-B 底物为苄胺盐酸盐,浓度均为0.1 mmol/L),37 ℃反应24 min,在570 nm 测量反应前后光密度差值,计算化合物对MAO-A 或MAO-B的抑制率I,使用Graphpad 8.0.2计算化合物对MAO-A 和MAO-B 的半抑制浓度(IC50)。抑制率I计算公式如式(1),ΔD1为实验组反应前后光密度差值,ΔD2为空白组反应前后光密度差值。
1.6 化合物对MAO-A、MAO-B可逆性抑制评价
1.6.1 化合物对MAO-A、MAO-B 预培养时间依赖性(time-dependent inhibition,TDI)的评价 丁内酯I浓度为2倍IC50,设置不同的化合物与单胺氧化酶预孵育时间(0、1、2、5、10、15、30 min),预孵育结束后,测定单胺氧化酶的剩余活性[11]。剩余活性AR0计算公式如式(2),ΔD1为实验组反应前后光密度差值,ΔD2为空白组反应前后光密度差值。
1.6.2 MAO-A、MAO-B 的酶活力恢复 丁内酯I 浓度为1.8 倍IC50,在反应24 min 后,测量反应前后光密度差值ΔD1,计算相对剩余活性AR,计算公式如式(3)。再添加等量底物,反应24 min 后,测量光密度反应前后光密度差值ΔD2,计算相对剩余活性[12]。
1.7 化合物对MAO-A、MAO-B抑制作用类型评价
固定酶液添加量,设置不同化合物和底物浓度,参照1.5节的实验方法,以底物浓度倒数(1/S)为横坐标,光密度差值倒数(1/D)为纵坐标,作图,评价化合物对MAO-A、MAO-B 的抑制作用类型;将不同抑制剂浓度下曲线斜率与抑制剂浓度做线性回归,计算抑制常数Ki[13]。
1.8 虚拟筛选
从Protein Data Bank(https://www.rcsb.org/)分别下载MAO-A 和MAO-B 的受体蛋白3D 结构,hMAO-A(PDB ID: 2Z5X,分辨率: 2.20×10-10m),hMAO-B(PDB ID:2V5Z,分辨率:1.60×10-10m),使用Pymol 软件去除水分子、配体,使用Autodock 4.2软件加氢,转化为“.pdbqt”格式。在Autodock 4.2 中确定对接盒子的大小与位置,确定对接范围,导出为txt 文件。从Pubchem(https://pubchem.ncbi.nlm.nih.gov/)下载注释化合物分子的3D 结构,使用Autodock 4.2 软件转化为“.pdbqt”格式。使用Autodock vina 程序完成分子对接,导出各个配体分子的最小结合亲和力得分,使用Pymol 软件观察每个配体分子与受体蛋白的氢键对接位点[14]。化合物库分子来源参考已有的丁内酯I 类似物综述文献[15-16]。
2 结果与分析
2.1 结构鉴定结果
化合物1:浅黄色油状,用二氯甲烷-甲醇(体积比10∶1)体系在GF254 薄层层析展开,比移值Rf为0.52,易溶于甲醇。核磁共振谱数据:1H NMR(700 MHz,MeOD)δH:7.59(2H,d,J=8.8 Hz,H-2',H-6'),6.86(2H,d,J=8.8 Hz,H-3',H-5'),6.49(1H,d,J=8.1 Hz,H-5″),6.53(1H,dd,J=8.2,2.3 Hz,H-6″),6.42(1H,d,J=2.3 Hz,H-2″),5.07(1H,m,H-8″),3.78(3H,s,H-7),3.43(2H,dd,H-5),3.07(2H,m,H-7″),1.67(3H,s,H-10″),1.57(3H,s,H-11″);13C NMR(176 MHz,MeOD)δC:171.8(C,C-6),170.7(C,C-1),159.2(C,C-4'),155.1(C,C-4″),140.3(C,C-2),133.0(C-9″),132.4(CH,C-2″),130.3(CH,C-2',6'),129.8(C,C-3″),128.8(C,C-3),128.4(CH,C-6″),125.2(C,C-1″),123.6(CH,C-8″),123.4(C,C-1'),116.6(CH,C-3',5'),115.0(CH,C-5″),86.8(C,C-4),53.8(CH3,C-7),39.6(CH2,C-5),28.7(CH2,C-7″),26.0(CH3,C-10″),17.8(CH3,C-11″)。质谱数据:ESI-MSm/z(电喷雾质谱质荷比):425.1607[M+H]+(实测值),425.1600[M+H]+(理论值,C24H25O7+)。圆二色谱数据(MeOH,c 0.5):λ(Δε)[λ为波长(nm),Δε为吸收系数差(°)]:232(-0.003 82),253(0.003 05),286(-0.004 08),320(0.005 15)。经数据库检索,该化合物确定为已知化合物丁内酯I,比较波谱数据与文献报道一致[16-19],分子式为C24H24O7,相对分子质量为424.4,分子结构如图1所示。上述核磁共振氢谱、碳谱、高分辨质谱及圆二色谱谱图见图2~图5。
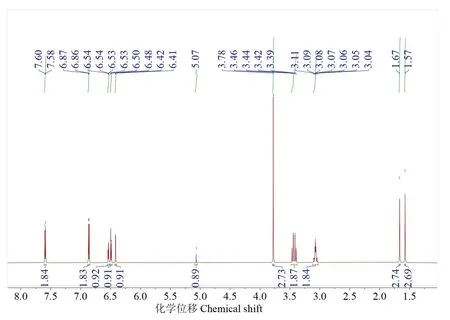
图2 丁内酯I氢谱(700 MHz,CD3OD)Fig.2 1H-NMR spectrum of butyrolactone I(700 MHz,CD3OD)
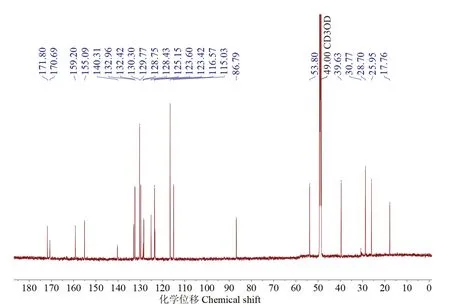
图3 丁内酯I碳谱(176 MHz,CD3OD)Fig.3 13C-NMR spectrum of butyrolactone I(176 MHz,CD3OD)
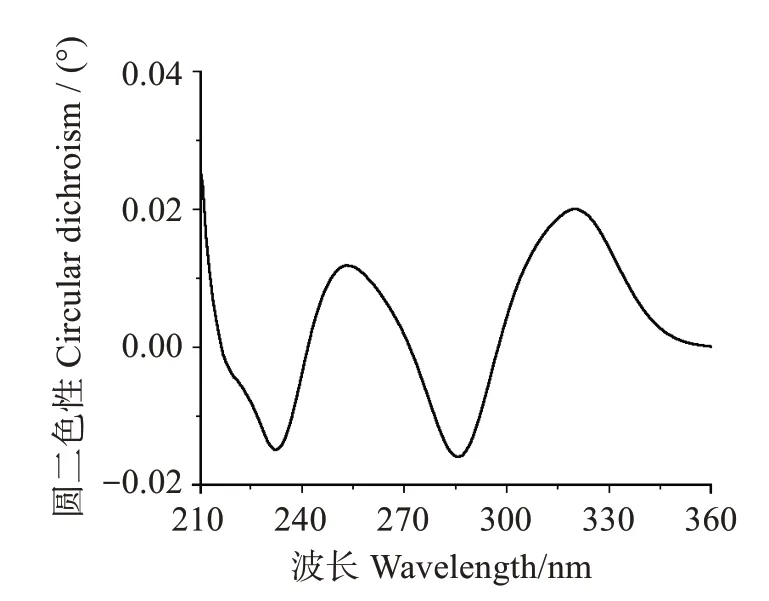
图5 丁内酯I的圆二色谱图Fig.5 Circular dichroism spectrum of butyrolactone I
2.2 丁内酯I抑制单胺氧化酶活性评价
以丁内酯I 对MAO-A、MAO-B 的抑制率为纵坐标,丁内酯I 浓度对数值为横坐标,使用Graphpad8.0.2非线性拟合,丁内酯I 抑制MAO-A 和MAO-B的活性评价结果如图6(A,B)所示,丁内酯I 对MAO-A 的半抑制浓度为21.45 μmol/L,对MAO-B的半抑制浓度为24.16 μmol/L。
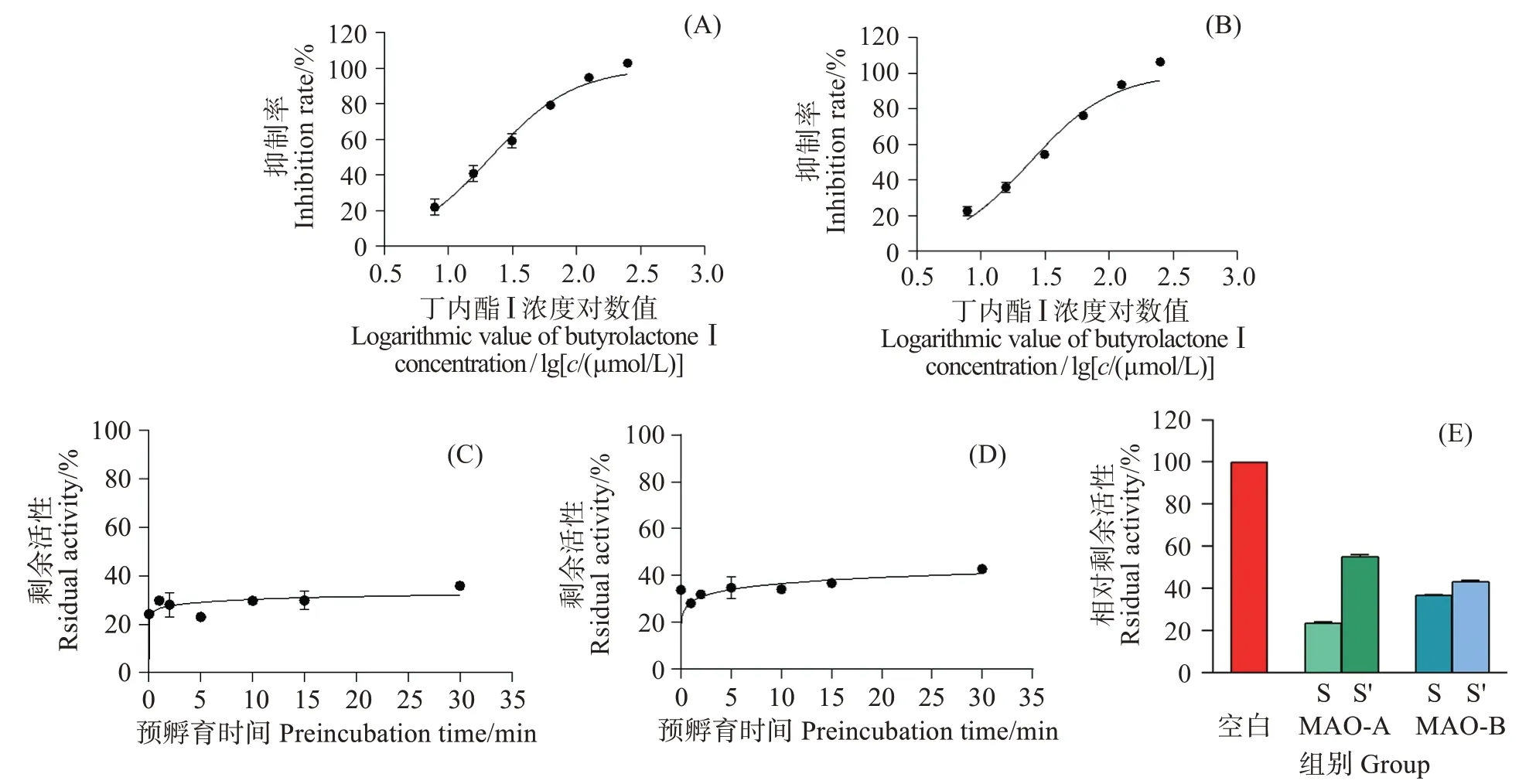
图6 丁内酯I对MAO-A和MAO-B的抑制动力学曲线和可逆性分析Fig.6 Kinetic curve and reversibility of butyrolactone I inhibiting MAO-A and MAO-B
2.3 化合物抑制MAO-A、MAO-B可逆性抑制评价
丁内酯I 对MAO-A、MAO-B 的预孵育时间依赖性评价如图6(C,D)所示,以MAO-A、MAO-B 的相对剩余活性为纵坐标,丁内酯I 与单胺氧化酶的预孵育时间为横坐标,使用Graphpad 8.0.2非线性拟合。以MAO-A、MAO-B 的相对剩余活性为纵坐标,记录MAO-A、MAO-B 在反应结束后加入等量底物的酶活性恢复情况(图6(E))。
对于丁内酯I对MAO-A 和MAO-B 的预孵育时间依赖性,从图6(C,D)中可见,在长达30 min 的预孵育过程中,MAO-A 和MAO-B 的活性没有发生显著变化,这意味着丁内酯I 不具备对MAO-A 和MAO-B时间依赖性的抑制。在图6(E)中,通过在第一次反应结束后添加等量的底物,MAO-A 的相对活性从23.7%恢复到55.1%,MAO-B 的相对活性从36.8%恢复到43.14%。这些结果表明,丁内酯I 对MAO-A和MAO-B的抑制作用是可逆的。
2.4 化合物对MAO-A、MAO-B的抑制作用类型评价
以反应速度倒数为纵坐标,底物浓度倒数为横坐标,绘制Lineweaver-Burk双倒数图(图7)。由图7(A,C)可见,对照组与实验组散点图连线延伸几乎与坐标轴的x轴负轴相交于一点,因此,可以判断丁内酯I 对MAO-A、MAO-B的抑制作用类型均属于非竞争性抑制,即不与底物争夺酶的催化位点。以Lineweaver-Burk双倒数图斜率-抑制剂浓度倒数作图得到图7(B,D),求得丁内酯I对MAO-A的抑制常数Ki为6.27 μmol/L,对MAO-B的抑制常数Ki为12.61 μmol/L。
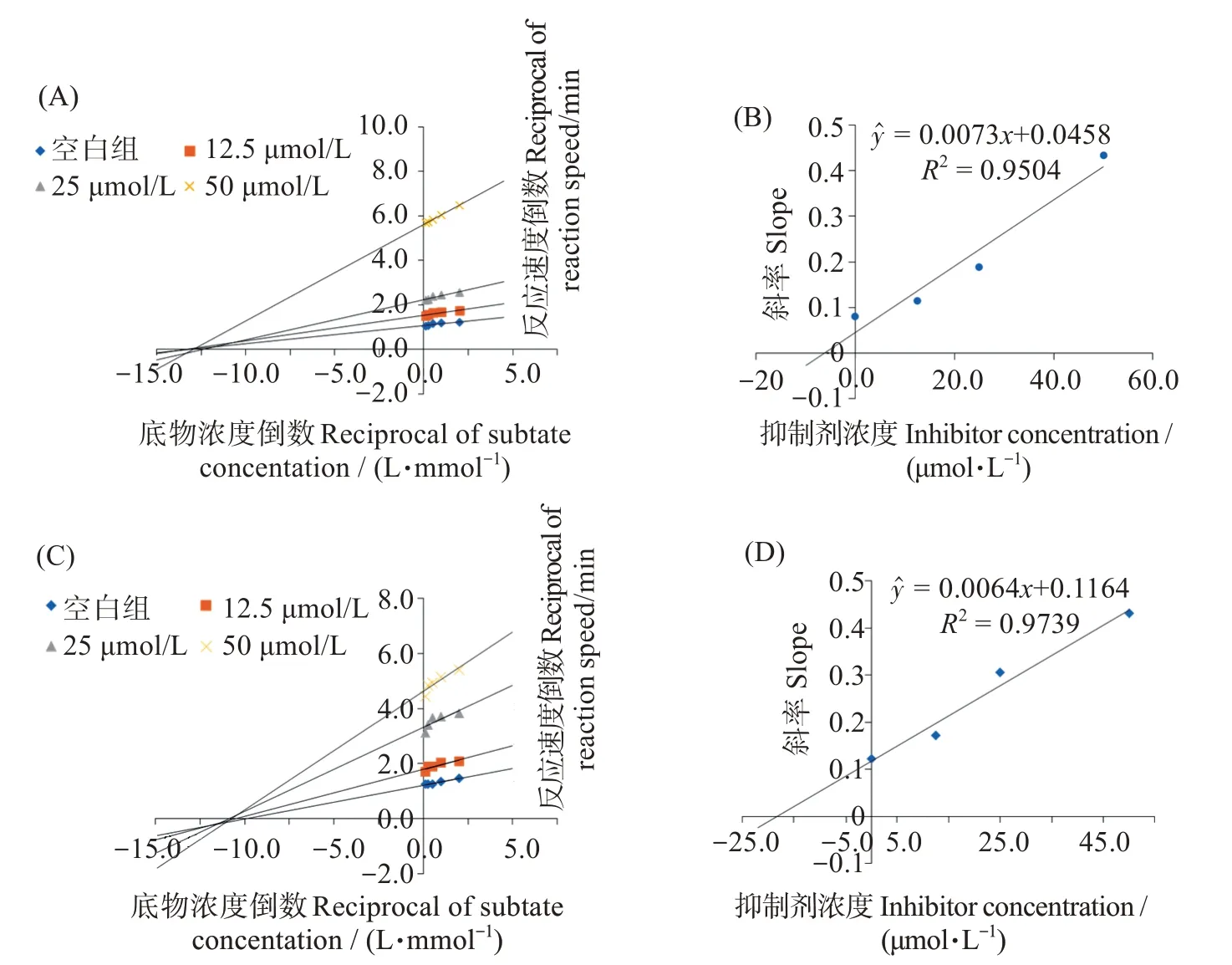
图7 丁内酯I 对MAO-A、MAO-B的酶动力学研究Fig.7 Enzymatic kinetic study of butyrolactone I inhibiting MAO-A and MAO-B
2.5 分子对接与虚拟筛选
丁内酯I 与MAO-A、MAO-B 分子对接的最小结合亲和力得分分别为-33.5 和-31.4 kJ/mol,通过Pymol 观察,丁内酯I 与MAO-A 的结合位点为Ala-111、Phe-112、Glu-492,共形成4个氢键(图8(A));与MAO-B的结合位点为Arg-36、Phe-274、Asn-275、Gln-392(图8(B))。从图8(B)可发现,丁内酯I 并未进入MAO-B 的芳香笼(活性位点中底物的结合区域,见图8(B)中虚线框标注的空腔),而是与辅基FAD 的苯并吡唑啉环附近的位点结合,从而影响到底物与苯并吡唑啉环的非共价结合。
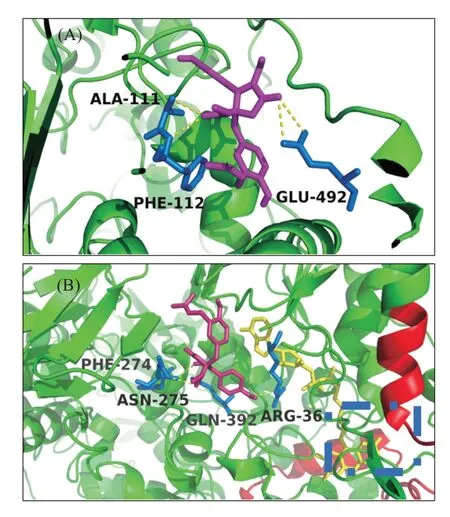
图8 丁内酯I与MAO-A、MAO-B的对接位点Fig.8 Docking sites of butyrolactone I with MAO-A&MAO-B
以丁内酯I 为先导化合物,搜索丁内酯I 的类似物(搜集文献中报道的真菌来源芳基丁内酯类化合物共计127 个),将这些丁内酯I 类似物与MAO-A、MAO-B 进行基于分子对接的虚拟筛选,以发现此类化合物中更具抑制MAOs 潜力的化合物。结果显示,对MAO-A 的最小结合亲和力得分低于-42.0 kJ/mol[20-21]的化合物有3 个,对于MAO-B的最小结合亲和力得分低于此值的有11个,对于这两种MAO 亚型最小结合亲和力得分均低于此值的化合物有2 个(Aspulvinone J-CR,化合物序号80;Aspulvinone N-CR,化合物序号70)。其中Aspulvinone J-CR 与MAO-A 的最小结合亲和力得分最低,为-49.4 kJ/mol,Aspulvinone C(化合物序号55)与MAO-B的最小结合亲和力得分最低,为-49.8 kJ/mol。将最小结合亲和力得分通过Origin 2018 软件作热图,其中丁内酯I序号为1(图9),部分具有较低的最小结合亲和力得分的分子结构如图10所示。
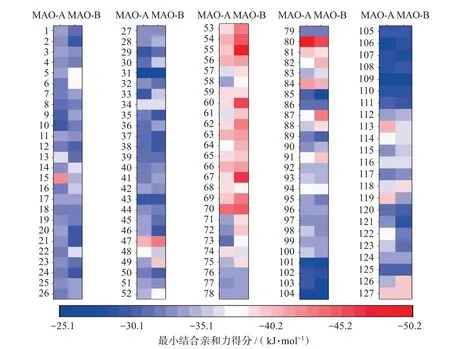
图9 丁内酯I类似物虚拟筛选最小结合亲和力得分Fig.9 Scores of minimum binding affinity of butyrolactone I analogs in virtual screening
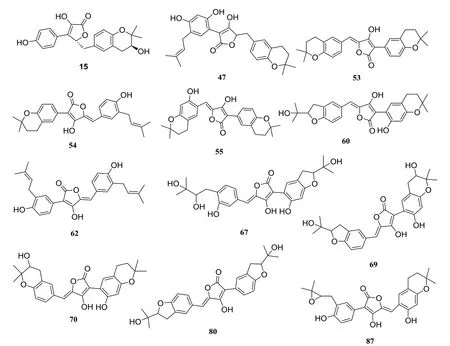
图10 虚拟筛选中最小结合亲和力得分低的丁内酯I类似物结构Fig.10 Structures of butyrolactone I analogues with lower minimum binding affinity in virtual screening
在图9 中,颜色越红,则代表化合物与MAOs在虚拟筛选中的最小结合亲和力得分越低,构象越稳固。在真菌来源丁内酯类化合物中,化合物15、47、53、54、55、60、62、67、69、70、80 和87 均具有较低的最小结合自由能得分。总体而言,这些化合物对于MAO-B 的亲和力高于MAO-A,当含有两个苯并呋喃基团时(化合物80),则更倾向于结合MAO-A。
3 讨论
为了分离得到具有抑制单胺氧化酶活性的化合物,根据前期预实验筛选结果选择土曲霉C23-3在大豆培养基进行发酵。以活性引导方式从发酵产物中分离得到化合物丁内酯I,通过核磁共振等波谱学分析鉴定其结构。以Amplex Red 作为显色剂,建立一个单胺氧化酶抑制剂评价模型。选择Amplex Red 做为显色剂主要因为过氧化氢与Amplex Red 的显色反应具有高度灵敏性,且底物浓度适中。通过此评价模型,实验研究发现,丁内酯I对MAO-A、MAO-B 具有中等的抑制活性,半抑制浓度(IC50)分别为21.45 μmol/L和24.16 μmol/L。相比现有的海洋来源天然单胺氧化酶抑制剂及衍生物(如Lewellyn 等[22]合成的aplysinopsin 类似物),对MAO-A 和MAO-B 的半抑制浓度最低可以达到5.60 nmol/L 和0.21 μmol/L,丁内酯I 对单胺氧化酶的IC50值虽然比现有单胺氧化酶抑制剂高,但该化合物作为一个天然产物可为以后的药物设计提供新的思路。同时,通过预孵育时间依赖性实验、酶活恢复能力实验和抑制作用类型实验,证明丁内酯I对MAO-A、MAO-B 的抑制作用是可逆的。酶动力学实验结果表明,丁内酯I 对MAO-A、MAO-B 是起非竞争性抑制作用,抑制常数Ki分别为6.27 μmol/L和12.16 μmol/L,这说明丁内酯I更倾向于与MAO-A结合。分子对接观察蛋白质-配体结合构象,丁内酯I 并没有进入单胺氧化酶狭长的反应腔或与辅酶FAD 结合,而是影响其他与酶活性相关的残基,这与非竞争性抑制剂的特点,即与酶活性位点以外的部位结合,不与底物形成竞争关系相吻合。
为了比较真菌丁内酯类化合物对MAOs 的抑制活性强弱,通过建立相应的丁内酯I 类似物库进行虚拟筛选,对其最小结合亲和力进行得分。实验结果发现,分子对接中丁内酯I 与MAO-A、MAO-B的结合位点不同于已有的MAO 抑制剂的文献报道[14,23],增加了丁内酯类化合物开发成为新型单胺氧化酶抑制剂的可能性。同时,在虚拟筛选中发现预测与MAOs 结合能力更强的丁内酯类似物分子,其分子结构上多具有苯环-五元内酯环-苯并呋喃/吡喃的特征,而且中间五元环多为α,γ-二芳基取代的aspvinone 类型,总体上对于MAO-B 的亲和力高于MAO-A。由于这些报道的丁内酯类天然产物[15-16]多数没有商品来源且合成不便,故本研究中没有对这些化合物进行实际酶抑制活性的测试,这也是相关研究未来需要深入进行的方面。真菌中蕴藏有丰富的丁内酯类天然产物,本研究得到的虚拟筛选和构效关系表明该类化合物的单胺氧化酶抑制活性值得深入研究。
4 结论
本研究从一株海洋土曲霉(Aspergillus terreus)C23-3 的大豆培养基次级代谢产物中分离得到丁内酯I,对丁内酯I 的体外单胺氧化酶抑制活性的研究表明其对MAO-A、MAO-B 具有抑制作用,并通过基于分子对接的虚拟筛选评价其真菌来源结构类似物的MAO 抑制活性。本研究丰富了丁内酯类化合物的活性多样性,为后续深入开发该属真菌生物活性成分提供新思路。

