杜仲提取物增强骨髓基质细胞移植对创伤性脑损伤治疗效能相关性研究
刘 欣, 刘 亮, 张 旭
北部战区总医院 1.神经内科;2.心血管外科,辽宁 沈阳 110016
创伤性脑损伤(traumatic brain injury,TBI)是全球范围内致残致死的主要原因之一[1]。TBI所导致的运动障碍等神经功能缺损长期存在,给患者造成痛苦和经济负担。TBI发生时,暴力直接作用于脑组织造成神经元死亡。原发损伤发生后,氧化应激、神经炎症反应等继发病理持续蔓延,可导致周围区域神经元凋亡等继发损伤。尽管有大量研究阐发TBI发病机制,但临床上目前仍缺乏减轻TBI神经后遗症的有效方法[2]。基于干细胞移植的治疗方法有助于补充和替代受损的神经元,并且能够帮助重建受损的神经环路,促进TBI患者神经功能恢复。但干细胞来源有限、免疫排斥等问题是该疗法应用的关键障碍。骨髓基质细胞(bone marrow stromal cells,BMSCs)是骨髓来源、具有多向分化潜能的间充质干细胞[3]。BMSCs在骨髓中含量相对丰富且易于提取,用于自体移植可有效避免移植排斥,是理想的移植细胞。有研究报道,经多途径移植的BMSCs可有效向组织损伤灶归巢迁移,并可向神经元方向分化[4]。然而,诱导BMSCs分化为功能性神经细胞的稳定有效策略并不明确。杜仲(eucommia ulmoides,EU)是一种具有补肝肾、坚筋骨,补中气等作用的中药,含有苯丙素类(如绿原酸)、黄酮类、多糖类等多种生物活性成分[5]。药理学和临床研究发现,EU可产生持久的中枢性降压效应,并能有效改善脊髓灰质炎后遗症[5-6],提示EU可能具有神经功能调节和神经损伤修复作用。但EU能否诱导BMSCs等干细胞神经分化尚不清楚。本研究旨在探讨EU提取物对BMSCs形态、增殖和神经分化等生物学特性的改变,明确EU预处理对BMSCs移植治疗TBI神经功能障碍和组织损伤效能的影响。现报道如下。
1 材料与方法
1.1 主要材料
1.1.1 实验动物 40只3月龄(22~25 g)雄性C57BL/6小鼠(8只用于提取原代BMSCs、32只用于体内实验)、8只3月龄(22~25 g)雄性C57BL/6-Tg(CAG-EGFP)1O sb/J绿色荧光蛋白(green fluorescent protein,GFP)转基因小鼠购自南京生物医药研究院[合格证号:201706897;许可证号:SCXK(苏)2015-0001],饲养于恒温(21℃)、恒湿(50%)、12 h:12 h光照/黑暗周期的SPF级动物室。所有动物实验按照北部战区总医院实验动物管理及保护的有关规定进行(伦理号:2020-009)。
1.1.2 主要试剂 EU提取物(规格:杜仲绿原酸5%;恒兴生物,张家界)、CCK-8试剂盒(货号:C0037;碧云天,上海)、兔抗神经原纤维轻链(neurofilament light chain,Nefl)多克隆抗体(货号:12998-1-AP;Proteintech,武汉)、兔抗微管相关蛋白2(microtubule associated protein 2,MAP2)多克隆抗体(货号:17490-1-AP;Proteintech,武汉)、小鼠抗GFP单克隆抗体(货号:66002-1-Ig;Proteintech,武汉)、TRIzol试剂(货号:15596026;Thermo Fisher,上海)、TaKaRa RNA PCR Kit Ver.3.0(货号:RR019A,TaKaRa,日本)、TB Green Premix Ex Taq Ⅱ(货号:RR820A,TaKaRa)。
1.2 实验方法
1.2.1 实验设计与分组 体外实验:将原代培养C57BL/6小鼠来源BMSCs接种于6孔板,分为EU组、Control组(每组8复孔),分别以添加EU提取物(100 μg/ml)和等量溶剂(0.9%生理盐水)的基础培养基培养14 d或70 d。通过相差显微镜观察细胞形态变化。通过细胞融合度分析和CCK-8试验检测细胞增殖。通过NEFL和MAP2的免疫荧光(immunofluorescence,IF)染色及Oct4、Nefl、神经分化因子(neuro differentiation factor 1,Neurod1)和神经生长因子(nerve growth factor,Ngf)的定量逆转录聚合酶链反应(quantitative reverse transcription polymerase chain reaction,qRT-PCR)检测细胞神经分化。
体内实验:将3月龄雄性C57BL/6小鼠随机分为Sham surgery组、TBI组、TBI+BMSCs组和TBI+EU_BMSCs组(每组各8只)。对TBI组、TBI+BMSCs组和TBI+EU_BMSCs组进行TBI手术。术后7 d,TBI组给予100 μl PBS,TBI+BMSCs组经眶内静脉注射1×106无特殊处理的GFP转基因小鼠来源BMSCs(100 μl PBS悬液),TBI+EU_BMSCs组经眶内静脉注射等量EU提取物(100 ng/ml)预处理14 d的GFP转基因小鼠来源BMSCs。Sham surgery组接受除TBI手术及细胞注射移植以外的其他操作。TBI术前1 d和术后1、3、7、10、14、17、21、24、28 d通过转棒式疲劳仪和平衡木行走试验检测各组小鼠的运动功能。运动功能检测全部完毕后处死动物,取材脑组织进行IF染色(GFP和MAP2)。
1.2.2 细胞培养 自3月龄C57BL/6小鼠或GFP转基因小鼠股骨和胫骨髓腔吸取骨髓,在PBS中制成单细胞悬液,经200目筛网过滤、离心[TD-6M离心机,百典(上海)仪器设备,离心半径16 cm,1 500 r/min,5 min]、弃上清、红细胞裂解液孵育(2×106个细胞/ml,5 min)后,加入等量基础培养基(含10%胎牛血清和1%青链霉素的DMEM/F12)终止裂解,离心(1 500 r/min,5 min)、弃上清,以基础培养基培养于T75培养瓶(2×106个细胞/ml)。原代培养第4代细胞用于体外和体内实验。
细胞生长融合度=待测细胞覆盖率×100%
1.2.3 CCK-8检测 细胞以原培养基接种于96孔板(2×105个细胞/ml,200 μl/孔,每组8孔)继续培养48 h后,每孔加入20 μl CCK-8试剂,37℃孵育1 h,酶标仪读取450 nm吸光度值(A450)。
相对细胞存活率=待测孔A450/Control组A450均值×100%
1.2.4 IF染色 检测前将细胞接种于多聚赖氨酸包被盖玻片(1×105个细胞/ml,每组8复孔)继续培养48 h。细胞样本经4%多聚甲醛固定10 min、0.5% Triton X-100透化处理5 min、5% BSA-PBS封闭1 h后,以一抗(兔抗NEFL多克隆抗体或兔抗MAP2多克隆抗体)工作液(5% BSA-PBS 1:100稀释)4℃孵育过夜。样本经0.1% BSA-PBS洗涤、在暗室中依次孵育二抗(山羊抗兔IgG H&L Alexa Fluor 488)工作液(5% BSA-PBS 1:500稀释)1 h和DAPI工作液(1 μg/ml)5 min、封固于50%甘油-PBS后,以BX51荧光显微镜(Olympus,日本)采集图像。
将脑组织样本制备为5 μm冰冻切片。切片经甲醇固定10 min、5% BSA-PBS封闭1 h后,以一抗(兔抗MAP2多克隆抗体和小鼠抗GFP单克隆抗体)工作液(5% BSA-PBS 1∶100稀释)4℃孵育过夜。切片经PBS洗涤、在暗室中依次孵育二抗(山羊抗兔IgG H&L Alexa Fluor 594和山羊抗小鼠IgG H&L Alexa Fluor 488)工作液(均以5% BSA-PBS 1∶500稀释)1 h和DAPI工作液(1 μg/ml)5 min、封固于50%甘油-PBS后,以BX51荧光显微镜(Olympus,日本)采集图像。
1.2.5 qRT-PCR 以TRIzol试剂提取细胞样本总RNA。每样本取500 ng RNA以TaKaRa RNA PCR Kit Ver.3.0试剂盒逆转录合成cDNA,以TB Green Premix Ex Taq Ⅱ试剂盒在LightCycler®96 System(Roche,上海)中扩增cDNAs(反应体系及反应条件见试剂盒说明书;引物序列见表1)。以2-ΔΔCt方法分析数据[7]。以β-actin作为内参对照。

表1 引物序列
1.2.6 TBI模型手术 在10%水合氯醛麻醉(400 mg/kg)、脑立体定位仪固定下,对C57BL/6小鼠左侧皮层上方开5 mm骨窗,采用改良Allen重物坠落打击法制备中度TBI模型(重锤质量:10 g,下落高度:3 cm)。小鼠均损伤对侧肢体瘫痪、不能直线爬行,即表明TBI造模成功[8]。
1.2.7 运动功能检测 在转棒式疲劳仪试验中,记录每只小鼠在旋转轴(40 r/min)上停留时间。在平衡木行走试验中,记录小鼠通过平衡木(宽6.0 mm、长1.2 m、离地30.0 cm)时右后肢足失误次数。
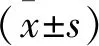
2 结果
2.1 EU提取物对BMSCs形态与增殖的影响 BMSCs贴壁生长,大多呈梭形、星形或多角形(图1a)。EU提取物处理14 d后,细胞形态无明显改变。暴露于EU提取物70 d后,细胞形态明显改变,多数细胞呈长梭形,细胞突起明显增多、延长,相邻细胞突起交互连接形成网络,部分细胞呈神经元样形态。EU提取物处理14 d后,相差显微镜图片量化分析显示,EU组细胞生长融合度显著高于Control组(P<0.001,图1a、b);CCK-8检测结果显示,EU组细胞存活率较Control组增加约50%(P<0.001,图1c)。
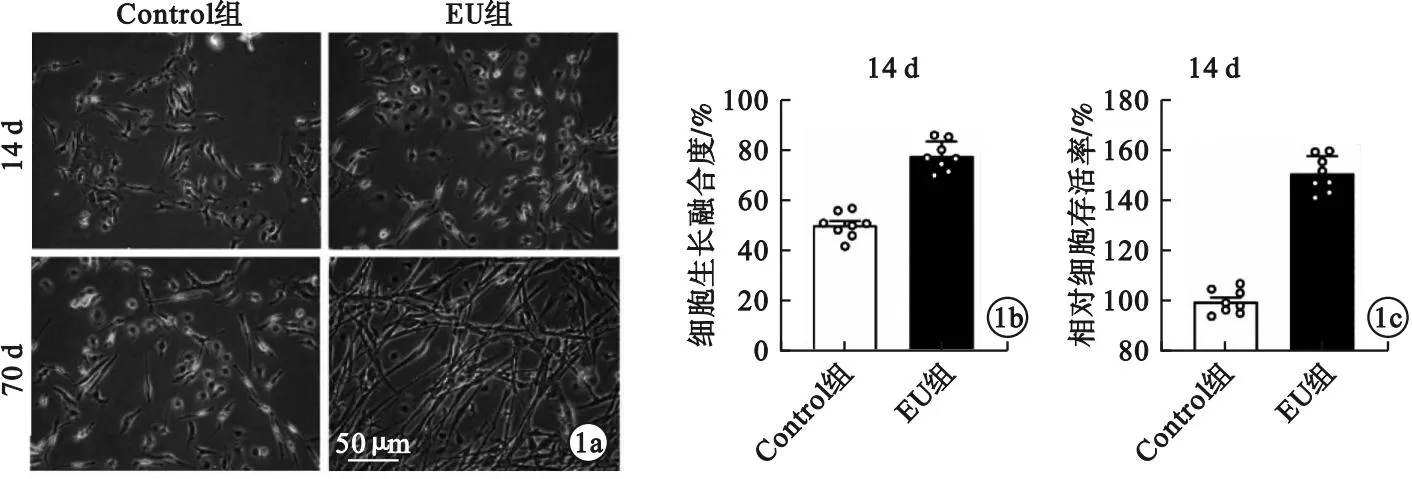
图1 EU提取物对BMSCs形态与增殖的影响[a.相差显微镜图片;b.细胞融合度分析,①P<0.001;c.细胞增殖CCK-8试验,①P<0.001]
2.2 EU提取物对BMSCs神经分化的影响 IF染色结果显示,EU提取物处理70 d后,EU组(65.05%±5.79%)细胞分化呈NEFL+(P<0.001,图2a、b),(70.31%±5.46%)细胞呈MAP2+(P<0.001,图2c、d),而Control组未检出NEFL+和MAP2+细胞。qRT-PCR检测结果显示,EU提取物处理14 d后,EU组未分化干细胞标记物Oct4和成熟神经元标记物Nefl转录水平较Control组未发生明显改变,而神经谱系分化特异性转录因子Neurod1和Ngf的表达量则明显高于Control组,差异均有统计学意义(P<0.001,图2e)。EU提取物处理70 d后,EU组Oct4 mRNA表达量低于Control组,而Nefl、Neurod1和Ngf转录水平高于Control组,差异均有统计学意义(P<0.001,图2f)。

图2 EU提取物对BMSCs神经分化的影响[a.NEFL的IF染色图像;b.NEFL+细胞比例定量分析,①P<0.001;c.MAP2的IF染色图像;d.MAP2+细胞比例定量分析,①P<0.001;e.EU提取物处理14 d后Oct4、Nefl、Neurod1及Ngf mRNA表达量qRT-PCR分析,①P<0.001;f.EU提取物处理70 d后Oct4、Nefl、Neurod1及Ngf mRNA表达量qRT-PCR分析,①P<0.001]
2.3 EU提取物对BMSCs移植治疗TBI小鼠运动障碍效能的影响 转棒式疲劳仪试验显示,与Sham surgery组小鼠比较,行TBI手术各组小鼠术后1 d转棒停留时间降至术前1/3,差异有统计学意义(P<0.001)。与TBI组比较,TBI+BMSCs组小鼠术后14~28 d转棒停留时间明显延长,差异有统计学意义(P<0.001)。TBI+EU_BMSCs组术后17~28 d转棒保持能力较TBI+BMSCs组进一步显著增强,差异均有统计学意义(P<0.001)。见图3a。平衡木行走试验显示,TBI+BMSCs组右后肢足失误次数在术后10~28 d显著少于TBI组,差异有统计学意义(P<0.05);TBI+EU_BMSCs组术后10~28 d通过平衡木时的足失误次数则较TBI+BMSCs组进一步减少,差异有统计学意义(P<0.001)。见图3b。
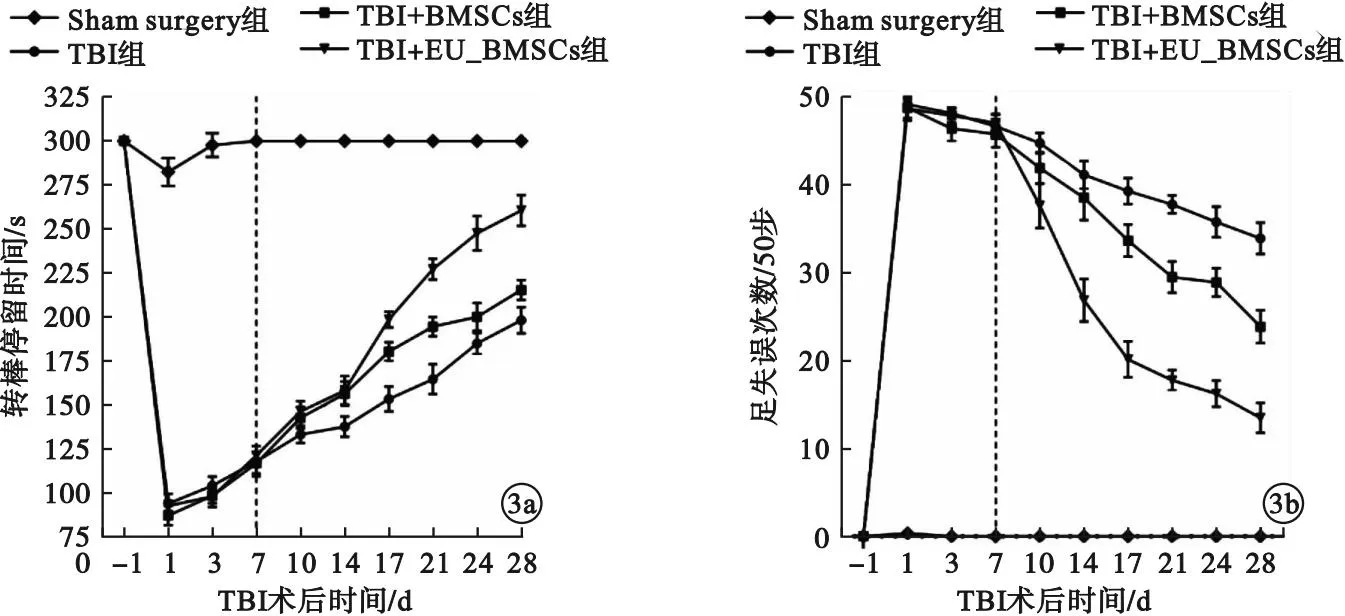
图3 EU提取物对移植BMSCs治疗TBI小鼠运动障碍效能的影响(a.转棒式疲劳仪试验;b.平衡木行走试验)
2.4 EU提取物对移植BMSCs在TBI小鼠脑组织损伤灶内迁移及分化的影响 IF染色显示,损伤28 d后,TBI组小鼠左侧运动-感觉皮层损伤灶内MAP2表达量显著低于Sham Surgery组,差异有统计学意义(P<0.001)。TBI+BMSCs组MAP2表达水平高于TBI组,差异有统计学意义(P<0.001);TBI+EU_BMSCs组MAP2表达量高于TBI+BMSCs组,但仍低于Sham Surgery组,差异均有统计学意义(P<0.001)。此外,TBI+EU_BMSCs组小鼠损伤灶内GFP+移植细胞含量及分化为MAP2+细胞的GFP+移植细胞比例均显著高于TBI+BMSCs组,差异均有统计学意义(P<0.001)。见图4。
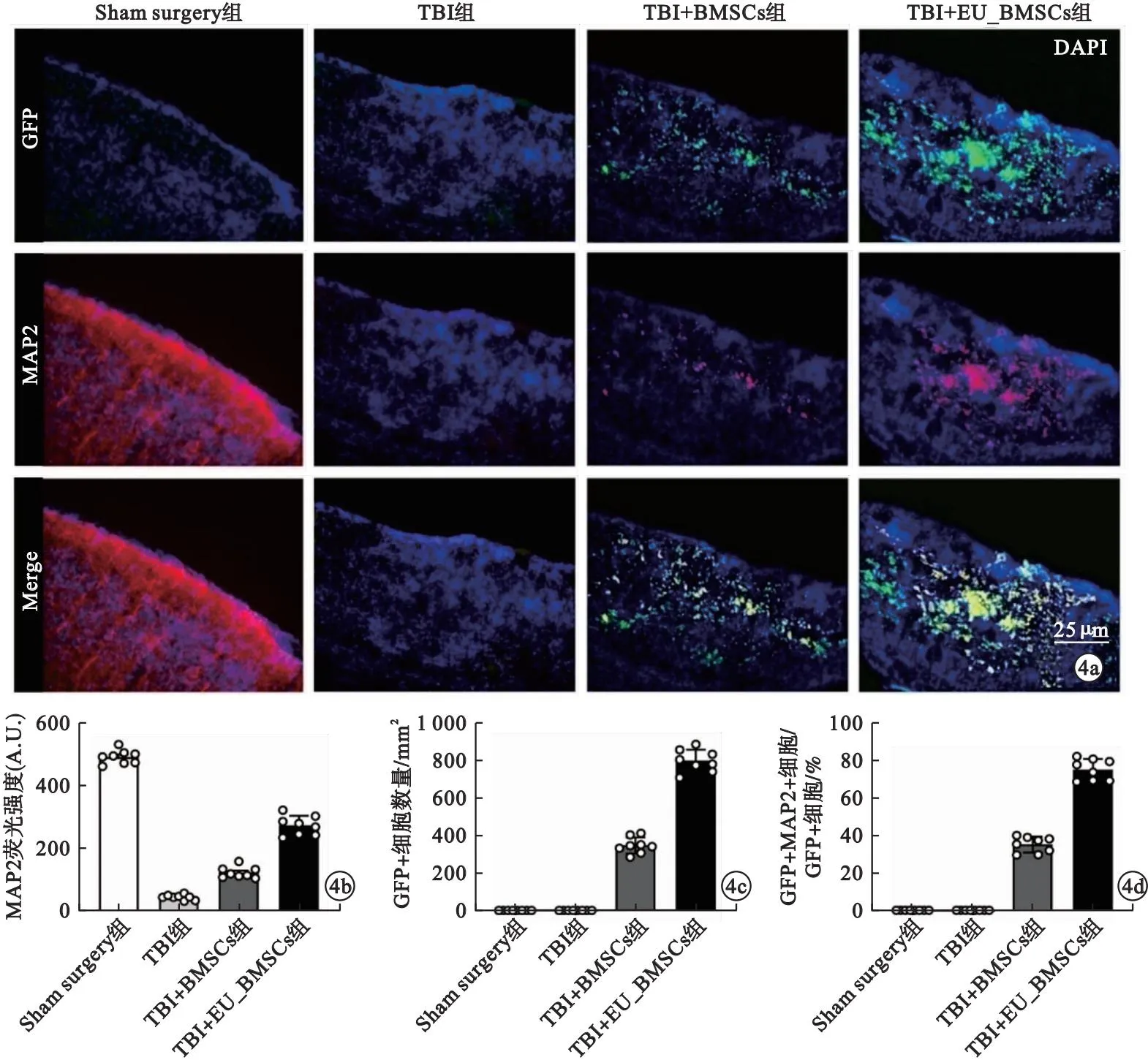
图4 EU提取物对移植BMSCs在TBI小鼠脑组织损伤灶内迁移及分化的影响[a.GFP与MAP2的IF双重染色图像;b.MAP2荧光强度定量分析;c.损伤灶内GFP+细胞含量定量分析;d.损伤灶内GFP+MAP2+细胞比例定量分析;①P<0.001]
3 讨论
神经元损失是TBI导致运动功能障碍的重要病理基础[9]。来源丰富、易于提取且具有神经分化潜能的BMSCs为TBI的自体移植细胞替代疗法带来希望[4,10]。然而,缺乏稳定高效的神经分化诱导方案是BMSCs移植治疗TBI的关键限制因素。有研究报道,EU具有调节中枢神经系统功能、促进中枢神经损伤修复的作用[5-6]。
既往研究表明,EU活性成分可以促进细胞增殖,本研究也发现EU提取物可以使BMSCs生长和增殖代谢活性显著提高[11]。同时,当EU提取物持续作用70 d后,原代BMSCs呈现确切的向神经元分化的迹象。这一变化说明,在EU提取物作用早期阶段,BMSCs表达谱即出现向神经分化发育转变的趋势,此时BMSCs可能已具备合成分泌Ngf等神经营养因子促进神经损伤修复、调控神经系统再生微环境的潜能[12-15]。因此,本研究选取EU提取物预处理14 d、具有旺盛增殖活性并在转录本水平呈现神经分化倾向和神经损伤修复潜能的BMSCs作为主要移植细胞。
在体实验中,本研究采用了转棒式疲劳仪和平衡木行走试验综合评估一侧皮层受损的TBI模型小鼠对侧肢体肌力和整体运动协调性的损伤和恢复情况[16-17]。结果显示,EU提取物预处理BMSCs治疗小鼠在两种运动试验中运动功能的改善程度明显高于一般BMSCs移植治疗小鼠。既往研究表明,损伤灶局部可能存在神经分化再生诱导微环境[18-19],本研究发现,经眶内静脉注射移植的GFP转基因小鼠来源BMSCs可向TBI小鼠皮层损伤灶内归巢迁移,并可在损伤灶内分化为MAP2+神经细胞。由于未治疗小鼠损伤灶内仅存一定数量的MAP2,治疗后TBI小鼠损伤灶内MAP2+神经细胞的恢复可能主要依赖于移植细胞分化。相较于一般BMSCs移植治疗小鼠[20-23],接受EU提取物预处理BMSCs移植治疗的TBI小鼠损伤灶内GFP+移植来源细胞明显增多,可能与移植细胞迁移归巢能力增强有关,另外也有可能得益于EU提取物的神经保护作用[24-25]。
综上所述,EU提取物处理可促进BMSCs向神经元分化,并显著提高BMSCs移植治疗TBI的效能。本研究结果可为基于BMSCs移植的TBI细胞移植治疗方案提供新思路和可靠的临床前研究依据。EU何种活性成分发挥诱导BMSCs神经分化的主导作用,EU预处理BMSCs移植可分化为何种递质类型功能性神经元、能否完全重建神经环路功能,仍有待进一步研究。

