猪UGT 1A1酶基因的克隆、表达及其对呕吐毒素特异性降解的作用
贺卫华 陈诗琪 王丽华 丁斓 翟晓虎 杨俊花

贺卫华,陈诗琪,王丽华,等. 猪 UGT 1A1 酶基因的克隆、表达及其对呕吐毒素特异性降解的作用[J]. 江苏农业学报,2023,39(8):1722-1728.
doi:10.3969/j.issn.1000-4440.2023.08.012
收稿日期:2023-03-21
基金项目:江苏农牧科技职业学院科研项目(NSF2023ZR06);第二批国家级职业教育教师教学创新团队课题研究项目(ZI2021100104)
作者简介:贺卫华(1982-),女,山西太谷人,硕士,副教授,主要从事动物毒理学研究。(E-mail)heweihua010@163.com
通讯作者:翟晓虎,(E-mail)zhaixiaohu010@163.com;杨俊花,(E-mail)yangjunhua303@126.com
摘要:为了在Sf9昆虫细胞中表达猪尿苷二磷酸葡萄糖醛酸转移酶(UGT) 1A1蛋白并对其进行功能鉴定。首先,合成密码子优化的 UGT 1A1 基因,克隆到载体pFastBacⅠ中,构建杆状病毒重组转移载体,然后导入DH10Bac中,获得重组的穿梭质粒,再转染Sf9细胞得到重组杆状病毒,采用Western blotting方法鉴定重组后 UGT 1A1蛋白的表达;对镍柱亲和层析纯化获得目的蛋白酶的动力学参数及其对呕吐毒素(DON)的代谢进行检测。结果表明:pFastBac-UGT 1A1 质粒被成功构建,导入感受态细胞DH10Bac中获得重组穿梭质粒Bacmid-UGT 1A1,再转染昆虫细胞Sf9获得重组Bacmid-UGT 1A1蛋白,能夠与多组氨酸标签单抗发生特异性反应。优化目的蛋白表达,并对其体外代谢DON进行了酶学性质和动力学参数的研究。本研究通过基因克隆、表达和代谢产物的分析等技术手段获得具有较好的生物活性且纯化的Bacmid-UGT 1A1蛋白,为揭示DON在肝脏中的代谢途径、代谢产物和关键调控因子提供参考。
关键词:呕吐毒素(DON);葡萄糖醛酸缀合物;尿苷二磷酸葡萄糖醛酸转移酶(UGT);猪肝脏
中图分类号:S852.23 文献标识码:A 文章编号:1000-4440(2023)08-1722-07
Expression and identification of porcine UGT 1A1 gene and its special effect of degradation for deoxynivalenol
HE Wei-hua1 CHEN Shi-qi1 WANG Li-hua1 DING Lan1 ZHAI Xiao-hu1 YANG Jun-hua 2
(1.Jiangsu Agri-animal Husbandry Vocational College, Taizhou 225300,China;2.Institute for Agri-food Standards and Testing Technology,Shanghai Academy of Agricultural Sciences, Shanghai 201403,China)
Abstract:To express the porcine uridine diphosphate glucuronosyltransferase (UGT) 1A1 protein in Sf9 insect cells and characterize its function, the codon-optimized UGT 1A1 gene was synthesized and cloned into pFastBacI vector to construct a recombinant baculovirus intermediate transfer vector. The vector was introduced into DH10Bac to obtain recombinant shuttling plasmid, which was used to transfect the Sf9 cells to get recombinant baculovirus. Expression of the recombinant UGT 1A1 protein was confirmed by Western blotting. Kinetic parameters of the target protease purified by nickel column affinity chromatography and its metabolism effect of deoxynivalenol (DON) were detected. The results showed that, the plasmid pFastBac-UGT 1A1was successfully constructed and was transducted into competent cells DH10Bac to obtain recombinant shuttling plasmid Bacmid-UGT 1A1. The recombinant shuttling plasmid was used to transfect Sf9 insect cells and obtained recombinant protein Bacmid-UGT 1A1, which was capable of taking specific reactions with His-tagged monoclonal antibodies. The optimal conditions for the target protein expression was screened, and the metabolism of DON in vitro was studied from the aspects of enzymatic properties and kinetic parameters. In this study, purified Bacmid-UGT 1A1 protein with good biological activities was obtained by technical methods such as gene clone and expression, analysis of metabolites, which provided references for revealing the metabolic pathways, metabolites and key regulatory factors of DON in the liver.
Key words:deoxynivalenol;glucuronic acid conjugate;uridine diphosphate glucuronosyltrans ferase (UGT);porcine liver
真菌毒素是在适宜的温度、湿度环境下,由真菌在粮食作物中产生的次级代谢产物,全球每年都因真菌毒素污染造成农产品及其加工制品质量降低,间接对畜禽和人类健康产生危害,每年造成的经济损失高达数百亿美元。联合国粮农组织统计发现,赭曲霉毒素、黄曲霉毒素、呕吐毒素(Deoxynivalenol,DON)等在农产品里检出率较高[1]。其中DON的污染不仅范围广而且频率高,在日常生产中危害极大。因此,探索DON在生物机体内的转化代谢、降解途径和控制代谢的关键因子对畜禽健康和其加工制品的生物安全性及保护人类健康安全具有重大意义。
DON属烯醇类化合物,其化学结构式中含有多个羟基,对细胞、肠道和肾脏等具有较强的毒性作用[2]。由于种属差异性,猪对DON的耐受性低[3]。以往有研究发现,DON在动物肠道或瘤胃中发生脱环氧作用并代谢产生脱环氧DON(DOM1)[4]。有研究结果表明,由尿苷二磷酸葡萄糖醛酸转移酶(UGT)催化的葡萄糖醛酸结合反应,是DON在肝脏内代谢的主要途径,代谢成为DON葡萄糖醛酸缀合物[5]。DON结构上的羟基结合葡萄糖醛酸后,亲水性大大增强,从而使生物机体更容易代谢和排泄DON。UGT基因存在多态性,已有研究发现,人肝脏有19种UGT亚型,如 UGT 1A1、UGT 1A3、UGT 2B7 和UGT 2B15 等[6],猪有 UGT 2B31、UGT 2B4、UGT 2A1、UGT 1AB3 等4种UGT亚型。有研究发现,由于UGT基因亚型不同,除去受生物年龄、种类和饮食方面的影响,不同基因亚型在机体中的表达也不同,以致于降解药物、毒素的效应也各不相同[7]。肝脏作为DON的主要解毒器官,在猪体内是如何将DON代谢为葡萄糖醛酸缀合物及哪种UGT酶起主要作用,还未见报道[8]。因此,本实验室前期通过猪原代肝脏细胞培养,攻DON毒后发现猪 UGT 1A1 表达量高。基于此,本试验拟通过质粒构建、Bac-to-Bac重组表达系统完成猪肝脏中 UGT 1A1 的克隆表达[9],再通过超高效液相色谱-串联质谱(UPLC-MS/MS)[10-11]等技术分析DON的葡萄糖醛酸代谢物来充分验证关键酶的功能。本研究旨在探索猪体内真菌毒素DON降解的途径,挖掘潜在的降解酶及其功能,为后期靶向性开发DON高效脱霉剂、保障中国畜牧业养殖安全提供基础数据和新思路。
1 材料与方法
1.1 材料与试剂
DON标准品购自青岛普瑞邦生物工程有限公司;PCR试剂盒、限制性内切酶和DNA连接酶等购自宝生物工程(大连)有限公司;DMEM培养基和胰酶等购买于赛默飞世尔科技公司;组氨酸标签(His-tag)抗体购买于生工生物工程(上海)股份有限公司;质粒提取和胶回收试剂盒、Trizol试剂购买于天根生化科技有限公司;pFastBacTM 1购买于赛默飞世尔科技公司;Sf9细胞由上海市农业科学院动物传染病预防与生物技术研究课题组提供。
本研究所用的主要仪器有:电泳凝胶成像系统,购自上海天能生命科学有限公司;微量紫外分光光度计,购自北京鼎国昌盛生物技术有限责任公司;蛋白质电泳仪、PCR仪、核酸检测仪和多功能荧光酶标仪购自伯乐生命医学产品(上海)有限公司;细胞培养箱购自赛默飞世尔科技公司;显微镜购自奥林巴斯(中国)有限公司;漩涡振荡器购自艾卡(广州)仪器设备有限公司;恒温混匀器和超低温冰箱购自艾本德(上海)国际贸易有限公司;电子天平购自梅特勒-托利多仪器(上海)有限公司等。
1.2 引物设计和目的基因的扩增
根据NCBI(美国国立生物技术信息中心)已有猪 UGT 1A1 的基因序列,设计与合成引物。用实验室保存的新鲜猪原代肝细胞cDNA进行基因扩增。上游引物:5′-CATGTTGCTGGTGAACCAGAGCCACCAGGGCTT-3′,设计增加Bam HⅠ的酶切位点(用于酶切)以及包含ATG的起始密码子;下游引物:5′-CGCTAGTGGGTCTTGCTCTTGTGGCTCTTCT-3′,在终止密码子前加入连续编码6个组氨酸的序列以及HindⅢ的酶切位点用于酶切。PCR的总扩增体系为50 μl:上下游引物各2 μl,2 μl DNA模板,Premix Primes STAR HS高保真酶体系25 μl,最后用ddH2O补充到50 μl。扩增程序:94 ℃保持5 min;94 ℃保持15 s,56 ℃保持35 s,72 ℃保持1 min,完成30个循环;72 ℃延伸8 min。使用1%凝胶对PCR产物进行电泳,并由生工生物工程(上海)股份有限公司测序,待用。
1.3 重组pFastBac-UGT 1A1质粒的构建
在37 ℃条件下,用Bam H I及HindⅢ對目的基因和转移载体质粒pFastBacⅠ双酶切2 h,产物通过DNA胶回收。载体pFastBacⅠ片段与目的基因片段在DNA连接酶作用下,4 ℃连接过夜,转化感受态细胞JM109。采用具有氨苄抗性的LB固体培养基进行筛选,挑选若干单个菌落,用特异性引物进行PCR扩增(方法同1.2),小量提取质粒。对阳性克隆提取质粒后进行Bam H I和Hind Ⅲ双酶切鉴定、测序,检验插入位置和序列的正确性,其中完整的被命名为pFastBac-UGT 1A1。
1.4 重组穿梭质粒Bacmid-UGT 1A1 的构建及鉴定
按Bac-to-Bac表达系统的操作说明,用5 μl的pFastBac-UGT 1A1 转化感受态细胞DH10 Bac。在摇床上37 ℃培养4 h。将培养液倍比稀释,选取适当的2个浓度的菌液涂布在LB筛选培养基[包含质量浓度为10 μg/ml的庆大霉素、50 μg/ml的卡那霉素、7 μg/ml的四环素、40 μg/ml的IPTG(异丙基-β-D-硫代半乳糖苷)和200 μg/ml的X-Gal(5-溴-4-氯-3-吲哚-β-D-半乳糖苷)]上,37 ℃倒置培养48 h。挑取白色单菌落再次培养,接种到LB液体培养基中,37 ℃过夜。提取重组质粒Bacmids,并用引物(MF:5′-GTTTTCCCAGTCACGAC-3′,MR:5′-CAGGAAACAGCTATGAC-3′)进行PCR验证。20.0 μl反应体系:2×Taq 10.0 μl,上下游引物各0.8 μl,0.5 μl Bacmids, ddH2O 7.9 μl。扩增程序: 94 ℃保持5 min;94 ℃保持20 s,56 ℃保持15 s,72 ℃保持5 min,循环30次;最后72 ℃延伸5 min。成功的重组穿梭质粒被命名为Bacmid-UGT 1A1。
1.5 重组杆状病毒的获得
依据试剂盒Cellfectin Ⅱ Reagent的说明书,在Sf9细胞处于对数生长期时转染Bacmid-UGT 1A1 ,同时设置染毒组Sf9细胞作为阴性对照,28 ℃培养约72 h,细胞出现明显病变时,收获P1代杆状病毒,继续传代,获得P2和P3代的重组杆状病毒毒株。提取基因组DNA,用方法1.4中的引物扩增,完成重组杆状病毒的鉴定。
1.6 重组蛋白质的表达及鉴定
调节Sf9细胞数为1 ml 1.0×106,将P3代Bacmid-UGT1A1 接种于其中,28 ℃悬浮培养72.0 h,约80%细胞出现病变时,收集细胞。取培养液,低速(300 r/min)离心15 min,分离上清液和细胞,收集沉淀细胞,用含蛋白酶抑制剂的昆虫活性蛋白抽提试剂裂解细胞,3×105 g离心后,用镍亲和层析柱进一步纯化蛋白质。先进行蛋白质电泳,转染PVDF(聚偏二氟乙烯)膜,用含量为5%的脱脂奶粉封闭1.0 h,一抗用鼠抗His(1∶2 500,稀释度)4 ℃孵育过夜,二抗为羊抗鼠抗体(1∶2 500,稀释度)室温培养1.5 h,用DAB(二氨基联苯胺)试剂盒显色,检测表达蛋白质的准确性。
1.7 重组酶动力学参数测定及对DON的降解分析
1.7.1 重组酶动力学参数测定 精密量取不同浓度的DON溶液加入到最佳酶浓度的重组酶蛋白稀释液中,选定最大激发波长410 nm,在酶标仪上对空白Sf9蛋白液和含DON的Sf9蛋白液中的孵育液进行扫描。其中底物浓度分别为2 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L、50 μmol/L、100 μmol/L、200 μmol/L,重组酶质量浓度为1 g/L,37 ℃预孵育5 min,加入启动剂NADP/NADPH(还原型辅酶Ⅰ/还原型辅酶Ⅱ)反应,24 h后加400 μl含一定量内标DON的乙酸乙酯液终止反应,涡旋90 s混匀,6 000 r/min离心10 min,去除上清液后用氮气吹干;样品用100 μl流动相复溶,涡旋90 s混匀后13 000 r/min离心15 min,取上清液20 μl进行超高效液相色谱-串联质谱分析,测定底物DON的剩余量和DON-3-Glu的生成量,每个底物浓度做3管平行试验。按Lineweaver Burk双倒数作图法求得Km(酶在达到最大反应速度一半时的底物浓度)和Vmax(酶的最大反应速度),并根据公式计算清除率(CLint): CLint=Vmax/Km×100%。
1.7.2 LC-MS/MS方法检测培养液中DON和DON-3-GlcA 提取方法:DON染毒培养Sf9细胞24 h后,2 000 r/min离心收集1.0 ml上清液于1.5 ml离心管,取400 μl的上清液加入1.2 ml的甲醇溶液,漩涡30 s加速溶解,冰浴超声40 min后,12 000 g离心10 min,取上清液,置于冻干机中。加60 μl 1%甲酸水溶液复溶,再次于4 ℃、12 000 g离心10 min。取上清液,用0.22 μm膜过滤,待上机分析。
色谱条件。(1)色谱柱:XBridge BEH-C18柱(100.0 mm×3.0 mm,2.5 μm)。(2)流动相:A相为甲醇,B相为5 mmol/L乙酸铵溶液。(3)梯度洗脱程序:0~1.0 min,10% A;1.0~6.5 min,10%~90% A;6.5~6.7 min,90%~10% A;6.7~8.0 min,10% A;再保持平衡2.0 min,总运行时间为10.0 min,流速0.4 ml/min;进样量3 μl;柱温40 ℃[1]。
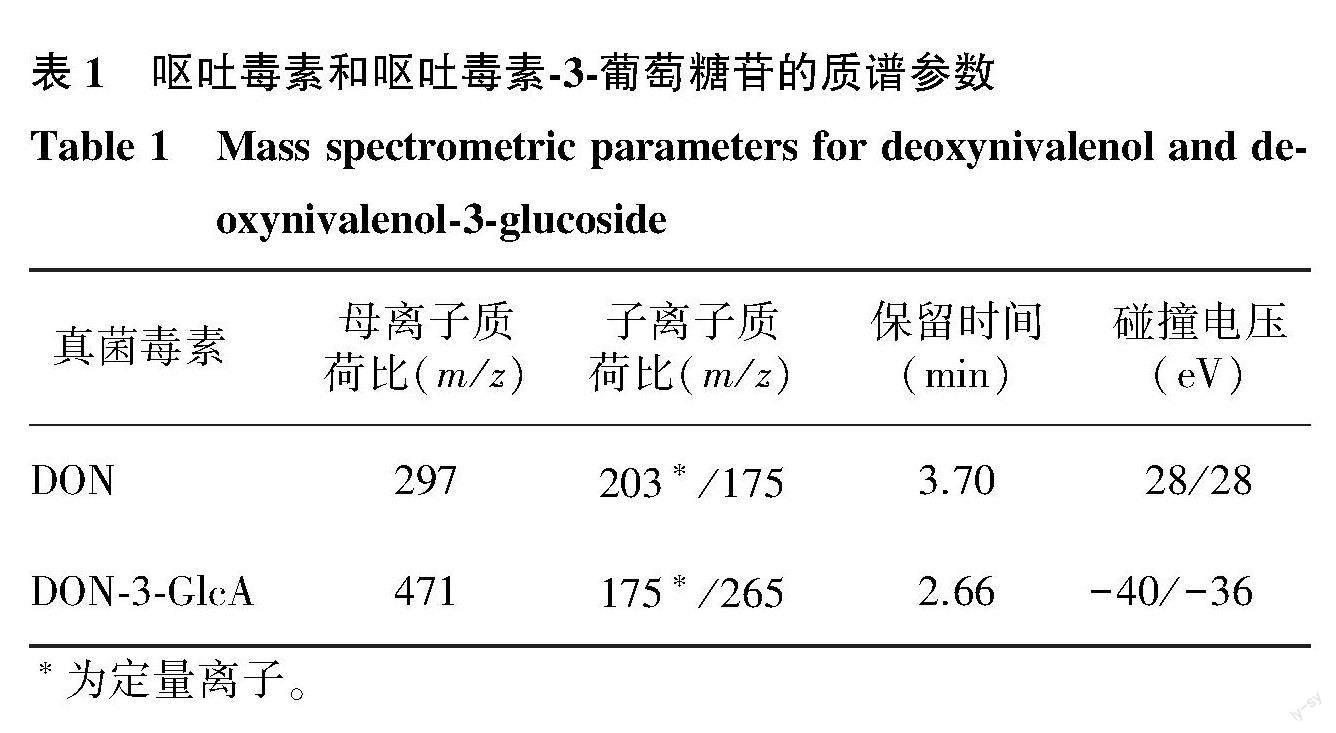
质谱条件:采用电喷雾电离 (Electron spray ionization,ESI)正负离子模式同时扫描;正负离子喷雾电压:5 500 V和4 500 V;去簇電压96 V;射入电压8 V;射出电压12 V;雾化温度:500.0 ℃;雾化和辅助气均选用高纯空气,其中雾化气为10 342.14 Pa,辅助气为17 236.89 Pa;碰撞气为高纯氮气:55 158.06 Pa;喷雾电压气帘气:2.41×105 Pa;通过多反应监测(Multiple reaction monitoring,MRM)模式对目标化合物进行峰值积分和数据分析[11]。表1为2种毒素的质谱参数。
2 结果与分析
2.1 猪 UGT 1A1 基因的PCR扩增及测序
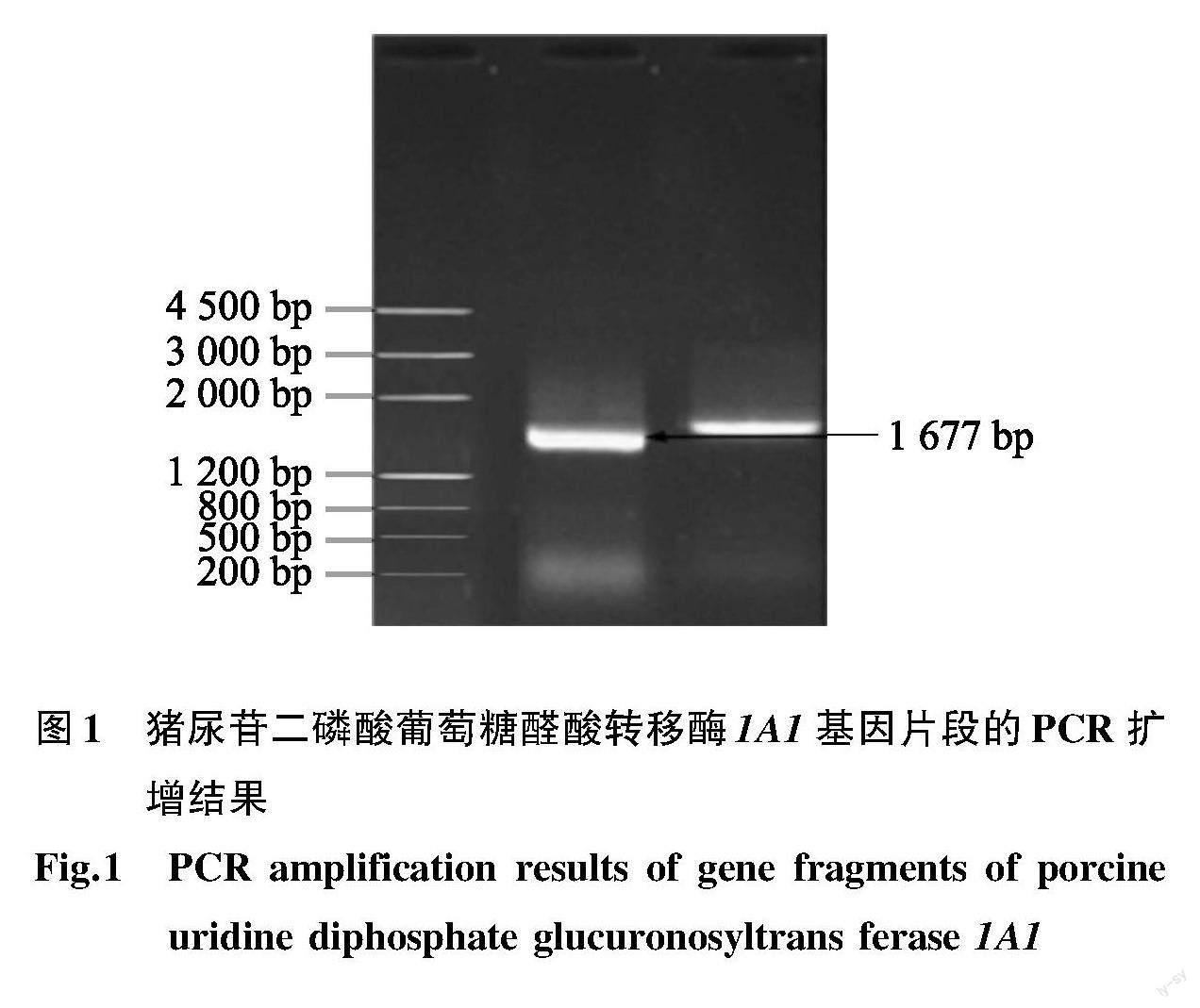
经1%琼脂糖凝胶电泳后观察PCR扩增产物,在约1 677 bp左右的位置出现1条与猪肝脏 UGT 1A1 片段预期大小一致的条带(图1)。
2.2 pFastBac-UGT 1A1的鉴定
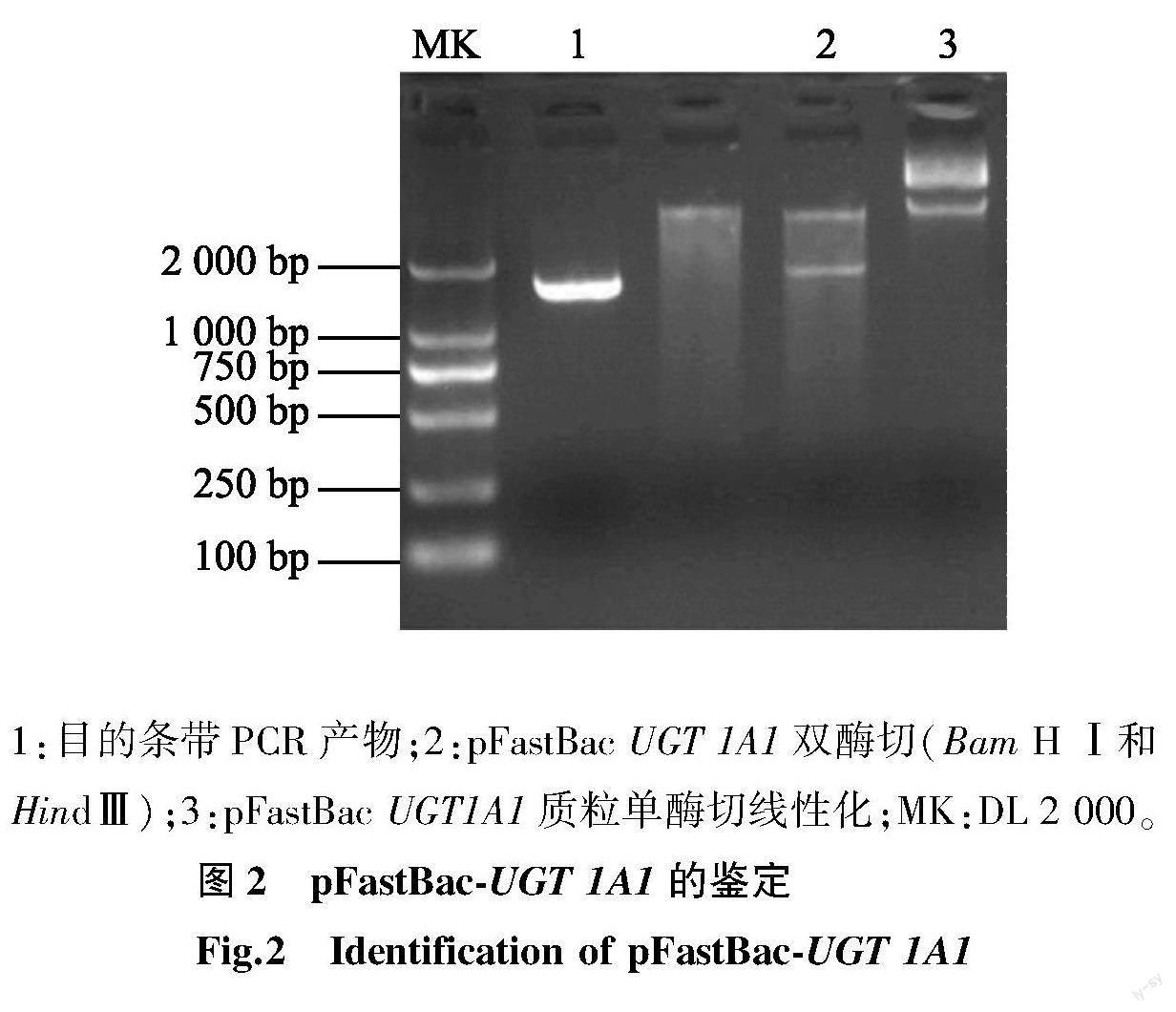
经PCR分析和电泳鉴定,检测出长约1 677 bp的1条特异性条带;经内切酶Bam H Ⅰ、HindⅢ双酶切后,电泳结果呈现2条带,其中1条为载体,约5 200 bp,另外1条为目的条带,约1 677 bp,与预期结果一致。结果(图2)表明,目标基因的序列正确,成功构建了pFastBac-UGT 1A1 的重组质粒。
2.3 重组穿梭质粒Bacmid-UGT 1A1 的鉴定
图3显示,采用方法1.4的引物,以Bacmid-UGT 1A1 的DNA为模板完成PCR扩增。扩增结果与预测的结果一致,在大约4 000 bp的地方呈现1条特异性的DNA片段。
1~5:PCR产物;MK:DL5000 plus DNA标记。
2.4 蛋白质表达结果的检测
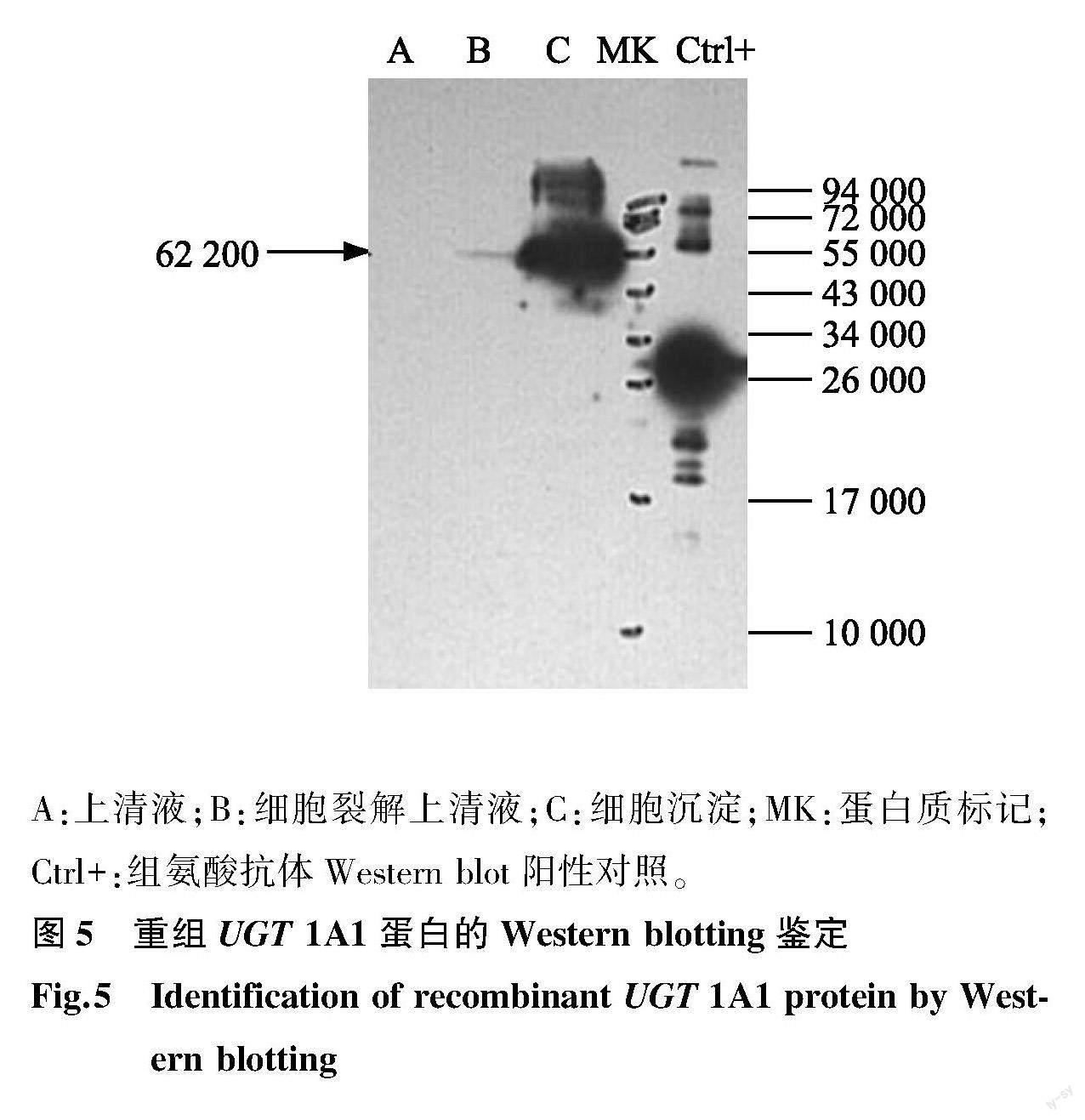
感染Sf9细胞72 h后,收集上清液,浓缩,用镍亲和层析柱进行纯化,完成蛋白质电泳十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)(图4)。转膜后进行抗体反应,在62 200处出现1特异性条带(图5),与预测大小一致。并且 UGT 1A1蛋白主要在Sf9昆虫细胞内表达。
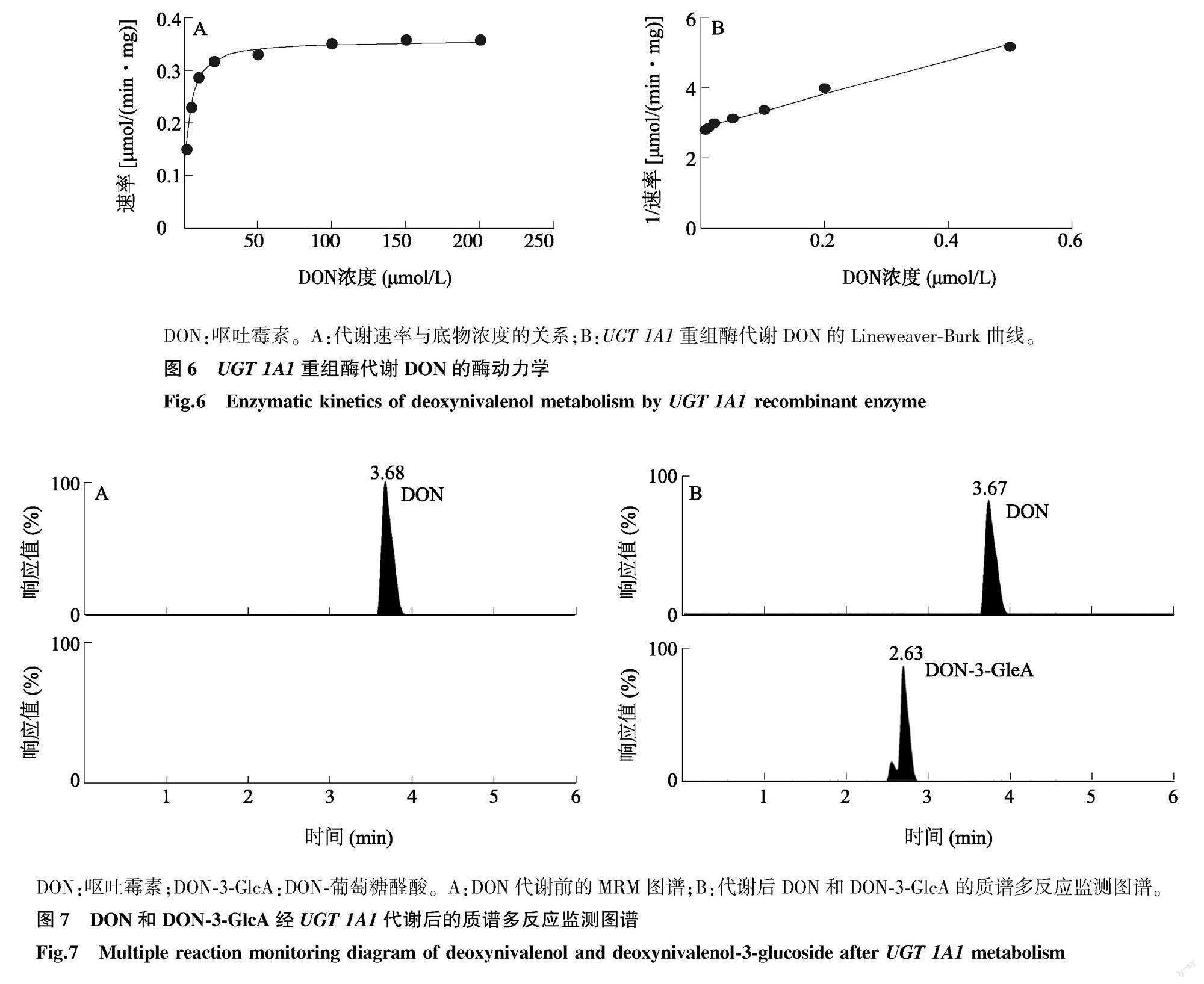
2.5 UGT 1A1 重组酶动力学参数分析
UGT 1A1 重组酶动力学参数采用Lineweaver-Burk法作图。结果(图6)表明,不同DON浓度培养条件下,Lineweaver-Burk曲线呈良好的线性关系(R2=0.99),说明试验条件下 UGT 1A1 重组酶对DON的代谢反应符合米氏方程。推算分别得到 UGT 1A1 酶对DON的Km=(2.71±0.29)μmol/L,Vmax=(0.359 5±0.006 4) μmol/(min·mg) ,CLint=0.132 7 L/(min·mg)。
DON:呕吐霉素。A:代谢速率与底物浓度的关系;B:UGT 1A1 重组酶代谢DON的Lineweaver-Burk曲线。
2.6 DON和DON-3-GlcA的LC-MS/MS分析结果
图7为DON经 UGT 1A1 培养液代谢后的MRM图谱,可见DON和DON-3-GlcA 2种物质色谱峰形较好且响应强度高。推测DON在 UGT 1A1 的作用下可代谢为DON-3-GlcA,降解率为45%。
DON:呕吐霉素;DON-3-GlcA:DON-葡萄糖醛酸。A:DON代谢前的MRM图谱;B:代谢后DON和DON-3-GlcA的質谱多反应监测图谱。
3 讨 论
UGT是在内质网膜和核膜上催化Ⅱ相代谢途径,是真菌毒素葡萄糖醛酸结合反应的超家族基因。 UGT 1A和UGT 2B 亚家族的成员在终止生物作用和亲脂性药物的消除方面起着关键作用。这些酶主要催化源自辅因子尿苷二磷酸(UDP)-葡萄糖醛酸的葡萄糖醛酸,同样,也可以催化具有共价连接的合适受体官能团的底物,这个过程被称为葡萄糖醛酸化[12]。体内一般脂溶性物质的代谢主要通过这一反应,如内源性物质、胆红素、类固醇等的降解过程[13-16]。前期研究发现DON主要在肝脏中被UGT催化,通过Ⅱ相代谢途径发生葡萄糖醛酸结合反应而被迅速排出体外,降低其毒性作用。而UGT基因家族有多个亚型,在猪体内主要发现的UGT亚型包括 UGT 2B31、UGT 2B4、UGT 2A1、UGT 1AB3 4种,这些亚型基因在真菌毒素体内代谢中的作用、解毒效应和代谢途径各不相同。本研究在前期工作基础上探索催化DON在猪肝细胞中发生葡萄糖醛酸化的 UGT 1A1 关键亚型基因。
目前重组构建技术可以使对体外培养试验中基因变化的观察更为直观,Bac-to-Bac 表达系统和传统的同源重组相比可以更快速地产生重组杆状病毒和同时进行大量重组目的蛋白鉴别,该表达系统主要包括合适的pFastBac菌体和DH10Bac感受态细胞及1个可以控制表达的质粒,通过感染细胞能形成重组杆状病毒[17]。 pFastbac 1的特点是表达水平高、启动子部位富含AcMNPV聚乙烯(PH),可用于简单的大量克隆[18]。为探索猪体内Ⅱ相代谢途径发生葡萄糖醛酸结合反应的关键 UGT 1A1 酶基因,本研究通过合成 UGT 1A1 基因,将目的基因克隆至pFastbac 1杆状病毒载体上,然后转化pFastbac-UGT 1A1 质粒至DH10bac感受态,制备Bacmid(杆粒),Sf9细胞被Bacmid转染后得到子代的病毒可获得大批量目的蛋白,Anti-His Western blot检测和放大转染、表达检测的结果一致,显示获得的蛋白质中 UGT 1A1 基因表达。通过UPLC-MS/MS分析DON代谢产物发现,DON在猪肝细胞中通过 UGT 1A1 酶的催化作用代谢为DON-3-葡萄糖醛酸,提示猪肝细胞中DON葡萄糖醛酸反应关键UGT酶基因 UGT 1A1 具有重要作用。
由于真菌毒素污染在畜禽日常生产中难以避免和降解,研究促进真菌毒素在机体内更快消除代谢的关键因子和调节机制具有重大意义。本研究发现,DON在猪肝细胞中通过Ⅱ相代谢途径发生葡萄糖醛酸结合反应的关键UGT酶基因是 UGT 1A1 ,后续或许可能通过对 UGT 1A1 基因结构进行突变诱导等处理,提高毒素转化代谢及降解效率,为后期饲料中DON脱毒剂开发研究和畜禽制品食品安全监督等提供参考。
参考文献:
[1] 贺烨宇,杨 华,杨伟康,等. 谷物及其制品中真菌毒素污染和管控策略研究[J]. 浙江农业科学,2023,64(1):1-8.
[2] YAO Y Z, MIAO L. The biological detoxification of deoxynivalenol: a review[J]. Food Chem Toxicol,2020,145:111649.
[3]PIERRON A, ALASSANE-KPEMBI I, OSWALD I P. Impact of two mycotoxins deoxynivalenol and fumonisin on pig intestinal health[J]. Porcine Health Manag,2016,2:21.
[4]SUN Y, JIANG J, MU P Q, et al. Toxicokinetics and metabolism of deoxynivalenol in animals and humans[J]. Arch Toxicol,2022,96(10):2639-2654.
[5]MAUL R, WARTH B, KANT J S, et al. Investigation of the hepatic glucuronidation pattern of the fusarium mycotoxin deoxynivaleno in various species[J]. Chem Res Toxicol,2012,25(12):2715-2717.
[6] MACKENZIE P I, BOCK K W, BURCHELL B, et al. Nomenclature update for the mammalian UDP glycosyltransferase (UGT) gene superfamily[J]. Pharm Genom,2005,15(10):677-685.
[7]GUILLEMETTE C, LVESQUE E, HARVEY M, et al. UGT genomic diversity: beyond gene duplication[J]. Drug Metab Rev,2010,42(1):24-44.
[8]SCHWARTZ-ZIMMERMANN H, HAMETNER C, NAGL V, et al. Glucuronidation of deoxynivalenol (DON) by different animal species: identification of iso-DON glucuronides and iso-deepoxy-DON glucuronides as novel DON metabolites in pigs, rats, mice, and cows[J]. Arch Toxicol,2017,91(12):3857-3872.
[9]LU B J, TANG Q, WANG Q Y, et al. Recovery infectious enterovirus 71 by Bac-to-Bac expression system in vitro and in vivo[J]. Front Microbiol,2022,13:825111.
[11]LATTANZIO V M, SOLFRIZZO M, DE GIROLAMO A, et al. LC-MS/MS characterization of the urinary excretion profile of the mycotoxin deoxynivalenol in human and rat[J]. J Chromatogr B,2011,879:707-715.
[12]FAN K, XU J J, JIANG K Q, et al. Determination of multiple mycotoxins in paired plasma and urine samples to assess human exposure in Nanjing, China[J]. Environmental Pollution,2019,248:865-873.
[13]ROWLAND A, MINERS J O, MACKENZIE P I. The UDP-glucuronosyltransferases: their role in drug metabolism and detoxification[J]. Int J Biochem Cell Biol,2013,45(6):1121-1132.
[14]BARBIER O,TROTTIER J,KAEDING J,et al. Lipid-activated transcription factors control bile acid glucuronidation[J]. Mol Cellbio Chem,2009,326(1):3-8.
[15] GALL W E, ZAWADA G, MOJARRABI B, et al. Differential glucuronidation of bile acids, androgens and estrogens by human UGT1A3 and 2B7[J]. J Steroid Biochem Mol Biol,1999,70(1/2/3):101-108.
[16]ZENG W, LIU X, WU Y, et al. Dysregulated hepatic UDP-glucuronosyltransferases and flavonoids glucuronidation in experimental colitis[J]. Frontiers in Pharmacology,2022,13:1053610.
[17]薛慶凯,黄玉政. 尿苷二磷酸葡萄糖醛酸转移酶在肝脏疾病中的作用及其转录调控机制[J]. 热带病与寄生虫学,2022,20(1):36-42.
[18]VAN OERS M M, PIJLMAN G P, VLAK J M. Thirty years of baculovirus-insect cell protein expression: from dark horse to mainstream technology[J]. J Gen Virol,2015,96(1):6-23.
(责任编辑:陈海霞)

