奶牛乳源外泌体提取方法的优化及效果评价
赵 莹 王靖雷 王 萌 王立斌,2 张 倩 李志杰 马 鑫 余四九,2 潘阳阳,2*
(1.甘肃农业大学动物医学院,兰州 730070;2.甘肃省牛羊胚胎工程技术研究中心,兰州 730070 )
外泌体是一种外形呈圆形或椭圆形,有部分凹陷,样似“茶托”形,介于30~200 nm双层膜结构的纳米级细胞外囊泡[1]。外泌体是由活细胞内出芽方式分泌产生形成的内吞小体,并以胞吐方式释放到细胞间隙,当受体细胞接收后发挥作用,从而达到细胞间信息交流[2]。外泌体可存在于机体大部分体液中,如乳液、唾液、羊水、腹水、血液、尿液、脑脊液等[3],且免疫系统细胞、脂肪细胞、肿瘤细胞、内皮细胞、间质细胞、肥大细胞、成纤维细胞等许多细胞均可分泌外泌体[4]。外泌体由脂质、蛋白质和核酸(DNA、mRNA、miRNA、lncRNA、circRNA等)组成[5],因有脂质双分子层保护,可稳定存在。
荷斯坦奶牛乳中含丰富外泌体[6],由乳腺上皮细胞分泌产生,并包裹蛋白质、核酸、聚糖、脂质等具有生物活性的内含物,内含物被受体接收后进行细胞间信息传递、细胞传递、血管新生、免疫应答、炎症反应、抗氧化、肿瘤细胞生长等[7]。Munagala等[8]研究发现,乳源外泌体可作为药物载体达到靶向治疗作用;Hock等[9]研究发现,乳源外泌体可提高肠道上皮细胞活力,促进细胞增殖并刺激肠道干细胞活性的提高,用乳源外泌体给药可防止坏死性结肠炎发生;Samuel等[10]研究发现,乳源外泌体富含与免疫应答和生长有关的蛋白质,通过调节这些蛋白质可调节机体免疫机能和生长修复;骆驼乳来源外泌体可抑制乳腺肿瘤细胞生长[11];牦牛乳源外泌体可提升细胞抗低氧能力[12];Li等[13]研究发现,乳源外泌体可作为包封亲水性大分子药物并口服的载体,可见开发乳源外泌体具有重要的生物学和商业价值,虽通过细胞培养也可收集到大量外泌体,但操作过程耗时费力,需要特殊设备,成本高,获取量少且质量不稳定,不适用于用量大的试验研究。因此,众多试验通过建立不同的技术方法,从乳汁中分离提取大量外泌体。
目前已知外泌体可通过差速超速离心法、化学沉淀法、蔗糖密度梯度离心法、超滤分离法、尺寸排阻色谱法、免疫亲和法、微流控法和其他商业试剂盒等提取方法得到。超滤分离法主要通过滤膜孔径不同来分离外泌体,该方法操作简单、耗时短,且保证外泌体生物活性,但易堵塞滤膜,与外泌体同等大小的蛋白质杂质与之混杂,且过膜压力会对外泌体造成机械性损伤,导致分离纯度低,因此仅适用于尿液、细胞培养液等的外泌体提取;尺寸排阻色谱法是通过固定相多孔凝胶孔径大小分离外泌体,方法简单高效,纯度高且色谱柱可重复使用,但操作耗时费力,需要特殊设备,成本高且获取量少,且存在高密度脂质颗粒,不适用处理大量样品及乳源外泌体的试验研究;免疫亲和法是通过外泌体表面蛋白抗原与抗体特异性结合来分离外泌体,该方法操作简单,特异性高,可保证外泌体的完整,但效率低,特异性抗体贵且易受其他因素影响;微流控法是通过控制微通道中流体行为来分离外泌体,该方法耗时短,纯度高,常在医学领域使用,但目前未见其在乳源外泌体研究中的应用;不对称流场流分馏法通过分流技术分离大尺径范围内样品,如聚合物、蛋白质、脂质等,该方法获取外泌体较完整,但耗时长,设备昂贵[14]。综上所述,仍需通过比较不同外泌体提取方法的优缺点,结合乳汁特性,挖掘高效稳定的乳源外泌体提取方法。
牛乳含大量酪蛋白,提取外泌体较其他组织困难。乳源外泌体分离常使用差速超速离心法、蔗糖密度梯度离心法和化学沉淀法,但前人发现,差速超速离心法、凝乳酶法、乙酸法和蔗糖密度梯度离心法都存在提取数量少、纯度低、步骤复杂、耗时长、过程外泌体损伤等问题,本试验通过改变乙酸或凝乳酶用量、调整蔗糖密度梯度,减少离心步骤先将4种提取方法进行优化,并通过透射电子显微镜(TEM)、纳米粒子跟踪分析(NTA)、蛋白浓度检测(BCA)、免疫印迹(WB)方法鉴定提取到的乳源外泌体,比较分析每种优化后提取乳源外泌体方法的优缺点,旨在确定最佳提取乳源外泌体的方法,为进一步研究奶牛乳源外泌体生物功能及应用提供新的理论基础。
1 材料与方法
1.1 试验材料及样品采集
选用甘肃省兰州市某奶牛场20头4~5岁龄、4~6胎次、处于泌乳期且无乳房炎的健康荷斯坦奶牛,在收集牛奶之前,用温水清洗乳房和酒精彻底擦拭。用无菌瓶采集乳汁样本,并将其混匀,用冰袋快速带回实验室,储存于-80 ℃冰箱。
1.2 乳源外泌体提取方法的优化
参照前人提取方法,对其中各项参数进行优化,达到减少操作步骤和时间,快速提取到大量杂蛋白少、纯度高的外泌体。乳源外泌体提取过程均在无菌环境下进行,每种提取方法均先将200 mL荷斯坦奶牛乳从-80 ℃冰箱取出,于25 ℃恒温水浴锅解冻。每种乳源外泌体主要优化超高速离心前的乳清提取步骤。
1.2.1 差速超速离心法的优化
优化前,差速超速离心法[15](多步离心)乳清提取需3步:①全脂牛奶离心10 min(300×g,4 ℃)取上清;②上清液离心10 min(2 000×g,4 ℃)取上清;③上清液离心30 min(10 000×g,4 ℃)取上清。
优化后,差速超速离心法乳清提取只需1步,原奶离心30 min(16 500×g,4 ℃)取上清,除去细胞、蛋白质、脂肪等,再超高速离心取沉淀,使用0.45 μm过滤器过滤,转移乳清至超速离心管中;再离心120 min(120 000×g,4 ℃)除上清液,用磷酸盐缓冲溶液(PBS)重悬收集达到清洗作用;使用0.22 μm过滤器过滤除去细菌、凋亡小体和聚集囊泡,超高速离心60 min(120 000×g,4 ℃)除上清液,用100 μL PBS重悬收集外泌体;转移至无菌离心管中,立即使用或-80 ℃储存用于进一步试验。
1.2.2 凝乳酶法的优化
优化前,1)凝乳酶法[16](添加乙酸)乳清提取需6步:①全脂牛奶离心15 min(277×g,4 ℃)取上清,重复2次;②上清液中添加10%乙酸溶液,将pH调至6;③加入0.035 mg/mL凝乳酶(NaCl溶液溶解),37 ℃水浴30 min;④加上清液中,37 ℃水浴30 min;⑤离心30 min(9 983×g,4 ℃)取上清;⑥上清液离心60 min(9 983×g,4 ℃)取上清。2)凝乳酶法[17](孵育6 h)乳清提取需4步:①全脂牛奶离心30 min(8 000×g,4 ℃)取上清;②上清液离心60 min(13 200×g,4 ℃)取上清;③上清液添加凝乳酶0.025 g/L;④37 ℃孵育6 h。
优化后,凝乳酶法前期乳清准备只需2步:①常温下原奶中添加pH 5.5的0.2 g/L凝乳酶氯化钠溶液,在28 ℃恒温水浴20 min使酪蛋白沉淀后;②离心30 min(16 500×g,4 ℃)去除细胞、蛋白质、脂肪、酪蛋白等,后续步骤与本试验优化后正常差速超速离心法相同。
1.2.3 乙酸法的优化
优化前,1)乙酸法[16](pH 4.6)乳清提取需4步:①全脂牛奶样品离心15 min(277×g,4 ℃)取上清,去除细胞,重复2次;②上清液中加入10%乙酸溶液,将pH调至4.6静置10 min;③上清液离心30 min(9 983×g,4 ℃)取上清;④上清液离心60 min(9 983×g,4 ℃)取上清。2)乙酸法[18](牛奶和乙酸体积比为100∶5)乳清提取需3步:①脱脂牛奶37 ℃预热10 min,②室温添加乙酸(牛奶和乙酸体积比为100∶5)混合5 min;③离心10 min(10 000×g,4 ℃)取上清。
优化后,乙酸法乳清提取只需2步:①常温下每1 mL原奶中添加4 μL纯乙酸溶液至pH 5.0,静置10 min使酪蛋白沉淀;②离心30 min(16 500×g,4 ℃)去除细胞、蛋白质、脂肪、酪蛋白等。后续步骤与本试验优化后差速超速离心法相同。
1.2.4 蔗糖密度梯度离心法的优化
优化前,1)蔗糖密度梯度离心法[19](43%、35%、20%蔗糖梯度)的乳清提取需5步:①去除牛奶中细胞、脂肪、酪蛋白等物质;②上清液离心70 min(150 000×g,4 ℃)取沉淀,添加5 mL PBS吹匀为混悬液;③超高速管中依次加入43%、35%、20%浓度蔗糖溶液,混悬液加入顶层;④离心90 min(110 000×g,4 ℃)取43%和35%(平均密度1.7 g/mL)沉淀液体;⑤沉淀液体离心90 min(110 000×g,4 ℃)取沉淀。2)蔗糖密度梯度离心法[20](30%蔗糖)的乳清提取需5步:①样品离心10 min(300×g,4 ℃)取上清;②上清液离心30 min(10 000×g,4 ℃)取上清;③超高速离心管中依次加入PBS、30%蔗糖溶液,上清液加入顶层;④离心90 min(100 000×g,4 ℃)取沉淀,添加PBS吹匀为混悬液;⑤混悬液离心90 min(100 000×g,4 ℃)取沉淀。
优化后,蔗糖密度梯度离心法只需3步:①在超高速离心管中依次添加40%、30%、20%、10%、5%浓度蔗糖溶液,优化后差速超速离心法提取的最终混悬液加入顶层;②离心120 min(120 000×g,4 ℃)除上清液,取40%、30%沉淀液体,使用0.22 μm过滤器过滤除去细菌、凋亡小体和聚集囊泡,使用PBS重悬收集沉淀吹匀为混悬液,达到清洗作用;③混悬液离心60 min(110 000×g,4 ℃)取沉淀,用100 μL PBS重悬收集乳源外泌体。
1.3 乳源外泌体鉴定
1.3.1 TEM鉴定乳源外泌体
TEM可分辨直径1 nm内图像,鉴定原理是将外泌体固定在网上并染色干燥,用TEM调整视野观察拍照,对比形态鉴定外泌体。取混匀奶牛乳源外泌体20 μL滴加在铜网;加入2%醋酸双氧铀1滴,负染乳源外泌体30 min,日光灯干燥;TEM观察选择电压80 kV,视野调整到直径200 nm,找到合适视野观察拍照保存。
1.3.2 WB鉴定乳源外泌体
将奶牛乳源外泌体裂解离心的上清液,与4×蛋白上样缓冲液混匀,100 ℃煮沸15 min;蛋白上样量10 μL,Marker上样量4 μL;电压70 V电泳30 min;电压转120 V电泳60 min;裁剪与胶相等大小的聚偏二氟乙烯(PVDF)膜浸泡甲醇激活30 s;横流200 mA转膜80 min;封闭液室温孵育120 min;去除封闭液,将PVDF膜分别加入抗体:肿瘤易感基因101蛋白(TSG101)、热休克蛋白70(HSP70)、四次跨膜蛋白家族中CD81和CD9,4 ℃封闭过夜;回收抗体PVDF膜用Tris-HCl缓冲盐溶液+吐温(TBST)溶液洗30 min;将PVDF膜相应加入抗兔二抗和鼠二抗室温孵育120 min;回收抗体PVDF膜用TBST溶液洗40 min;配制好化学发光显色液,使用化学发光仪曝光成像并保存。
1.3.3 NTA鉴定乳源外泌体
NTA是纳米粒子常用一束光照射,当光被纳米粒子散射并发生布朗运动时,便可记录纳米粒子运动路径、扩散系数和平均速度。将乳源外泌体放置冰上,PBS稀释,使用粒径分析仪检测,对悬浮液中特定直径30~1 000 nm外泌体和囊泡,实时进行逐个直接成像及观察;最后通过Zeta view 8.04. 02.软件计算出乳源外泌体粒径分布。
1.3.4 BCA鉴定乳源外泌体
奶牛乳源外泌体中添加蛋白裂解液,4 ℃裂解30 min,离心5 min(12 000×g,4 ℃),取上清至无菌离心管,按BCA蛋白检测试剂盒说明书操作,制定蛋白标准曲线,在562 nm处测吸光度值,通过公式计算样品蛋白浓度。
1.4 数据统计分析
采用SPSS 20.0统计软件对BCA蛋白浓度测定和NTA所得数据进行独立样本t检验,比较优化后4种方法提取的蛋白浓度和粒子浓度差异显著性。对比分析WB优化前和优化后4种方法提取的外泌体条带。使用ImageJ2x软件进行WB条带灰度值分析。使用GraphPad Prism 8软件进行绘制差异性显著分析。P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 对比每种优化前和优化后的乳源外泌体提取方法
2.1.1 对比优化前和优化后3种提取方法的乳清
本试验将优化前和优化后差速超速离心法、凝乳酶法和乙酸法提取的乳清进行拍照对比,如图1所示,差速超速离心法优化后比优化前(多步离心)提取的乳清沉淀效果更好;凝乳酶法优化后比优化前提取的乳清沉淀效果更好;乙酸法优化后比优化前提取的乳清沉淀效果更好。因蔗糖密度梯度离心法的筛选,主要在超高速离心且蔗糖浓度滤过部分,所以无乳清对比图。因此,3种方法均显示优化后提取的乳清比优化前沉淀更多。

A:差速超速离心法;B:凝乳酶法;C:乙酸法。下图同。A: differential overspeed centrifugal method; B: rennet method; C: acetic acid method. The same as below.
2.1.2 TEM鉴定对比每种优化前和优化后的乳源外泌体形态
TEM是鉴定外泌体的金标准,可直观对比外泌体典型形态和密度。分别对优化前和优化后4种方法对比分析,如图2所示,通过对图像结果观察对比,优化前和优化后的4种方法取得乳源外泌体均具有外形呈圆形有部分凹陷样似“茶托”形典型结构,粒径均在30~200 nm,差速超速离心法优化后比优化前提取的外泌体含量高;凝乳酶法优化后比优化前提取的外泌体含量高;乙酸法优化后比优化前提取的外泌体含量高,且外泌体表面光滑;蔗糖密度梯度离心法优化后比优化前提取的外泌体含量高。因此,本试验优化后4种方法提取的外泌体含量均明显高于优化前提取方法,且部分优化前提取的外泌体表面粗糙,形态结构被损伤。
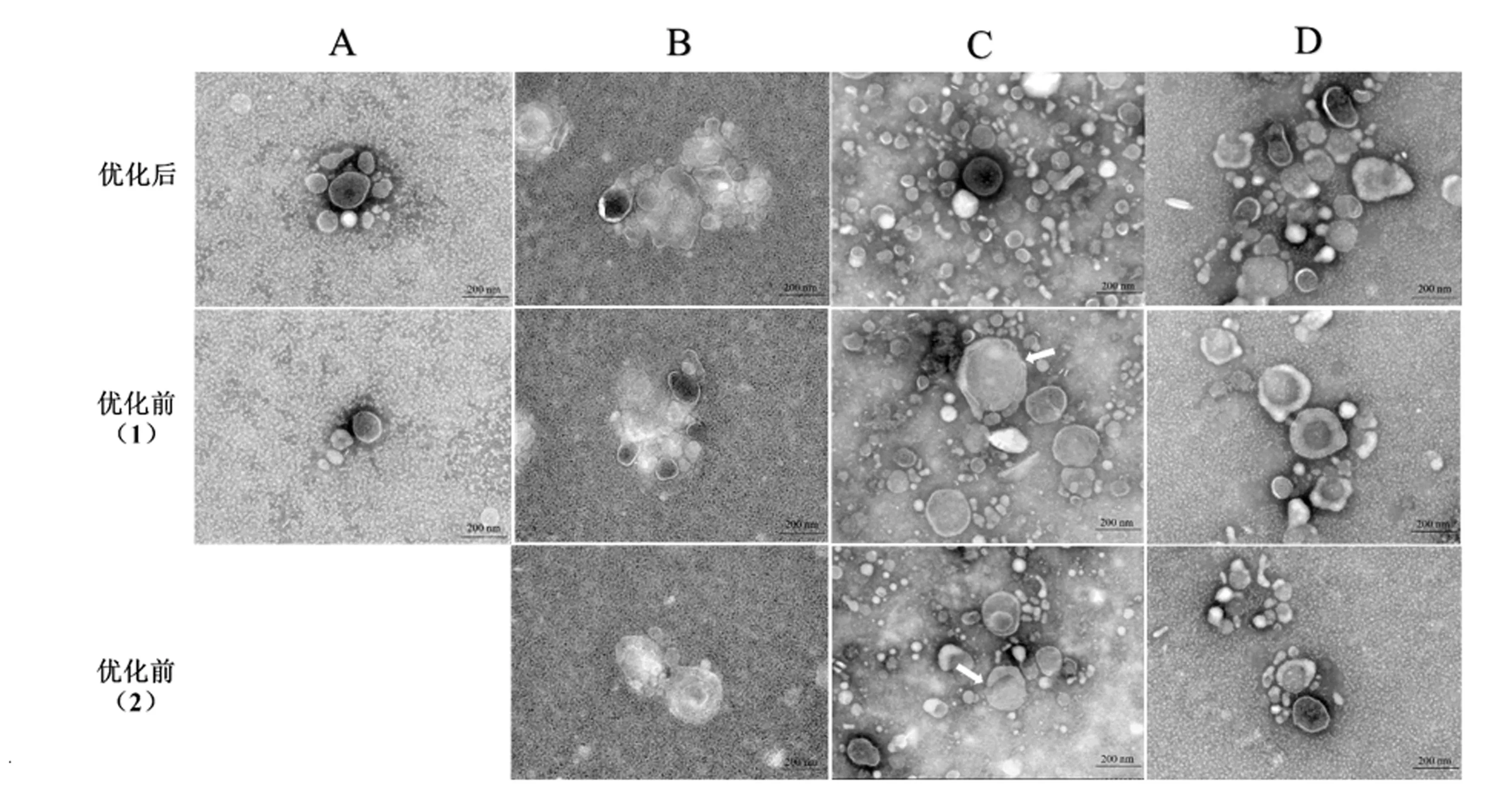
D:蔗糖密度梯度离心法,其中(1)为优化前蔗糖密度梯度离心法(43%、35%、20%蔗糖梯度),(2)为优化前蔗糖密度梯度离心法(30%蔗糖)。下图同。D:sucrose density gradient centrifugation method, (1) is the gradient centrifugation of sucrose density before optimization (43%, 35%, 20% sucrose gradients), and (2) is the gradient centrifugation of sucrose density before optimization (30% sucrose). The same as below.
2.1.3 WB鉴定对比每种优化前和优化后的乳源外泌体特异性蛋白表达量
利用WB条带分别对优化前和优化后4种方法提取的乳源外泌体进行对比鉴定,如图3所示,特异性标记蛋白CD81均有表达,4种方法均显示优化后提取的外泌体蛋白表达量比优化前高。
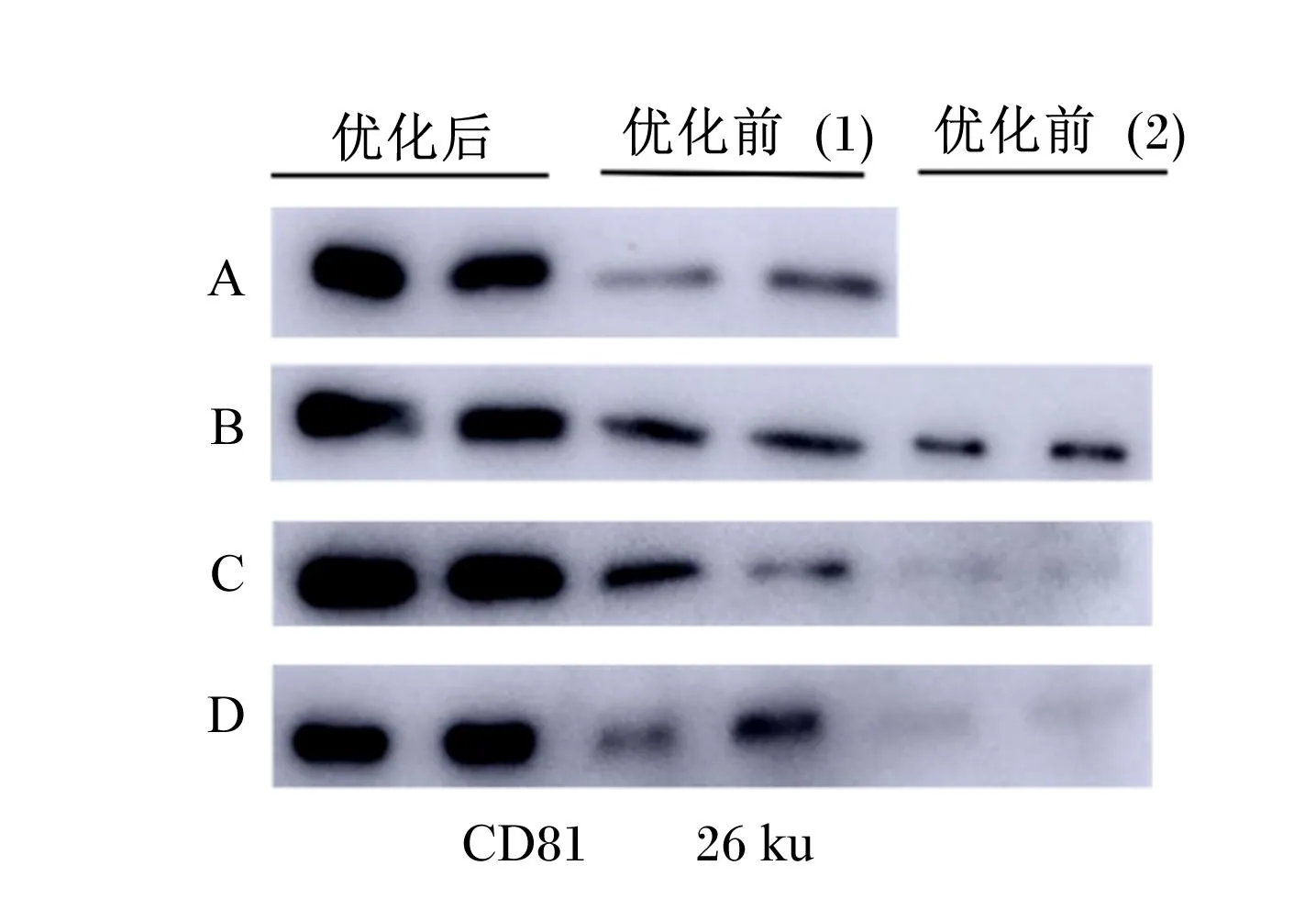
图3 优化前和优化后4种提取方法的WB条带对比
对比优化前和优化后的4种方法提取的乳源外泌体WB条带灰度值,如表1所示,差速超速离心法优化后提取的外泌体含量显著高于优化前(多步离心)(P<0.05);凝乳酶法优化后提取的外泌体含量最多,显著高于优化前(P<0.05);乙酸法优化后提取的外泌体含量显著高于优化前(P<0.05);蔗糖密度梯度离心法优化后提取的外泌体含量显著高于优化前(P<0.05)。因此,本试验优化后4种方法提取的外泌体含量均显著高于优化前。
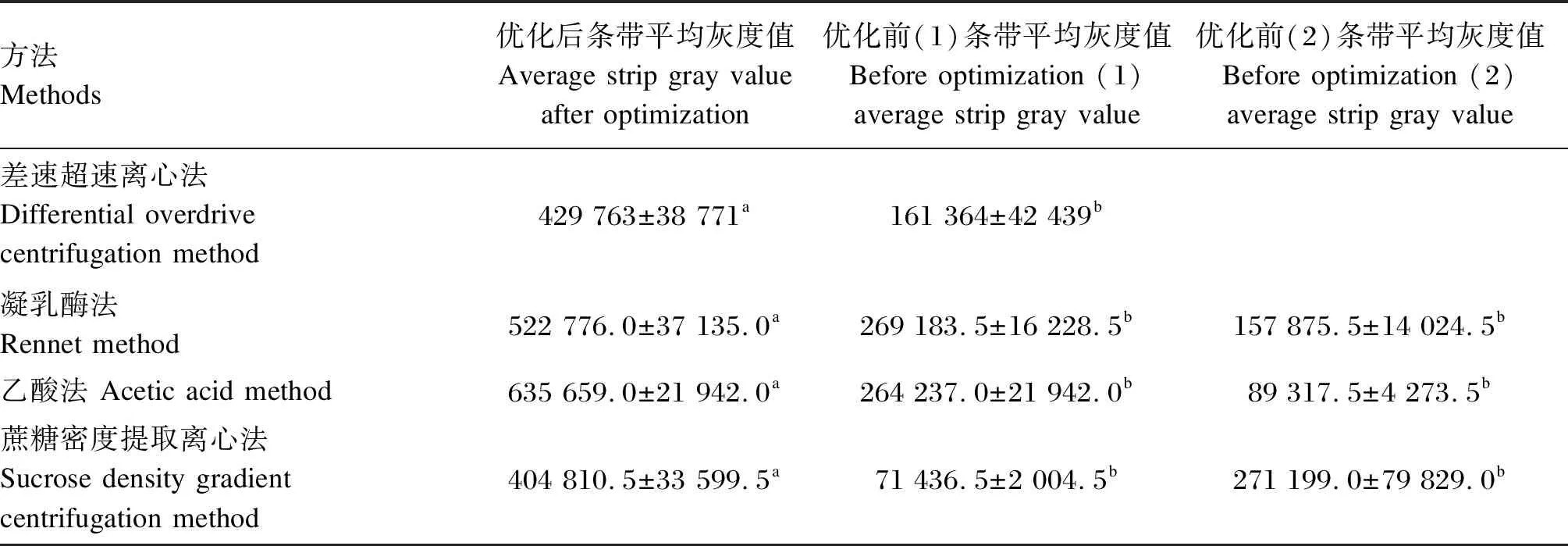
表1 优化前和优化后4种提取方法的WB条带灰度值对比结果
2.2 鉴定比较优化后的4种最优乳源外泌体提取方法
2.2.1 优化后乳源外泌体提取方法
对优化后乳源外泌体提取方法进行归纳,如图4所示,优化后的提取方法主要分为乳清提取和外泌体沉淀,高速离心去除酪蛋白、脂肪、细胞及蛋白质等,使用0.45 μm过滤器过滤,第1次超高速离心,使用0.22 μm过滤器过滤去除细菌、凋亡小体和聚集囊泡,第2次超高速离心,最终获得外泌体沉淀。

Centrifugal:离心;washing:溶液;filtration:过滤;exosomes:外泌体;casein:酪蛋白;cell debris:细胞碎片;fat:脂肪;chymosin:凝乳酶;acetic acid:乙酸;sucrose solution:蔗糖溶液;milk:牛乳。
2.2.2 TEM鉴定比较优化后4种方法提取乳源外泌体的形态
分别对优化后4种方法提取的乳源外泌体进行TEM鉴定,通过对图像结果观察对比,如图5所示,优化后4种方法提取的乳源外泌体均具有外形呈圆形、有部分凹陷样似“茶托”形结构,表面光滑,背景杂质少,粒径均在30~200 nm,乙酸法提取的乳源外泌体镜下视野密度高达80%以上,蔗糖密度梯度离心法提取的乳源外泌体镜下视野密度可达50%左右,凝乳酶法提取的乳源外泌体镜下视野密度可达20%左右,差速超速离心法提取的乳源外泌体镜下视野密度可达5%左右。因此,优化后乙酸法提取的乳源外泌体含量最高。

图5 优化后4种方法提取奶牛乳源外泌体形态和密度对比图
2.2.3 NTA鉴定比较优化后4种方法提取乳源外泌体的大小
分别对优化后4种方法提取的乳源外泌体进行NTA鉴定,通过对图像结果观察对比,如图6所示,优化后4种方法提取的乳源外泌体粒径均在30~200 nm,符合外泌体粒径范围。
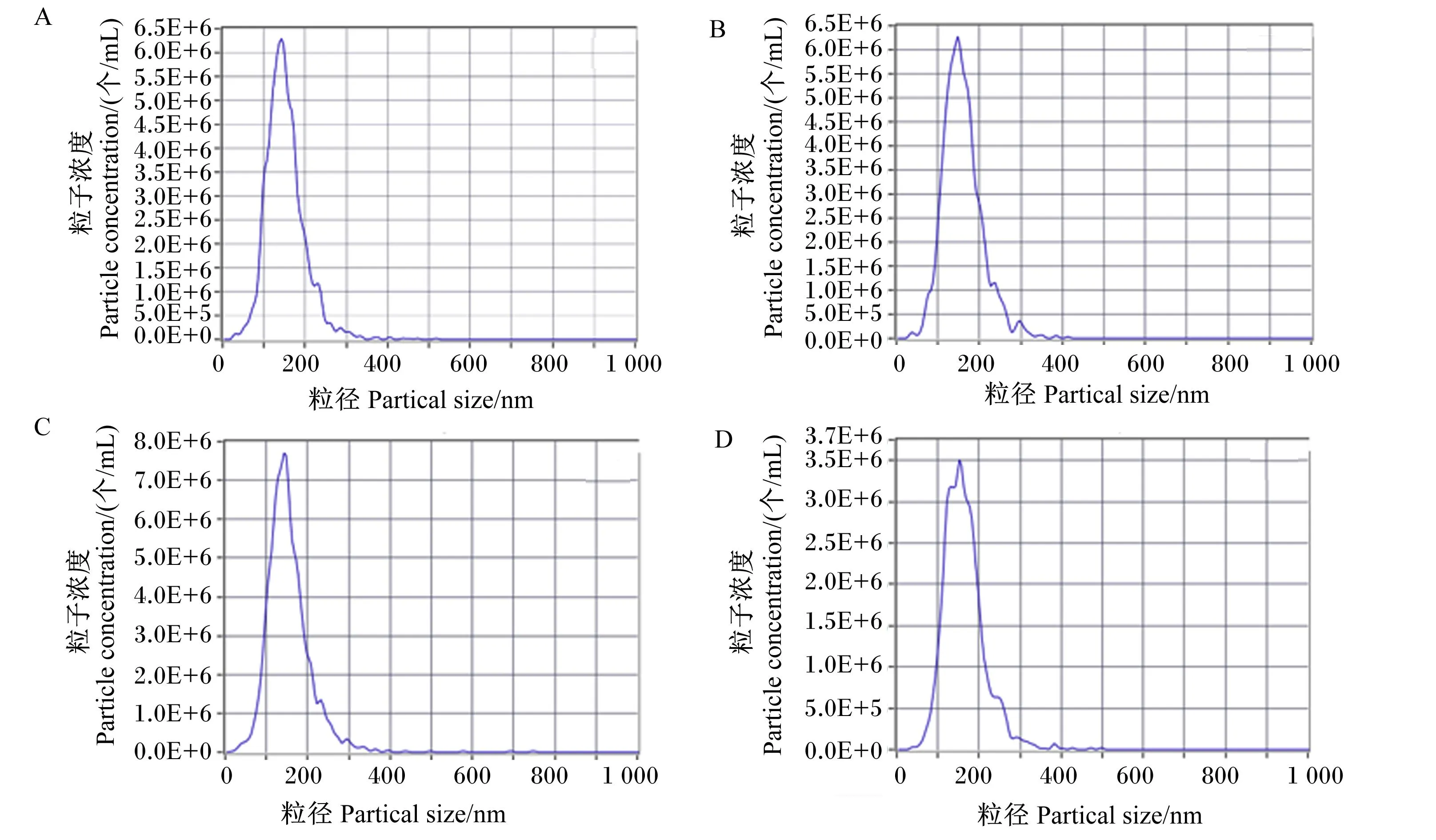
该图表示不同优化方法的不同倍比稀释后的峰值浓度。
通过对NTA鉴定结果对比,如表2所示,优化后差速超速离心法提取的乳源外泌体粒径大小为(144.1±48.2) nm;优化后凝乳酶法提取的乳源外泌体粒径大小为(143.9±56.9) nm;优化后乙酸法提取的乳源外泌体粒径大小为(151.0±47.2) nm;优化后蔗糖密度梯度离心法提取的乳源外泌体粒径大小为(155.0±49.9) nm。优化后乙酸法提取的乳源外泌体粒子浓度最高,其次是优化后蔗糖密度梯度离心法提取的乳源外泌体,最后是优化后凝乳酶法提取的乳源外泌体,均高于优化后差速超速离心法提取的乳源外泌体粒子浓度。因此,优化后乙酸法提取的乳源外泌体含量最高。
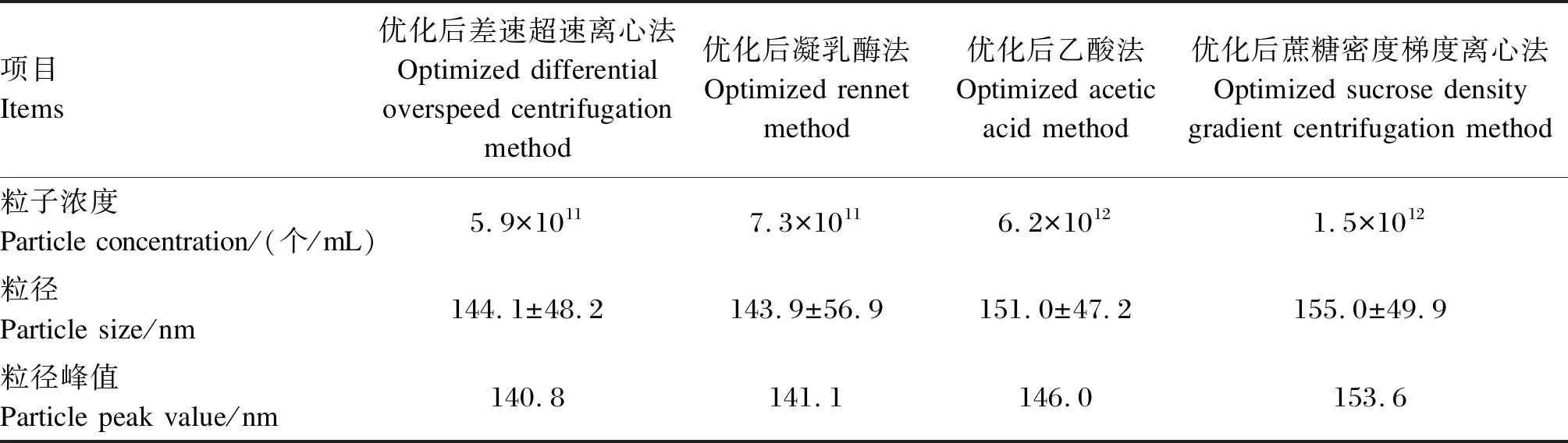
表2 优化后4种方法提取奶牛乳源外泌体粒径、粒子浓度和粒径峰值对比结果
2.2.4 BCA蛋白浓度测定鉴定比较优化后4种方法提取的乳源外泌体的浓度
因BCA蛋白浓度检测的非纯外泌体浓度,所以分别对优化后4种方法提取的乳源外泌体样品进行BCA蛋白浓度测定,标准曲线为y=2.342 8x-0.198 8(x:样品蛋白浓度,mg/mL;y:样品吸光度值),r2=0.989 5。如表3所示,优化后乙酸法提取的乳源外泌体样品蛋白浓度最低,显著低于优化后差速超速离心法提取的乳源外泌体样品蛋白浓度(P<0.05),其次是优化后蔗糖密度梯度离心法提取的乳源外泌体,最后是优化后凝乳酶法提取的乳源外泌体,均低于优化后差速超速离心法提取的乳源外泌体样品蛋白浓度。根据TEM方法和NTA浓度结果,可对比得出乙酸法提取得到的乳源外泌体杂蛋白含量少且纯度高。
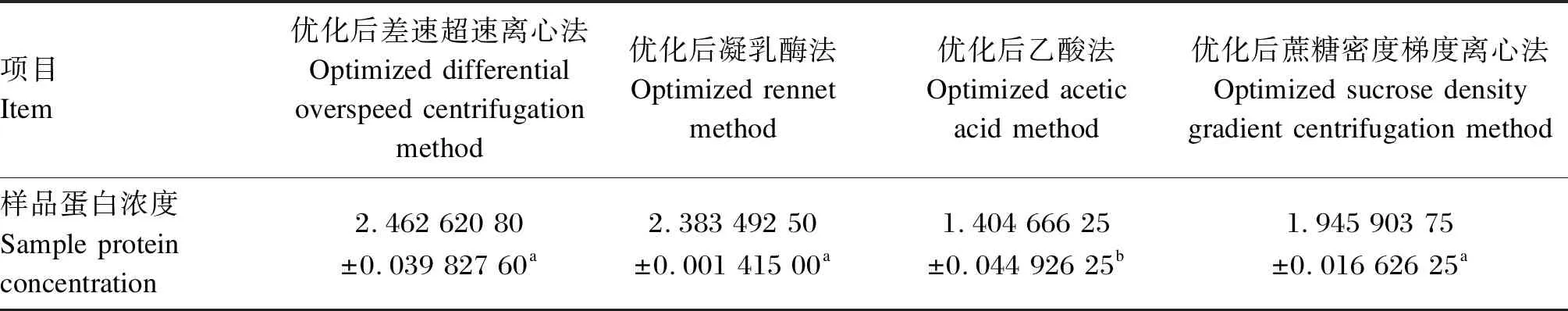
表3 优化后4种方法提取奶牛的乳源外泌体样品蛋白浓度对比结果
2.2.5 WB鉴定比较优化后4种方法提取的乳源外泌体特异性蛋白表达量
外泌体表面和内部有许多特异性标记蛋白,如HSP70、TSG101、CD9、CD81等,而HSP70是外泌体位于胞浆内的蛋白,因WB可特异性测定乳源外泌体表面及内部蛋白表达量,所以分别对优化后4种方法提取的乳源外泌体进行鉴定,如图7所示,优化后乙酸法提取到的乳源外泌体可明显表达表面及内部特异性标记蛋白CD81、CD9、TSG101和HSP70,而其他3种优化后方法均有不同程度表面及内部蛋白标记物损伤。因此,优化后乙酸法提取的乳源外泌体含量最高,且可用于转录组学、蛋白质组学等进一步试验。
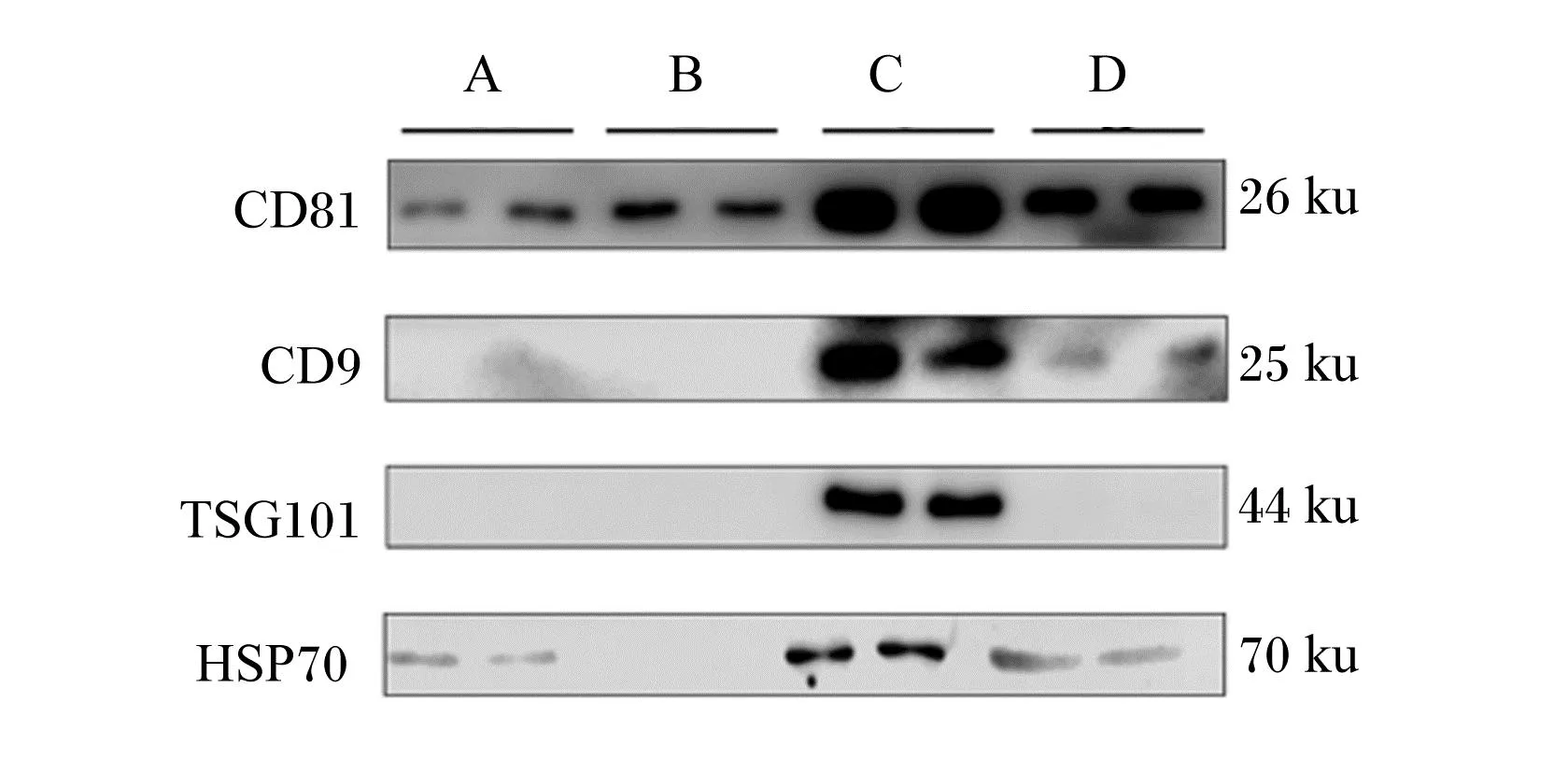
TSG101:肿瘤易感基因101 tumor susceptibility gene 101;HSP70:热休克蛋白70 heat shock protein 70。
分别对优化后4种方法提取的乳源外泌体WB条带灰度值进行对比,如表4所示,优化后乙酸法提取的乳源外泌体WB条带灰度值显著高于其他3种方法(P<0.05),其次是优化后蔗糖密度梯度离心法提取的乳源外泌体,WB条带灰度值高于优化后凝乳酶法和优化后差速超速离心法。

表4 优化后4种方法提取的乳源外泌体WB条带灰度值比较结果
2.2.6 WB法鉴定筛选优化后乙酸法最优乙酸添加量
将优化后4种方法进行对比后发现,优化后乙酸法提取的乳源外泌体含量最高,通过WB方法检测外泌体特异性表面蛋白CD81和内部蛋白HSP70,根据蛋白表达水平筛选优化后乙酸法的最佳乙酸添加量,如图8所示,每毫升乳中添加4 L乙酸(pH 5.0)时蛋白表达量最高,且外泌体内部蛋白HSP70未受损伤。HSP70是外泌体内部蛋白,位于胞浆内,应激下可进入核,并包围核仁,具有与核苷酸结合的特性,表明外泌体内部及核糖体未受乙酸的损伤,可用于进一步的核酸试验。
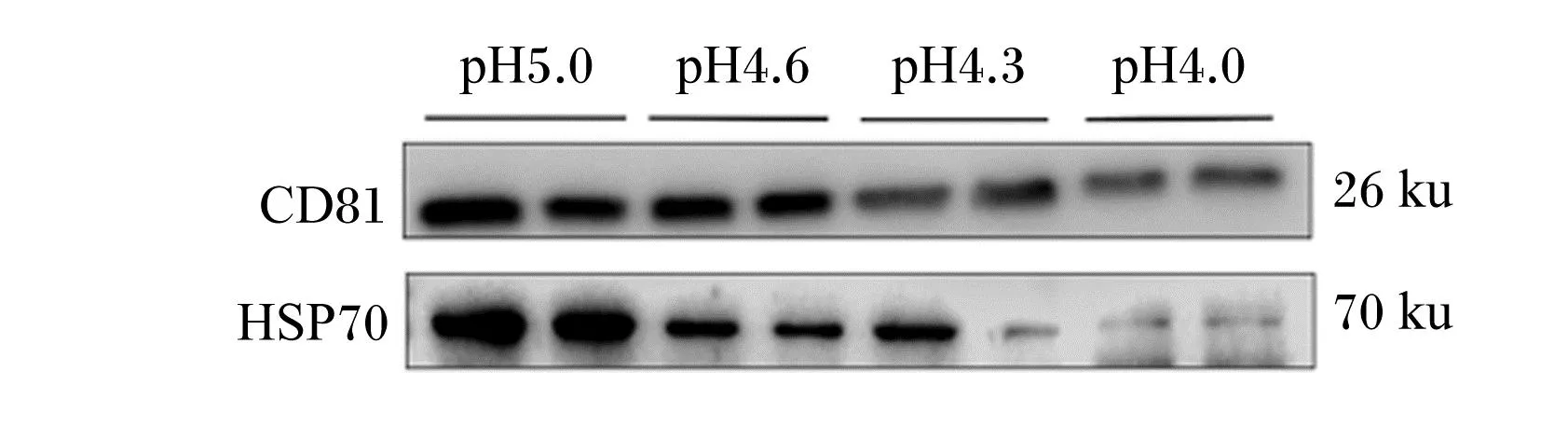
HSP70:热休克蛋白70 heat shock protein 70。
分别对优化后乙酸法不同乙酸添加量提取的乳源外泌体WB条带灰度值对比,如表5所示,每毫升乳中添加4 μL乙酸至乳的pH为5.0时提取的外泌体含量最高,其次是每毫升乳添加8 μL乙酸至乳的pH为4.6时提取的外泌体,最后是每毫升乳添加12 μL乙酸至乳pH为4.3时提取的外泌体,均比每毫升乳添加20 μL乙酸至乳pH为4.0时提取的外泌体含量高。因此,每毫升乳添加4 μL乙酸至乳pH为5.0时提取的外泌体含量高且稳定。

表5 优化后乙酸法不同乙酸添加量提取的乳源外泌体WB条带灰度值比较结果
3 讨 论
近几年国内外学者不断发现乳源外泌体可作为载体,通过靶向传递生物大分子、核酸、基因、药物等,达到抵抗炎症、治疗肿瘤、制作疫苗、疾病诊断等功效,极具医学潜力及应用价值,所以研究乳源外泌体的提取就成为重中之重。
牛奶中含有大量蛋白质、脂肪和酪蛋白等化合物,提取乳源外泌体有难度。本试验根据前人已建立的差速超速离心法、凝乳酶法、乙酸法和蔗糖密度梯度离心法,通过不断优化和改进,可有效除去乳中化合物,精简乳源外泌体的提取方法的步骤。根据国际外囊泡学会发布的鉴定标准,对优化前和优化后4种方法提取到的乳源外泌体进行鉴定及比较。Yamauchi等[21]通过加入盐酸进行等电点沉淀,发现提取的乳源外泌体表面粗糙,受到酸性条件的损伤,而本试验优化后乙酸法提取得到乳源外泌体,通过TEM和NTA观察,发现该外泌体数量和粒子浓度都高于其他3种方法,而且在酸性条件下,形态也未遭受破坏。Rahman等[22]研究发现,加入乙酸进行等电点沉淀,提取乳源外泌体粒子浓度高于超速离心法和加入盐酸等电点沉淀法提取效果,与本试验研究结果具有相似性。研究同时发现,在酸性条件下,外泌体表面及内部特异性标记蛋白的表达易受损伤,而本试验优化后乙酸法提取的乳源外泌体表面及内部特异性标记蛋白均未受到破坏,可见添加乙酸至乳pH为5.0时可有效保护外泌体内部结构。综上所述,本试验优化的乙酸外泌体提取方法可有效除去乳中酪蛋白及其他化合物,提高外泌体纯度及浓度,保持形态结构完整性,同时可减少提取步骤及时间,具有一定的应用价值。
4 结 论
本试验通过增加离心速度,改变乙酸或凝乳酶用量、调整蔗糖密度梯度,减少离心步骤成功优化了4种乳源外泌体提取方法,优化的奶牛乳源外泌体乙酸提取法在减少提取步骤和时间的基础上,可获得纯度高、特异性标记蛋白不易降解的优质外泌体。研究结果为乳源外泌体大量制备和工业化生产奠定方法基础。

