辣椒素生物活性及其递送系统研究进展
王馨瑶,陈梦娟,肖 何,刘 洋,王蓉蓉,蒋立文
(湖南农业大学食品科学技术学院,食品科学与生物技术湖南省重点实验室,湖南 长沙 410128)
辣椒(Capsicum annuumL.)是我国种植面积最大的蔬菜作物,其年种植面积稳定在210万 hm2以上,消费量占中国调味品的30%[1]。辣椒除可用作烹饪、调味和加工外,还能用于药食同源食品的研发[2]。辣椒素(capsaicin,CAP)是辣椒中主要的生物活性化合物,由CAP合酶通过辣椒胎盘组织中的香草胺和支链脂肪酸的生物反应合成[3]。除CAP外,辣椒中还发现了许多与CAP化学结构类似的天然CAP类化合物,如二氢辣椒素、去甲二氢辣椒素、高二氢辣椒素和高辣椒素等,其结构差异仅体现在脂肪族侧链的长度和烷基侧链区域中的饱和度不同(图1)[4-5]。其中,CAP和二氢辣椒素占辣椒中CAP类化合物总量的80%~90%,是主要的辛辣成分,表达出的辣度是次要CAP的两倍左右[3]。CAP具有镇痛[6]、抗炎[7]、抗氧化[8]、抗癌[9]、代谢调节[10-11]等生物学效应,但由于其水溶性差且刺激性强,极大地限制了CAP在食品药品领域的应用。目前,已设计出包括脂质体[12]、胶束[13]、微乳液[14]、纳米乳液[15]、Pickering乳液[16]和纳米粒子等递送系统,用以提高CAP的生物利用度并减轻其刺激性[6-7]。本文主要阐述CAP的生物学功能,并总结了目前用于提高CAP稳定性和生物利用度的各种递送系统。
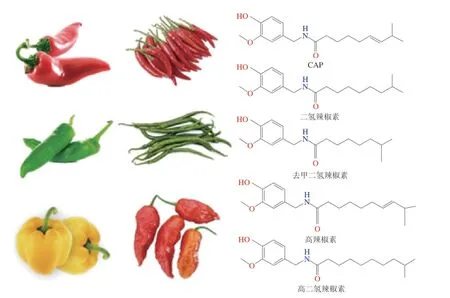
图1 CAP的化学结构Fig.1 Chemical structures of CAP
1 CAP的生物学效应
CAP作为辣椒的主要生物活性成分,其在动物、体外、人体中的生物学效应已得到广泛研究(表1),探究其机制,发现CAP可与瞬时受体电位香草素1(transient receptor potential vanillin 1,TRPV1)受体结合发挥作用(图2),也可独立于TRPV1直接作用于特定的细胞,改变细胞膜流动性、离子通量和活性氧水平[17]。此外,CAP还可通过直接或间接影响肠道微生物菌群的组成、丰度和结构改善肠道微生物环境,从而有效预防肥胖[18]、糖尿病[19]或炎症性肠病[20]等疾病的发生。

表1 CAP的生物学效应研究Table 1 Recent studies on biological effects of CAP
1.1 镇痛作用
TRPV1离子通道在初级感觉神经元中充当有害信号的分子检测器,其受体主要在Aδ和C伤害性感觉神经上高度表达,因此TRPV1的激活会导致神经系统对疼痛的感知[37]。然而,局部应用TRPV1通道激动剂CAP可激活TRPV1-表达伤害感受器中的TRPV1受体。CAP在TRPV1 S3和S4之间的通道-脂质界面上与TRPV1受体结合,磷脂酶C的Ca2+依赖性激活可引起局部质膜水通道蛋白PIP2水解为1,4,5-三磷酸和二酰基甘油,导致TRPV1通道失活[39]。CAP与TRPV1受体结合引起初始神经元兴奋和促炎介质释放,且反复使用低浓度CAP局部给药可导致TRPV1离子通道受体脱敏,增强疼痛敏感性[38]。此外,CAP还可导致离子通道失活产生短期的去功能化,起到短时镇痛作用。然而,高浓度的CAP可介导大量Ca2+流入并激活钙蛋白酶引起轴突末端结构消融,导致TRPV1+传入神经长期去功能化,起到长效镇痛作用[40-41]。目前,CAP已被用于治疗类风湿关节炎[42]、带状疱疹后神经痛[43]、糖尿病性神经病[44]及非糖尿病性周围神经病等慢性肌肉骨骼和神经性疼痛[40]。
1.2 抗炎作用
慢性炎症是心血管病、癌症、糖尿病、非酒精性脂肪性肝病、自身免疫病等慢性疾病的基础,全球一半以上的死亡都可归因于与慢性炎症相关的疾病[45]。因此,采取措施预防或控制慢性炎症极有必要。CAP通过降低促炎因子、趋化因子、细胞黏附分子和免疫细胞功能的表达,表现出抗炎特性[46-48]。Tang Jing等[49]证明CAP可通过时间和剂量依赖方式减少脂多糖刺激的THP-1巨噬细胞中促炎因子白细胞介素-1β、白细胞介素6和肿瘤坏死因子-α的产生。同时,CAP可激活过氧化物酶体增殖物激活受体γ,诱导肝X受体α的表达上调,从而阻断核转录因子介导的炎症基因表达。Mendivil等[22]发现长期口服CAP(2 mg/(kgmb·d))可降低胃炎Wistar大鼠胃黏膜中促炎细胞因子和环氧化物酶-2的表达,对大鼠胃保护率达到61.1%,有效减少了胃炎Wistar大鼠胃部炎症浸润和溃疡面积,起到了胃保护作用。
1.3 抗氧化作用
氧化应激是指体内氧化剂在生成和中和之间的一种失衡状态,会导致组织和器官功能的渐进性丧失,引起不同的病理状态[50]。CAP的抗氧化作用已在Wistar大鼠红细胞[26]、人脐静脉内皮细胞[51]和大鼠肝线粒体膜[52]等多种模型中得到证实。Chaudhary等[26]发现CAP通过提高等离子体铁还原能力、细胞内谷胱甘肽水平和质膜氧化还原系统活性,降低活性氧、丙二醛、蛋白质羰基和晚期氧化蛋白产物水平,对氧化应激具有显著抑制作用。Chen等[51]发现CAP(50 μmol/L)具有明显的自由基清除活性,其对1,1-二苯基-2-三硝基苯肼自由基清除率为52.8%。此外,CAP还可通过调节活性氧生成酶和清除酶的表达活性,抑制人脐静脉内皮细胞中氧化低密度脂蛋白诱导的活性氧的产生。此外,CAP还能有效抑制辐射引起的脂质过氧化和蛋白质氧化,从而在防止辐射引起的抗氧化酶和重要的内源性抗氧化剂谷胱甘肽活性丧失方面发挥重要作用[52]。
1.4 抗癌作用
癌症也称恶性肿瘤,是由于机体细胞持续过度分裂失去正常调控的疾病,其发病率和死亡率以惊人的速度增长[53-54]。CAP作为一种潜在的抗癌化合物,在乳腺癌[33]、肺癌[9]、胃癌[55]、肝癌[56]和前列腺癌[32]等的治疗中均有应用。CAP可与多种药物联用增强抗癌活性[57-58],其抗癌机制主要通过诱导肿瘤细胞凋亡和周期阻滞、抑制肿瘤细胞侵袭和迁移、阻止肿瘤血管生成实现[59]。陈晗等[60]以不同浓度CAP处理前列腺癌细胞PC-3,发现CAP通过上调PC-3中DNA复制所必需的重要蛋白PCNA和细胞周期驱动因子Cyclin D1,下调细胞周期蛋白依赖性激酶抑制剂P21抑制PC-3增殖;并通过干预PC-3中B淋巴细胞瘤-2基因表达上调和细胞凋亡调控因子Bax表达下调,从而促进其凋亡。此外,经CAP干预后,下游E-钙黏蛋白和紧密连接蛋白、抗闭锁小带蛋白-1表达上调,N-钙黏蛋白和波形蛋白表达下调,从而抑制了PC-3的迁移。Lee等[61]以20 mg/kgmbCAP喂食肿瘤抑制基因APC缺失的ApcMin+/小鼠4 周,发现小鼠肠道中的息肉数量和肿瘤负荷减少,表明CAP是一种潜在的抗癌药物。
1.5 心血管保护作用
心血管疾病包括动脉粥样硬化负荷引起的冠状动脉疾病、急性心肌梗死、缺血后心力衰竭和不同病因的心力衰竭,其发病率在全球范围内不断上升[62]。CAP能够通过释放降钙素基因相关肽和P物质等感觉神经肽作为保护介质,进入血液到达血管和心脏,发挥抗动脉粥样硬化和心脏保护作用[63-64]。Li Jianping等[63]给正常钠(0.5%,质量分数,下同)饮食Wistar大鼠注射100 µg/kgmbCAP,可增加大鼠血浆中降钙素基因相关肽水平,降低平均动脉压。此外,CAP还可通过激活TRPV1通道减轻动脉粥样硬化。Ma Liqun等[65]以0.01% CAP长期(24 周)喂食高脂饮食(high fat diet,HFD)ApoE-/-小鼠,结果表明CAP能显著增加ATP结合盒转运体A1的表达,降低低密度脂蛋白相关蛋白1的表达及血浆中总胆固醇和甘油三酯浓度,改善动脉粥样硬化病变。Li Binghu等[66]发现CAP激活TRPV1可减轻氧化低密度脂蛋白损伤的血管平滑肌细胞自噬,激活自噬-溶酶体通路,起到抗粥样动脉硬化的效果。近期研究也表明,CAP可通过上调沉默信息调节因子6促进缺氧诱导因子-1α的脱乙酰化和降解,防止动脉钙化[67]。
1.6 代谢调节
代谢综合征主要由胰岛素抵抗和肥胖组成,可增加心血管疾病、2型糖尿病和非酒精性脂肪性肝病发生的风险。CAP可通过激活TRPV1调节单磷酸腺苷活化蛋白激酶、过氧化物酶体增殖物激活受体α、解偶联蛋白1和胰高血糖素样肽1在内的代谢调节剂,从而增加脂肪氧化[68-69]、调节葡萄糖稳态[70]、改善心脏和肝脏功能[71]。此外,CAP还可通过调节肠道微生物组成和相对丰度,有效减轻代谢紊乱[72]。
1.6.1 CAP对糖代谢的影响
CAP可激活TRPV1通道,从而增强胰岛素分泌和抑制胰高血糖素释放降低血糖[73]。Zhang Shiqi等[74]以6 mg/(kgmb·d)CAP喂食链脲佐菌素诱导的糖尿病大鼠,发现大鼠体质量增加,其肝糖原和肌糖原含量分别增加66.0%和69.3%。此外,CAP激活了肝脏和胰腺中的TRPV1,导致肝X受体和胰十二指肠同源盒-1的表达上调,从而调节葡萄糖激酶、葡萄糖转运蛋白2、磷酸烯醇丙酮酸羧激酶和葡萄糖6-磷酸酶的表达控制糖代谢。Hui Suocheng等[75]给2型糖尿病db/db小鼠喂食含CAP的食物8 周,发现CAP通过减少糖异生和增加肝脏中的糖原合成显著改善葡萄糖耐量和胰岛素敏感性。此外,与食物喂养小鼠相比,CAP可抑制乳酸杆菌属相对丰度增加及胆汁盐水解酶活性,增强肝胆汁酸的合成,从而改善葡萄糖代谢,增加胰岛素敏感性[30]。
1.6.2 CAP对脂代谢的影响
CAP可通过激活TRPV1阳离子通道抑制脂肪细胞分化,诱导白色脂肪细胞褐变,增加产热并降低细胞内脂质含量[76-77]。在3T3-L1前脂肪细胞和脂肪细胞中,低剂量CAP能降低过氧化物酶体增殖物激活受体γ、CAAT区增强子结合蛋白α和瘦素的表达,同时诱导细胞凋亡并生成抗脂肪基因,以此抑制脂肪生成[78]。Wu Tao等[79]发现与HFD喂养的小鼠相比,以200 mg/(kgmb·d)CAP喂食HFD小鼠12 周可使小鼠体质量减轻27.5%,葡萄糖耐量显著逆转,血清甘油三酯、总胆固醇、低密度脂蛋白胆固醇和三甲胺N-氧化物水平降低,微生物多样性增加。Takeda等[18]发现CAP不仅能激活解偶联蛋白1基因,还激活了一系列参与甘油三酯代谢、脂肪酸代谢、糖酵解途径和适应性产热的代谢基因,促进了脂肪细胞褐变,提高了棕色脂肪细胞转化效率。
2 CAP递送系统
CAP是一种强疏水性物质,室温下几乎不溶于水,而低溶解度会导致其体内生物利用度低,生物功效受到很大限制[80]。此外,CAP还具有强刺激性,直接口服会刺激口腔和胃部导致口腔溃疡和胃溃疡,且与皮肤直接接触也会引起皮肤灼痛或刺痛[81]。为了提高CAP的生物利用度并缓解其强刺激性,目前已设计了多种CAP封装递送系统,包括脂质体、胶束、微乳液、纳米乳液、Pickering乳液和纳米粒子等(图3)。
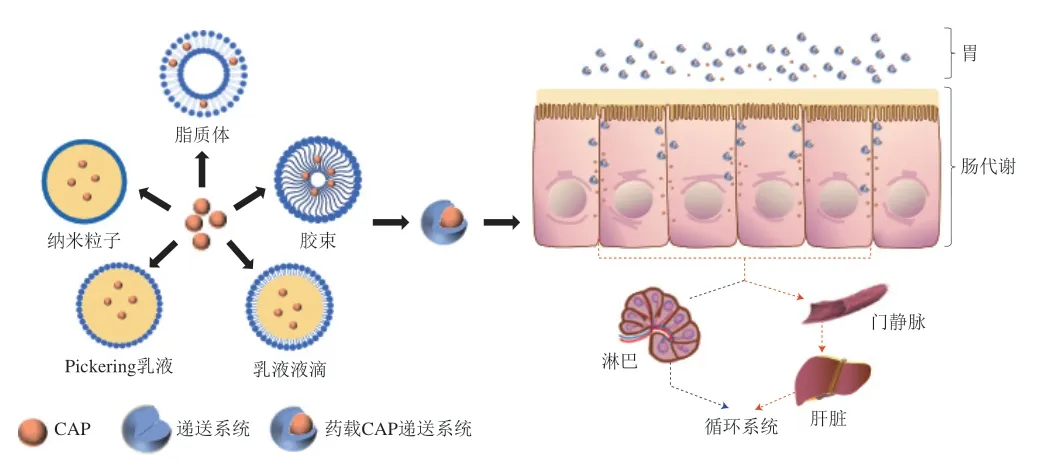
图3 增强CAP生物利用度的递送系统[41]Fig.3 Delivery systems to enhance CAP bioavailability[41]
2.1 脂质体
脂质体的主要成分是脂质和脂肪酸,由于其天然存在于细胞膜中,因此被认为具有内在生物相容性和可生物降解性。在结构上,脂质体由两亲分子自组装成双层球体,是不同极性分子的理想载体[82]。脂质体通过稳定化合物、增加药物浓度及克服细胞和组织摄取障碍增加药物在靶细胞中的停留时间,从而提高药物的治疗指数[83]。Zhu Yuan等[12]应用薄膜分散技术制备了荷载CAP的脂质体,其平均包封率为81.9%,且与游离CAP相比,相对生物利用度增加了3.34 倍。低剂量CAP(质量分数为0.075%)已被证明可有效缓解神经性疼痛,但提高剂量可能会导致应用部位出现红斑、疼痛、瘙痒和丘疹等副作用;而脂质体CAP制剂可在较低剂量情况下实现缓慢释放,达到更持久的镇痛效果,并减轻甚至消除副作用[84-86]。Shomorony等[87]发现荷载少量CAP和河豚毒素的脂质体可实现持续释放,达到约18 h的麻醉效果,且未发现任何毒性作用。
2.2 胶束
胶束与双尾磷脂形成双层结构的脂质体不同,是封闭的脂质单层,表面具有极性头基,内部具有疏水尾,可将多种疏水性药物的溶解性提高10~5000 倍。此外,胶束的纳米尺寸(10~100 nm)能够增强药物渗透性,并延长药物保留时间,从而提高其生物利用度[88-89]。基于以上优势,胶束可用于皮外[90]、口服性[91]、注射性[92]和靶向性抗癌药物递送[93]。Zhu Yuan等[13]采用薄膜分散法设计了一种由磷脂、胆酸钠和聚乙烯吡咯烷酮组合的载有CAP且粒径低于50 nm混合聚合物胶束,经大鼠给药及动力学研究表明,该胶束减少了CAP对大鼠胃黏膜的刺激,增加了CAP的体外释放,使CAP的口服生物利用度相较于游离CAP提高了2.42 倍。另一方面,胶束还可用于光动力学疗法。Trubitsyn等[94]用尼罗红和共价罗丹明对聚乙二醇-聚羟基辛酸进行标记,其形成的荧光聚合物胶束稳定性显著改善可用于治疗诊断。
2.3 乳液
2.3.1 微/纳米乳
微乳液是由水、油和表面活性剂制成各向同性且热力学稳定的分散体[95],而纳米乳液是纳米级颗粒的分散体,其与自发形成的微乳液不同,可通过高压均质机、超声波发生器和微流化器等机械力获得[96-97]。微/纳米乳液具有增加稳定性、改善控释性能和提高生物可及性等优点[98]。Zhu Yuan等[14]以聚氧乙烯蓖麻油EL、乙醇、中链甘油三酯和水制备了荷载CAP的微乳液,其平均包封率约85.0%,与游离CAP相比,CAP微乳液在体外释放中呈现更快的释放速率,且延长了释放时间,表明微乳液可提高CAP的溶解度和生物利用度。在大鼠体内研究发现,CAP微乳液的口服生物利用度比游离CAP高2.64 倍,明显降低了对胃黏膜的刺激。Lu Muwen等[15]以荷载CAP的有机凝胶为油相,Tween 80为乳化剂,经超声处理得到平均液滴尺寸为168 nm且CAP荷载量为80.4 mg/mL的纳米乳液。经体外和体内研究表明,与游离CAP相比,纳米乳荷载的CAP更易于吸收,用其喂食HFD大鼠既能够缓解CAP对胃黏膜刺激,还能提高CAP的生物可及性,并表现出了抗肥胖作用。Han Jingjing等[99]在高压均质下使用生育酚聚乙二醇1000琥珀酸酯作为乳化剂制备荷载CAP的纳米乳液,其包封率为91.9%,稳定性和抗氧化特性均增强。生物学研究表明,相比于游离CAP,乳液对大鼠肝脏细胞的毒性较低,且对胃肠道黏膜的刺激性也较低,表明纳米乳液在封装和递送刺激性生物活性物质方面具有潜在应用。
2.3.2 Pickering乳液
Pickering乳液是由固体颗粒稳定的不含表面活性剂的乳液,其独特结构使其具有良好的稳定性、优异的生物相容性和环境友好性,被广泛用于疏水性生物活性物质的装载、递送和控释[100]。此外,当Pickering乳液体积分数超过74%时可形成高内相Pickering乳液,同样具有很强的荷载能力[101]。Wu Xiaolin等[16]将CAP与海藻酸钠混合形成CAP的水分散形式,将其与玉米油、蜂蜡、聚甘油蓖麻醇酸酯混合后在高速剪切条件下得到荷载CAP的油包水高内相乳液(water-in-oil high internal phase emulsion,W/O HIPE),CAP包封率为98.7%,且储存28 d后乳液仍保持稳定。体外消化模拟实验表明,荷载CAP的W/O HIPE在模拟口腔和胃条件下CAP几乎没有释放;通过在模拟肠液中缓慢和可持续释放,有效提高了CAP的生物利用度。此外,小鼠胃组织切片的组织学形态表明,将CAP荷载于W/O HIPE中对小鼠胃组织未造成任何明显的损害。
2.4 纳米粒子
纳米粒子由于其生物相容性、抗炎、抗菌、高荷载能力和靶向递送能力,常用于生物[102-103]、医学[104]和环境方面[105]。纳米粒子不仅能提高生物活性物质的稳定性,还能携带其穿过细胞膜和生物屏障,达到靶向递送和持续释放的效果[106]。Xu Mengqing等[107]采用气体扩散反应和一锅法合成了一种荷载CAP的酸响应性CaCO3纳米颗粒,其释放的CAP可特异性激活TRPV1通道,使细胞内钙离子浓度超载引起细胞凋亡,从而达到治疗肿瘤的效果。Ni Xiaoyue等[108]将CAP修饰的半导体聚合物纳米粒子在无需额外添加钙离子条件下,用于NIR-II荧光成像引导的钙超载/PDT联合治疗。Tao Xiaoqi等[109]用籼米淀粉纳米粒子荷载CAP,其包封率为70.1%,且CAP可从籼米淀粉纳米粒子中持续释放。Feng Yingshu等[80]制备的自组装CAP纳米颗粒相对口服生物利用度可达游离CAP的3.2 倍,降低了肝组织和血液样本的某些脂质指数。总之,纳米颗粒系统通过口服给药增强了CAP的生物利用度,提高其稳定性并降低对黏膜的刺激。
3 结语
本文首先综述了CAP的生物学效应,主要包括镇痛、抗氧化、抗炎、抗癌和代谢调节等。目前,医学领域已将CAP与其他药物联合制备成具有镇痛效果的外用贴剂,镇痛效果及耐受性较好。生物学研究表明,CAP可通过下调促炎性细胞因子和炎症介质起到抗炎作用。作为一种抗氧化物质,CAP也具有良好的清除活性氧的潜力,且可通过抑制过氧化物酶活性减轻氧化应激。此外,CAP还可预防和治疗肥胖、糖尿病及心血管等疾病。体外研究表明,CAP通过诱导癌细胞凋亡和周期阻滞、抑制癌细胞迁移从而起到抗癌作用。然而,由于CAP水溶性差导致生物利用度较低,且辛辣味会引起口腔和胃强烈的烧灼感,影响了其在食品药品领域中的应用。基于以上问题,本文总结了可用于改善CAP应用限制条件的递送系统,包括脂质体、胶束、微/纳米乳和纳米颗粒等。CAP在这些递送系统中的稳定性、荷载能力和包封率均得到提高,通过实现缓释延长CAP的作用时间,有效减少刺激并提高其生物利用度。
尽管CAP在食品药品领域的应用已取得较大进展,但由于CAP的强刺激性,在急性接触下可能会出现肿胀、恶心、呕吐、结膜炎和腹痛等急性副作用,故需对其使用剂量和作用时间开展进一步研究。目前,CAP的使用剂量、作用时间及实验模型的种类和条件差异较大,很难明确其发挥生物学效应的实际机制。因此,仍需深入开展体内、体外和临床研究,进一步了解CAP的作用机制。此外,用于荷载CAP的递送系统仍缺乏对不可控药效学组分及不利理化性质的研究,后期研究中应加强对具有较强特异靶向性、良好生物相容性及稳定性的CAP递送系统的开发。

