脂多糖干预后的不同滑膜细胞来源炎性外泌体对软骨细胞的作用机制研究
周 俊,郭长青,王庆甫
膝关节骨性关节炎(knee osteoarthritis,KOA)是由高龄、外伤、劳损、遗传、肥胖等因素引起的慢性无菌性炎症。基本的病理过程包括软骨降解和滑膜炎症。滑膜炎症可以出现于KOA病程的任意过程,且研究[1]表明,滑膜炎症常作为软骨炎症的前兆症状,并且与软骨退变、损伤、骨赘形成等临床症状多呈正相关[2-3]。TLRs/NF-κB信号通路介导的炎症反应与软骨细胞的坏死、凋亡关系密切[4]。正常的膝关节滑膜组织由A型滑膜细胞(巨噬细胞样滑膜细胞,macrophage-like synoviocytes,MLS)、B 型滑膜细胞 (成纤维细胞样滑膜细胞, fibroblast-like synoviocytes,FLS)组成[5]。外泌体(exosomes) 是一种由细胞主动分泌到胞外的具有脂质双层膜结构的微小囊泡,其在细胞间信息交流、功能调控方面发挥巨大的作用[6]。该研究拟通过离体实验观察炎性环境下不同滑膜细胞来源外泌体对于软骨细胞的影响,探讨不同细胞来源炎性外泌体干预软骨细胞的作用机制。
1 材料与方法
1.1 主要试剂人成纤维样滑膜细胞系、巨噬样滑膜细胞系(上海ATCC细胞库);DMEM培养基、胎牛血清(美国Bio-Rad公司);脂多糖(lipopolysaccharide,LPS)(美国Sigma公司);RYPSIN 0.25%胰酶(美国Invitrogen公司);外泌体提取收集试剂盒(北京恩泽康泰公司);乌磷酸(美国Sigma公司);96孔细胞培养板(美国Corning公司);CCK-8 试剂(南京诺唯赞公司);肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α) 、白细胞介素-1β(interleukin-1β, IL-1β)、IL-6 Elisa试剂盒(美国 abcam 公司) ;Toll样受体4(Toll-like receptor4, TLR4)、核因子κB(nuclear factor kappa-B,NF-κB)、核因子κB抑制因子激酶(inhibitor of kappa B kinase, IkK)、核因子κB抑制蛋白(inhibitor of NF-κB, IκB)、金属肽酶含血小板反应蛋白基元5(a disintegrin and metalloproteinase with thrombospondin motifs 5, ADAMTS5)单克隆抗体(美国 abcam 公司);辣根过氧化物酶标记山羊抗小鼠抗体(美国 abcam 公司)。
1.2 实验方法
1.2.1LPS诱导滑膜细胞炎症 将冻存的两种滑膜细胞分别置于37 ℃水浴箱中,不时摇动使其迅速融化后将细胞悬液转移至离心管中并利用离心机 1 000 r/min离心5 min,吸弃上清液,加入适量含有10% FBS和1%青霉素-链霉素双抗的无外泌体DMEM培养基重悬后,分别转移至培养瓶中,置于5%CO2,饱和湿度90%的37 ℃恒温培养箱中培养。稳定传代至3-4代后,各取2瓶FLS和MLS,加入新的含双抗无外泌体培养基后,在其中1瓶FLS及MLS中分别加入5 μl LPS/PBS溶液(1 μg/ml),另外两瓶滑膜细胞不做其余处理,干预24 h后收集两种细胞的上清液;将正常的3-4代FLS和MLS以1 ∶4 的比例接种于同一培养瓶中,加入含双抗无外泌体培养基,再加入5 μl LPS/PBS溶液(1 μg/ml)干预,模拟KOA环境,24 h后收集细胞上清液,分别置于-80 ℃冰箱中冻存,用于后续实验。
1.2.2用尺寸排阻加超滤法(SECF)提取细胞上清液中外泌体 将Exosupur柱固定在装置架上,使柱内温度与室温持平,打开柱子上下的封盖回收封柱液,将15 ml离心管置于柱子下方,从柱子顶部加入PBS进行冲洗,保持柱子湿润,冲洗完成后将细胞上清液从柱子顶部加入,收集底部流出液,前1 500 μl不用收集,之后收集的成分即为外泌体成分,将所得外泌体置于-80 ℃下保存备用。
1.2.3电镜观察两种细胞外泌体形态 将10 μl外泌体重悬液滴加在电镜的载样铜网上,室温下静置5 min,用滤纸从侧方将多余的液体吸干,滴加10 μl 4%磷钨酸溶液于铜网上,室温负染5 min。滤纸吸干负染液,白炽灯下烤干后,于透射电子显微镜下观察并在80 kV下成像。
1.2.4软骨细胞提取与培养 软骨组织取自于北京中医药大学第三附属医院行全膝关节置换术的膝骨关节炎患者,患者对实验过程完全知情并签署知情同意书,收集术中取出的废弃软骨组织并立即送至实验室进行细胞提取。该研究已通过北京中医药大学第三附属医院伦理委员会审查 (伦理号BZYSY-2019KYKTPJ-26)。
将术中取得的软骨组织用含1%双抗的PBS漂洗3次,用眼科手术剪将附着软骨块的软组织剪除,再剪为1 mm×1 mm×1 mm大小的碎片,加入约10倍体积的0.2%Ⅱ型胶原酶,使软骨碎片悬浮,放入5%CO2,饱和湿度90%的37 ℃恒温培养箱中过夜,用70 μm细胞过滤网过滤后,1 000 r/min离心5 min,获得软骨细胞。将细胞接种于培养瓶中,加入含双抗无外泌体培养基,置于培养箱中培养,选取第3-4代细胞用于后续实验。
1.2.5炎性滑膜细胞外泌体干预软骨细胞 取3-4代软骨细胞,分别置于5个培养瓶中,并标记Ⅰ-Ⅴ。在5组培养瓶中分别等量加入含双抗无外泌体培养基。将1.2.2中所得各组外泌体用生理盐水制备成混悬液(浓度为1×107/ml)。第Ⅰ、Ⅱ组软骨细胞中分别加入正常的MLS和FLS外泌体,第Ⅲ组加入2种细胞共培养的炎性外泌体,第Ⅳ、Ⅴ组加入分别加入炎性的MLS和FLS外泌体。各组干预24 h后,光镜下观察各组软骨细胞形态。分别收集各组软骨细胞及上清液并置于-80 ℃冰箱中冻存,用于后续实验研究。
1.2.6CCK-8法检测各组软骨细胞活力 取3-4代软骨细胞,计数,用培养基使软骨细胞悬浮,调整细胞浓度1×105个/ml,接种于96孔板,各孔加0.1 ml细胞悬液,分为5组,分别加入对应的外泌体混悬液:第Ⅰ、Ⅱ组软骨细胞中分别加入正常的MLS和FLS外泌体,第Ⅲ组加入两种细胞共培养的炎性外泌体,第Ⅳ、Ⅴ组加入分别加入炎性的MLS和FLS外泌体。放入恒温培养箱中过夜,用倒置相差显微镜观察各组软骨细胞形态。向每组孔中加入10 μl CCK-8溶液,放入恒温孵育箱中再次孵育3 h后使用酶联免疫检测仪在 450 nm双波长处测得相应吸光度值(absorbance,A)。
1.2.7ELISA法检测各组软骨细胞上清液中TNF-α、IL-1β、IL-6水平 将各组软骨细胞上清液室温解冻摇匀后,ELISA法检测其中中TNF-α、IL-1β、IL-6水平,按照试剂盒操作步骤执行,每个指标设置3个复孔。
1.2.8Western blot法检测软骨细胞中TLR4、NF-kB、IkK、IκB、ADAMTS5蛋白的表达 收集各组软骨细胞,用PBS洗涤细胞沉淀3次,1 000 r/min离心5 min,吸弃上清液后加入0.2 ml的蛋白裂解液和蛋白酶抑制剂混合液;4 ℃低温离心机12 000 r/min离心15 min后,取上清液置于新EP管中,标记分组。用BCA试剂盒进行蛋白浓度测定,取适量蛋白进行电泳,电泳完成后进行电转,将目标蛋白转移至PVDF膜上,室温下将膜完全浸没在3% BSA-TBST中轻摇30 min。用3% BSA-TBST稀释(1 ∶1 000)一抗,参照TLR4、NF-κB、IkK、IκB、ADAMTS5及内参β-actin等抗体说明书进行一抗标记,TBST清洗4次后,加入3% BSA-TBST稀释(1 ∶1 000)后的二抗室温孵育1 h,最后加入ECL试剂后显影。

2 结果
2.1 电镜下观察两种滑膜细胞外泌体形态电镜下可见两种外泌体均为颗粒直径为30~150 nm范围内的圆形或椭圆形膜性微囊泡结构,内含有致密的云状物质,为外泌体内容物。
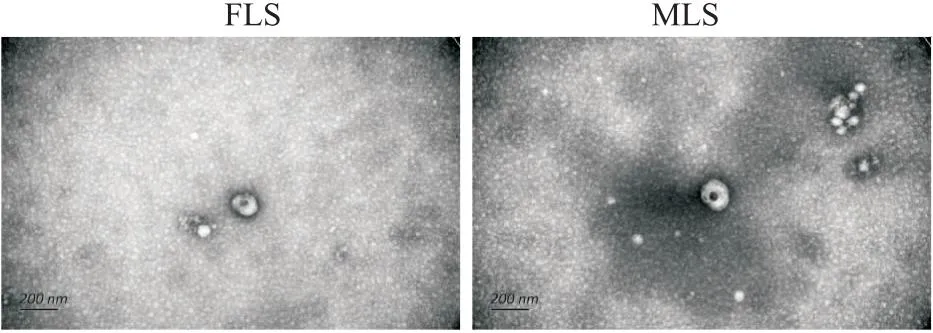
图1 电镜下观察两种滑膜细胞外泌体形态 ×500
2.2 各组软骨细胞的生长形态显微镜下观察正常外泌体干预的两组软骨细胞多为圆形、椭圆形及短梭形,贴壁生长,与未经干预的正常软骨细胞形态基本相似;炎性外泌体干预的三组软骨细胞形态出现不规则型,有较多的悬浮坏死细胞,细胞密度低于另外两组。见图2。

图2 各组软骨细胞生长形态 ×10
2.3 各组软骨细胞A值Ⅲ、Ⅳ、Ⅴ组软骨细胞活力低于Ⅰ、Ⅱ组(P<0.05)。Ⅰ、Ⅱ组细胞活力几乎没有差异。Ⅳ组细胞活力最低,Ⅲ组细胞活力高于Ⅳ组但低于V组(P<0.05)。见表1。
表1 各组软骨细胞A值
2.4 各组软骨细胞上清液中TNF-α、IL-1β、IL-6水平Ⅰ、Ⅱ两组细胞上清液中TNF-α、IL-1β、IL-6水平没有差异;Ⅲ、Ⅳ、Ⅴ组细胞上清液中TNF-α、IL-1β、IL-6水平高于Ⅰ、Ⅱ两组(P<0.05);Ⅲ组细胞上清液中TNF-α、IL-1β、IL-6水平高于Ⅳ组(P<0.05),但低于V组(P<0.05)。见表2。

表2 Elisa法检测各组细胞上清液中TNF-α、IL-1β、IL-6水平
2.5 各组软骨细胞中TLR4、NF-κB、IkK、IκB、ADAMTS5的表达量Ⅰ、Ⅱ两组软骨细胞TLR4、NF-κB、IkK、IκB、ADAMTS5的蛋白表达量没有差异;Ⅲ、Ⅳ、Ⅴ组软骨细胞TLR4、NF-κB、IkK、IκB、ADAMTS5的蛋白表达量高于Ⅰ、Ⅱ两组(P<0.05);Ⅲ组软骨细胞TLR4、NF-κB、IkK、IκB、ADAMTS5的蛋白表达量高于Ⅳ组(P<0.05),但低于Ⅴ组(P<0.05)。见图3、表3。

表3 各组软骨细胞中相关蛋白表达量与actin比值
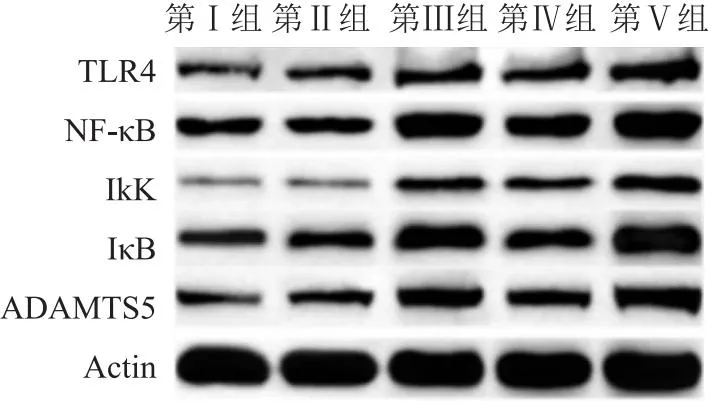
图3 Western blot检测各组软骨细胞TLRs/NF-κB信号通路相关蛋白表达印迹图
3 讨论
KOA是一种以滑膜炎症、软骨退变为主要病理变化的退行性疾病[6-10]。滑膜炎症导致滑膜细胞释放的炎性因子和基质蛋白酶是诱发软骨炎症、加重软骨损伤的重要因素[11]。人体膝关节滑膜组织主要由MLS和FLS两种细胞组成。MLS是来源于骨髓的巨噬细胞通过循环系统迁徙至滑膜下层,约占滑膜细胞总数的约20%,它可以吞噬关节腔内碎屑、异物并释放IL-1β、IL-6、TNF-α等细胞因子。FLS占滑膜细胞总数的约80%,它具有分泌透明质酸,合成胶原蛋白及分泌产生基质蛋白酶的功能[12]。外泌体携带有来自细胞的蛋白,脂质及核酸等物质。在细胞间信息交流和细胞功能调控方面发挥着重要作用[13]。不同细胞来源的外泌体具备不同的特点和功能。观察不同滑膜细胞来源的外泌体在炎症过程中的特点和功能差异,有助于进一步研究KOA的病理过程和治疗方法。TLRs/NF-κB信号通路可以调节膝关节滑膜及软骨细胞产生免疫和炎症反应。一般状态下,NF-κB与NF-κB抑制蛋白(IκB)结合成二聚体结构而处于活性抑制状态。在KOA中,由于软骨损伤或退化产生体内损伤相关分子模式( DAMPs)和炎性因子,Toll样受体是一类重要的模式识别受体(如TLR2、TLR4等),其可通过识别DAMPs而激活,并使得IkK活化,该激酶可以激活IκB,使其从二聚体上解离,激活NF-κB信号通路。产生IL-1β、IL-6、TNF-α等下游因子,引起滑膜和软骨炎症,同时产生MMP-13和ADAMTs等可以使软骨外基质降解,导致软骨细胞坏死[14]。
本研究中三组炎性外泌体干预后的软骨细胞均出现了细胞变形,悬浮,坏死的情况。说明炎性滑膜细胞外泌体可以影响软骨细胞活力。用CCK-8法观察各组软骨细胞活力,三组炎性外泌体干预组的软骨细胞活力比正常外泌体干预后的软骨细胞差,两种滑膜细胞共培养后的炎性外泌体干预后的软骨细胞活力高于炎性FLS外泌体而低于炎性MLS外泌体。ELISA法和Western blot法检测结果亦显示三组炎性外泌体组均可激活软骨细胞中TLRs/NF-κB信号通路并产生炎性因子,其中两种滑膜细胞共培养后的炎性外泌体致炎效果强于FLS外泌体而弱于MLS外泌体。在KOA中两种滑膜细胞均会产炎性因子,其中FLS还会一些抗炎因子如前列腺素和血管内皮生长因子等,同时巨噬细胞可以根据微环境的变化由具有促炎作用的M1型转化为具有生抗炎和组织修复作用的M2型[15]。有研究[16-17]通过成纤维细胞与巨噬细胞体外共培养,显示巨噬细胞的促炎因子释放得到抑制,这可能是由于成纤维细胞体表的CD14+蛋白的中和作用导致的。在本实验中,两种细胞共培养后MLS外泌体的致炎作用得到一定抑制,可能由于FLS外泌体对于MLS的炎性因子释放和M1、M2两种亚型的转变有一定的调控作用,有待进一步的实验验证。总之在KOA的炎症过程,两种细胞之间既可以相互促进炎症释放,又可互相抑制其致炎作用,处于促炎与抗炎的动态平衡中,而外泌体在两种细胞的信息交流中发挥了重要作用。
综上所述,在KOA疾病进展过程中,两种滑膜细胞来源外泌体均可通过调控软骨TLRs/NF-κB信号通路,促进软骨细胞外基质降解,加重软骨退变。两种细胞通过其外泌体进行细胞间信号交流,既可以相互促进又会抑制致炎效果。本实验为KOA的机制研究和临床用药开发提供了新的途径和思路。

