肠道菌群在类风湿性关节炎心脏损伤中的研究进展
秦 琼,蒋宝平,韩大飞 综述 周玲玲 审校
类风湿关节炎(rheumatoid arthritis,RA)是一种全身性炎症疾病。研究[1-2]显示,RA是心血管疾病发生的独立危险因素,其心血管事件相对危险性是健康人群的 2~5倍。RA患者早期易发生高血压、血脂异常、动脉粥样硬化等,更容易发生心衰、缺血性心脏病、冠心病、急性冠脉综合征、深静脉血栓栓塞症,甚至瓣膜病。在RA炎症期间[3],免疫细胞活化后产生的促炎细胞因子,如白细胞介素-6(interleukin- 6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),刺激局部交感神经纤维,导致交感神经系统过度激活,过量的肾上腺素被释放,心脏功能下降。Bissell et al[4]发现既往无心血管疾病史RA患者的左室收缩功能和左室质量指数下降。虽然炎症在RA晚期会消退,但心脏损伤仍在继续。
RA患者往往还会出现肠道炎症,肠道屏障被破坏,导致肠道菌群失衡,代谢产物和炎症因子释放,继而引发免疫细胞向心脏和全身迁移[5]。高脂饮食将导致K/BxN雌性小鼠血脂异常、踝关节肿胀和主动脉根部动脉粥样硬化加重,可能与显著降低阿克曼氏菌和狄氏副拟杆菌的丰度,并增加梭状芽胞杆菌群的丰度有关[6]。因此,全身炎症、肠道菌群和代谢产物被认为是RA致心脏损伤的关键因素。由于RA滑膜炎症发生的病理生理特征与心脏损伤的病理生理特征重叠,探讨这些共同途径是RA患者防治心脏损伤的迫切需要和主要挑战。现探讨肠道菌群及其代谢产物在RA发病和治疗过程中出现心脏损伤的作用。
1 肠道菌群在RA心脏损伤中的作用
1.1 肠道菌群调节炎症与免疫反应
1.1.1炎症反应 RA炎症因子表达模式与慢性炎症引起的心血管疾病类似,有IL- 6和TNF-α等[7]。此外,RA引起的慢性炎症可导致高血压,这是心血管疾病的另一个危险因素[8]。研究[9]表明,RA患者中普氏普雷沃菌的流行引发高水平脂多糖(lipopolysaccharide,LPS)和C-反应蛋白(C-reactive protein,CRP)的生理反应,包括TOLL样受体- 4(toll-like receptor- 4,TLR- 4)激活和IL-17升高,血小板增加,T细胞活化,蛋白尿导致慢性炎症状态和相关的心脏风险升高。随着CRP水平的升高,RA患者往往表现出与心脏风险增加相关的其他炎症标志物升高,包括红细胞沉降率,类风湿因子(rheumatoid factor,RF)和抗瓜氨酸蛋白抗体(anti-citrullinated protein antibody,ACPA)[10-11]。简而言之,RA患者中增多的普氏普雷沃菌通过LPS-CRP-蛋白尿机制增加心血管风险。
1.1.2免疫反应 在RA心肌病的动物模型K/BxN F1小鼠中,人重组膜联蛋白A1(recombinant human annexin A1,hrANXA1)通过调节心脏内的成纤维细胞和炎症细胞表型,纠正心脏舒张功能障碍[12]。研究[13]表明,分节丝状菌可以诱导肠道滤泡辅助性T细胞(follicular helper T cell, Tfh)分化和迁移到系统性淋巴细胞位点,导致自身抗体的产生,促进K/BxN小鼠模型关节炎进展。并通过限制IL-2进入CD4+T细胞诱导派尔集合淋巴结中的Tfh细胞分化。菌群失调通过影响T细胞亚群分化,导致Th17/Treg细胞比例失衡而诱发关节炎。随着Th17细胞的发育,组织损伤和易感个体激活局部免疫级联反应,可发展为系统性自身免疫反应,涉及心脏等多个器官。
1.2 肠道菌群代谢产物
1.2.1氧化三甲胺(trimethylamine N-oxide,TMAO) 有害代谢产物TMAO参与RA心脏损伤的病理机制包括[14-16]:① TMAO促进胆固醇前向运输,抑制胆固醇逆向运输,并改变巨噬细胞、泡沫细胞、内皮细胞的功能;② TMAO促进血小板聚集;③ TMAO激活丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)和活化B细胞的核因子κB(nuclear factor kappa-B,NF-κB)、NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3, NLRP3)-炎性小体、促炎细胞因子和黏附分子途径,并在内皮细胞和白细胞中驱动这些信号通路。在RA中,单核细胞和中性粒细胞在局部病变关节内产生促炎细胞因子TNF-α和 IL-1β,进入循环引发血管炎症和心脏损伤。因此,选择性作用于TMAO成为一个潜在的RA心脏损伤治疗策略。
1.2.2短链脂肪酸(short chain fatty acids,SCFAs) 研究[17]表明,RA患者心血管死亡风险与膳食纤维摄入量呈负相关。SCFAs可利用宿主无法消化的纤维。SCFAs维持肠道免疫稳态的主要机制包括调节血小板免疫功能和调控G蛋白偶联受体(G protein-coupled receptor,GPR)信号传导,参与动脉粥样硬化和高血压过程,进而影响心脏功能。活动性RA患者的血小板反应性显著升高[18]。在CIA小鼠模型中,SCFAs通过调节巨核细胞数量和血小板免疫调节功能,直接减轻关节炎症状[19]。SCFAs可以调节GPRs的活性,包括GPR41、GPR43和GPR109A,影响血管紧张素-肾素系统合成肾素来控制血压[20]。与野生型小鼠相比,GPR41基因敲除小鼠的收缩压较高,SCFAs通过激活内皮GPR41降低血压[21]。然而,SCFAs作为治疗靶点的潜力还需要进一步的深入研究。
1.2.3胆汁酸(bile acids,BAs) BAs可引起心脏重构和电生理改变,导致致命的心律失常。肠道菌群介导的胆盐水解酶(bile salt hydrolase,BSH)活性可以通过刺激胆固醇集聚、泡沫细胞形成和增加斑块大小,促进动脉粥样硬化进展[22]。BAs也可诱导T细胞向Treg分化,促进抗炎因子IL-10分泌,抑制促炎因子TNF-α、IL-2、IL-6和IL-17分泌[23]。在关节炎大鼠中,参与BAs代谢的双歧杆菌丰度增加,可以缓解炎症[24]。假小链双歧杆菌通过保护CIA小鼠肠道屏障和重塑肠道菌群组成,从而提高BSH活性和增加未结合的BAs水平,以抑制异常的Th1/Th17免疫应答,从而防止关节损伤;然而,这些作用可被胆汁酸受体TGR5(Takeda G protein-coupled receptor 5)拮抗剂消除[25]。因此,BAs可能通过激活TGR5来驱动代谢和炎症机制。
肠道菌群参与RA心脏损伤的机制[5,13]:① 细菌抗原引发滑膜炎症,吸引白细胞浸润组织;② 自身反应性细胞激活巨噬细胞,分泌细胞因子;③ 细胞因子诱导成纤维细胞产生基质金属蛋白酶和核因子κB配体受体激活因子,介导关节损伤,导致RA的发生;④ 炎症部位的CD4+T细胞活化,如RA患者滑膜近端淋巴结,导致CD4+T细胞分化,这些细胞通过循环向心脏迁移,导致心肌炎症和纤维化;⑤此外,TMAO、SCFAs、BAs途径可介导心脏损伤。如图1所示。
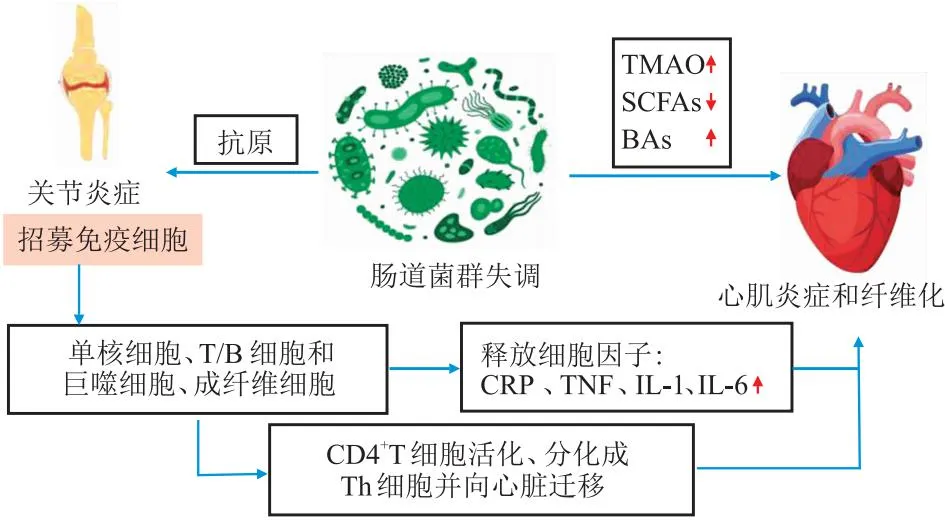
图1 肠道菌群介导的RA和心脏损伤机制
2 肠道菌群的治疗调节
2.1 直接调节肠道菌群
2.1.1补充益生菌 益生菌通过调节肠道菌群,维持适当的肠道通透性,下调异常的炎症反应。有证据[25-26]表明,补充嗜酸乳杆菌和干酪乳杆菌有助于降低血液中总胆固醇、低密度脂蛋白胆固醇以及CRP水平。益生菌附着到上皮细胞的信号级联调节免疫系统,减少氧化应激,从而减少与RA慢性炎症相关的心脏问题。
2.1.2粪便菌群移植(fecal microbiota transplantation, FMT )治疗 FMT被用于改善自身免疫性疾病的发病、减缓进展或抑制症状[27]。1例难治性RA患者经FMT成功治疗,RF降低,疾病活动度评分-28和残疾指数改善,提示FMT对RA可能有较好的治疗效果[28]。但是,FMT可接受性不高,男性较女性更能接受FMT[29]。目前,验证FMT在RA患者中疗效和可接受性的临床研究还在进行中。
2.2 间接调节肠道菌群
2.2.1化学抗风湿药物 控制RA的全身炎症和疾病活动性,以降低患者心脏损伤风险,是目前公认的防治观点[30]。RA患者肠道菌群的差异可能部分决定抗风湿药物的生物利用度和临床结局[31]。其中,MTX和TNF-α抑制剂被证明可以部分恢复RA患者正常肠道菌群组成[32-33]。MTX还可以通过释放腺苷,参与减少心梗后的梗死面积、炎症、心肌肥厚和心肌纤维化[34]。然而,有研究[35]认为这种治疗效果较小,不足以减少心肌梗死面积或改善心功能。因为炎症减少,RA患者通常受益于抗TNF-α治疗,这种影响在年轻患者和女性中尤为明显。不幸的是,在老年人群中,使用抗TNF-α与心衰恶化的风险增加有关。在RA治疗中,通过减少非甾体类消炎药和糖皮质激素的使用,也可以减少患者心血管风险[36]。低剂量、短期强的松龙(<7.5 mg/d)可能有助于降低RA患者心衰的发生率,≥7.5 mg/d 治疗组心衰的发生率增加[37]。因此,RA会导致心脏损伤,而迄今为止使用的任何治疗方法(生物制剂和MTX)都不足以阻止这种进展。
2.2.2传统中草药 黄芪、雷公藤、三七等均能通过调节肠道菌群,保护肠道屏障功能,从而防治心脏损伤。研究[38]显示,黄芪桂枝五物汤(huangqi guizhi wuwu decoction, HGWD)可减轻TNF-Tg小鼠踝关节滑膜炎症,减轻心肌肥大、心脏炎症浸润和纤维化,减轻肺部炎症和纤维化。HGWD能减少脱硫弧菌科、拟杆菌科的丰度,而这2个科的菌群与炎症密切相关,丰度越高,炎症越严重。HGWD有可能通过抑制肠道内炎症相关的菌群,进而达到治疗 RA 心脏损伤的作用。另外,雷公藤减少RA患者丝状芽孢杆菌和拟杆菌丰度[39]。体外实验[40]表明,雷公藤没有抗菌活性,对肠道菌群的影响可能是通过破坏胃肠道中的宿主细胞。来自于三七的人参皂苷Rh4显著抑制TLR4-MyD88-MAPK信号通路,增加SCFAs和BAs的水平,伴随着菌群多样性的改变[41]。
2.2.3膳食干预 大多数RA患者通过药物治疗降低心血管危险因素,针对RA患者可采取有针对性的生活方式干预[42]。除治疗药物外,膳食营养物质也会影响肠道菌群的组成和功能。素食中富含膳食纤维,可以改善RA患者的肠道菌群组成,减少关节疼痛。减少碳水化合物的摄入有助于改善肠道菌群和免疫功能的平衡。因此,膳食干预可能对RA心脏损伤的防治产生重要影响。

