奶牛隐性乳房炎病原菌的分离及药敏试验*
付新城,庞树坤
(1.河北省廊坊市农业局动物卫生监督所,河北廊坊065000;2.河北省涿州市动检站,河北涿州072750)
奶牛乳房炎[1](Mastitis)是奶牛最普遍的疾病,依其表现形式可分为临床型乳房炎和隐性乳房炎,临床型乳房炎主要表现为乳腺肿胀、坚硬,乳汁出现凝块、变色等,从临床外观即可确诊;隐性乳房炎不表现临床症状,隐蔽性强,发病率高,要用特殊的试验才能检出乳汁的变化,它不仅使奶产量减少,而且使乳的品质大大下降。奶牛乳房炎已成为制约奶牛养殖业发展的最重要的疾病之一,它不仅影响产奶量,降低牛奶的品质,还易延长产后发情和妊娠时间,甚至使病牛失去生产性能,造成严重的经济损失,而且危害人类健康,因而其防治问题已日益为人们所关注。据报道,全球约有2.2亿头奶牛,其中1/3的奶牛患有各类型乳房炎;国内关于乳房炎发病率的报道均在46%~70%之间,在丹麦,平均每头奶牛每年的损失估计超过200美元;仅美国每年因乳房炎造成的损失就达20亿美元,德国为4.5亿马克;其中70%的损失是来自隐性乳房炎引起的产奶量下降,中国每年此项损失为1.35亿元人民币[2-3]。
近年来,各地区的个体奶牛养殖业发展很快,但由于奶牛隐性乳房炎不易被发现,饲养管理水平差,疾病的防治技术落后,致使奶牛隐性乳房炎大面积存在;又因乱用和滥用抗生素的现象十分普遍,造成许多病原微生物产生耐药性,导致隐性乳房炎发展成严重的临床型乳房炎,给乳房炎的防治带来困难。
1 材料与方法
1.1 材料
1.1.1 动物 选择某奶牛场临床健康奶牛50头进行隐性乳房炎检测。
1.1.2 乳样采集 采集乳样之前消毒4个乳区,用1 g/L新洁尔灭;消毒乳头用750 mL/L酒精棉球。弃去前3把奶,每个乳区取乳样10 mL,盛于灭菌离心管中,送试验室检测。
1.1.3 仪器 离心管、离心机、接种环、载玻片、酒精灯、恒温培养箱、高压灭菌锅、光学显微镜、平皿、试管、电炉、玻璃棒、漏斗、烧杯和锥形瓶等。
1.1.4 培养基、试剂 CMT检测试剂(自己配制)。
分离用培养基,绵羊鲜血琼脂培养基、麦康凯琼脂、营养琼脂、营养肉汤、普通琼脂培养基。生化培养基及试剂,各种糖发酵管,三糖铁琼脂高层斜面,3%过氧化氢,65 g/L氯化钠琼脂平板,枸橼酸钠琼脂斜面,葡萄糖蛋白胨水,吲哚试剂,甲基红试剂,16%甲萘酚溶液,醋酸铅琼脂,尿素酶高层斜面,半固体琼脂柱,革兰染色液,马尿酸盐,pH9.6肉汤,40%胆汁,0.1%美兰牛奶。
1.1.5 药品 环丙沙星、氨苄西林、丁胺卡那霉素、氟哌酸、庆大霉素、链霉素、青霉素、林可霉素、克林霉素、先锋霉素V。
1.2 方法
1.2.1 隐性乳房炎的CM T检测 CMT法:即加利福尼亚乳房炎检测法。基本原理是用一种阴离子表面活性物质——烷基或烃基硫酸盐破坏乳中的体细胞,释放其中的蛋白质,蛋白质与试剂结合沉淀或凝胶。细胞中聚合的脱氧核糖核酸(DNA)是CMT产生阳性反应的主要成分。乳中体细胞数越多,产生的凝胶也就越多,凝结越紧密。
每个乳样取2 mL于测试盘中消泡后,加入等量乳房炎指示剂混合后据混合液的浓度来判断牛奶中体细胞的含量,并据此检测奶牛乳房的健康状况。判定标准见表1。
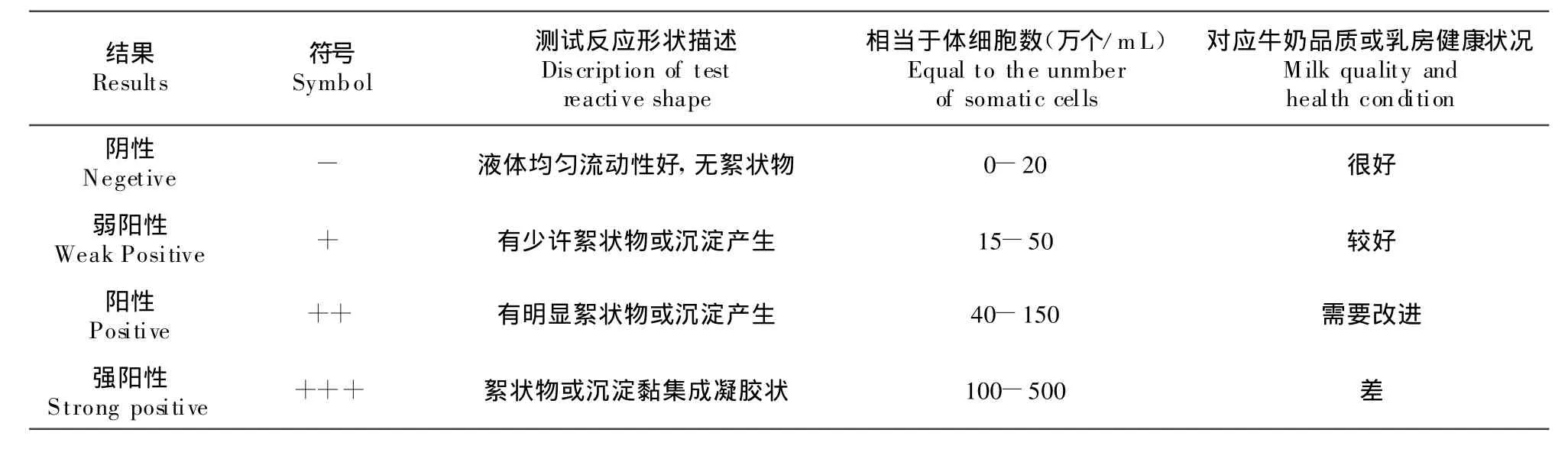
表1 CM T法判定标准Table 1 Criteria for CM T
1.2.2 细菌分离与培养 选取隐性乳房炎CMT法检测为阳性得乳样,将其3 500 r/min离心20 min,取沉淀物,以接种环划线的方法接种于鲜血琼脂平皿、麦康凯琼脂平皿,置37℃恒温培养箱培养24 h~48 h,观察菌落生长情况及形态特征,挑取典型单个菌落涂片,革兰染色,镜检。根据菌落形态特征、溶血与否、染色特性及菌体形态初步判定细菌类属[4-5],将其分为葡萄球菌、链球菌、革兰阴性杆菌和革兰阳性杆菌等四大类。并进一步纯化培养,最后将纯培养物接种于血液琼脂斜面,低温冷藏于冰箱供生化试验用。
1.2.3 病原菌的生化鉴定[5-7]根据菌落形态特征、革兰染色特性及镜检形态等将各分离纯化的细菌基本分类并将其分别接种于鲜血琼脂斜面,37℃培养24 h。按表2方法进行生化鉴定。

表2 奶中常见链球菌的生化特性[8]Table 2 Biochemical characteristics of Streptococcus in milk
1.2.3.1 葡萄球菌 以标准金黄色葡萄球菌为对照,对待鉴定的葡萄球菌进行兔血浆凝固酶试验,据试验结果将其分为金黄色葡萄球菌和凝固酶阴性葡萄球菌。
1.2.3.2 链球菌 将细菌纯培养物按链球菌鉴定程序和表1~表3各项进行鉴定。
链球菌鉴定程序:


表3 奶牛乳房炎主要革兰阴性杆菌的生化特性[4,8]Table 3 Biochemical characteristics of Gram-negative bacteria in cow masitis
革兰阳性杆菌:根据镜检有无芽孢将其分为革兰阳性芽孢杆菌和其他革兰阳性杆菌。
1.2.4 药物敏感试验
1.2.4.1 药敏片制备 用打孔器将定性滤纸制成直径为6 mm的纸片,每50片放入一个洁净干燥的青霉素小瓶中,高压蒸汽灭菌30 min,取出后放入温箱,干燥备用,各种药物按常规方法配制成所需浓度(表4)。用微量移液器向装有纸片的小瓶中分别加入配制成的各种药液0.25 mL用无菌镊子轻轻翻动,使滤纸片均匀吸静药液,放入4℃冰箱冷藏3小时取出,将药敏片平铺在灭菌平皿中放入37℃温箱中干燥后,放入灭菌青霉素小瓶中加盖灭菌橡皮塞,4℃保存备用。

表4 药敏片含药浓度T able 4 The concentration of sensitivity tablet
1.2.4.2 操作方法 选择从不同乳样中分离出的典型菌株:金黄色葡萄球菌、链球菌和大肠埃希菌分别均匀划线接种于血琼脂平皿,以纸片法[9]进行药物敏感试验。所选抗菌药物有:青霉素G、氨苄西林、链霉素、庆大霉素、丁胺卡那霉素、先锋霉素、克林霉素、环丙沙星、氟哌酸和林可霉素共十种常用抗菌药。抗菌效果判定:青霉素G和氨苄西林对葡萄球菌的抑菌直径≥29mm为敏感,≤28 mm为不敏感;对链球菌抑菌直径≥28 mm为敏感,≤19 mm为不敏感;其它药物抑菌直径≥20 mm为高敏;15 mm~20 mm为中敏;≤15 mm为不敏感。
2 结果
2.1 CMT法检测结果
CMT法检测200个乳样中84个呈现阳性,116个呈现阴性,乳区阳性率为42%,其中强阳性或强阳性以上的为54个;84个阳性乳样取自28头奶牛,头阳性率为56%。结果见表5。

表5 乳房炎检测结果Table 5 The detection results of mastitis
2.2 细菌分离鉴定结果
对84个阳性乳样进行细菌分离培养和鉴定,结果有72个乳样检出13种共98个菌株。其中葡萄球菌44株,占44.90%;链球菌20株,占20.40%,大肠埃希菌11株,占11.22%.详见表6。由葡萄球菌、链球菌、和大肠埃希菌引起的乳房炎占整个比例的71.43%。而另一个强阳性乳样则未分离出细菌,可能为非特异性乳房炎或者是由其他病原微生物引起。

表6 奶牛乳房炎病原菌分离鉴定结果T able 6 Isolation and identification of bacatria from cowmatitis

表7 病原菌混合感染情况T able 7 Pathogenic bacteria of mixed infection
从表6和表7中结果可以看出,单纯由某一种病原菌引起的乳房炎较少,而多数是由2种~3种甚至是3种以上的病原菌引起,混合感染的情况比较严重。
2.3 药敏试验结果
对三批不同乳样的3种主要病原菌进行药敏试验,结果表明葡萄球菌对弗哌酸、环丙沙星、庆大霉素和丁胺卡那霉素高度敏感,对林可霉素、克林霉素和先锋霉素比较敏感,而对青霉素则基本耐药;链球菌则对庆大霉素和丁胺卡那霉素敏感性较高;环丙沙星、林可霉素、庆大霉素和丁胺卡那霉素对大肠埃希菌较敏感。结果见表8。

表8 主要病原菌药敏试验结果Table 8 Drug sensitivity test of main pathogenic bactriamm
3 讨论
本试验对50头奶牛的乳样进行了检测,从检测的结果来看隐性乳房炎的头阳性率为56%,乳区阳性率为58%,这个结果与国际上公布的50%接近,与各地区比较发现,与杨章平报道的阳性率为54.1%、双金报道的61.84%(头阳性率)基本一致,说明该地区牛场隐性乳房炎的发病率比较低,但患牛乳区阳性率偏高。这说明该地区奶牛场的管理水平和卫生条件良好,但仍存在不足。
通过对阳性乳样的分离鉴定,共得到13种98个菌株。其中葡萄球菌的感染率最高,为44.90%,链球菌占20.40%,大肠埃希菌杆菌占11.22%。这说明该地区奶牛乳房炎以葡萄球菌为主要病原菌,而且以2种~3种病原菌感染为主,甚至由3种以上病原菌感染,而单纯由某一种细菌感染的情况较少,混合感染相当严重,可能这与牛场的消毒管理不严有一定的关系。混合感染是由两种以上的病原微生物同时参与的感染,其表现严重而复杂,给奶牛隐性乳房炎的诊断和治疗增加了困难。因此我们必须切实强化卫生意识,加强挤奶过程中的各项卫生管理,改善牛舍的的环境卫生,是防治奶牛隐性乳房炎工作的重中之重。
金黄色葡萄球菌和无乳链球菌是传染性致病菌,其传播主要发生在挤奶过程中,如通过擦洗乳房用的毛巾、水、挤奶员的手、挤奶杯等传播,而表皮葡萄球菌、停乳链球菌、乳房链球菌、化脓链球菌、大肠埃希菌等一些革兰阴性杆菌属于环境性致病菌,其传播主要通过牛体、褥草、粪便、泥土等。传染性致病菌的危害比较大只要感染机体,就会形成传染源,即使感染牛本身不发病,也会传染给其他牛,导致疾病的发生,因此,对于这种传染性病原菌,应及早发现及早之治疗,控制传染源减少感染机会,尤其应注意切断感染途径。而环境性致病菌主要存在于周围环境中,不可能完全消灭,当牛的抵抗力降低时,又可能引起发病,本试验中在隐性型乳房炎的乳之中分离出的环境性致病菌所占的比例较大,但并未引起发病,是因为少量的环境性致病菌侵入机体,机体的自身抵抗力强而不发病,因此经常保持牛舍内外的干燥清洁,牛体的清洁卫生,就可降低环境性致病菌的感染,减少隐性乳房炎的发病率。
本试验仅对常用的药物作了药敏试验,希望能通过体外药敏试验选择出一种低毒,低残留的有效药物。从试验结果上看,喹诺酮类药物以杀菌作用强、毒副作用小、经济实用等特点,是用抗生素治疗奶牛乳房炎疾病效果最好的,应广泛使用。
奶牛乳房炎的主要病原菌中绝大部分对青霉素、链霉素耐药,用传统的青链霉素疗法效果已几乎无效,但对庆大霉素、丁胺卡那霉素、氟哌酸和环丙沙星等敏感性较高,这可能与在治疗奶牛乳房炎方面较少使用这些药物有关。随着抗菌药物[10]的广泛应用和耐药菌株的增多,细菌对常用抗生素的耐药性越来越强,这不仅给奶牛乳房炎治疗的选择用药带来很大困难,而且这些存在于质粒或染色体的耐药基因可以接合的方式在个菌株、动物和人类之间传播,给人类用药带来很大问题。随着人们对绿色消费需求的提高,建议有关部门加强用药新途径[11-12],如使用疫苗、纯中药制剂等防治奶牛乳房炎,同时各养殖户也应加强“预防为主,防治结合”的思想意识,加强对奶牛的饲养管理,不乱用、滥用抗生素,为人类健康减少一份威胁,增添一份安全。
该奶牛场CM T法检测表明隐性乳房炎的头发病率为56%,乳区阳性率为42%。通过对阳性乳样的细菌分离鉴定,共得到13种98个菌株。其中葡萄球菌的感染率最高,为44.90%,链球菌占20.40%,大肠埃希菌杆菌占11.22%。这说明该地区奶牛隐性乳房炎以葡萄球菌、链球菌和大肠埃希菌为主。药敏试验结果表明引起该牛场奶牛隐性乳房炎的主要病原菌中绝大部分对青霉素、链霉素耐药,用传统的青链霉素疗法效果已几乎无效,但对庆大霉素、丁胺卡那霉素、氟哌酸和环丙沙星等敏感性较高。
[1] 卜仕金,陈杖榴,冯其辉,等.奶牛乳房炎的抗菌药物治疗[J].兽药与饲料添加剂,1999(4):14-20.
[2] 鲁希英等,单味木鳖子和神效瓜蒌散治疗奶牛隐性乳房炎的研究[J].中国兽医医药杂志,1996,26(2):16-17.
[3] 伍义行,黄利权.奶牛乳房炎防治的免疫学和药理学机制[J].中国兽医杂志,2003,39(3):40-44.
[4] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[5] 袁永隆,张永欣,侯奕昭,等.奶牛乳房炎乳汁细菌的分离和鉴定程序[J].中国兽医科技,1991,21(2):7-10.
[6] 徐冬梅,刘广深,常 新.高效液相色谱法测定动物组织中3种抗生素残留量[J].中国公共卫生,2002,2(18):233-234.
[7] 李俊锁,邱月明,王 超.兽药残留分析[M].上海:上海科学技术出版社,2002.
[8] 陆承平.兽医微生物学[M].北京:中国农业出版社,2001:204-223.
[9] 陈坤永,翁良树,吴慕贞,等.深圳地区奶牛临床型乳房炎病原菌分离鉴定与药敏试验[J].中国兽医科技,1999,29(9):362.
[10] Sandholm M,Kaartinen L,Pyaerc S.Bovine mastitis-why does antibiotic therapy not always work?An overview[J].J Vet Pharmacol T herap,1990,13(3):248-260.
[11] 曾振灵,冯淇辉.兽用氟喹诺酮类药物研究与临床应用进展[J].中国兽医科技,1995,25(3):39-41.
[12] 曹随忠,杜立新,赵兴绪.奶牛乳房炎相关基因的功能基因组学研究进展[J].甘肃农业大学学报,2004,39(3):239-241.

