依那普利对大鼠树突状细胞功能的干预效应*
吕永恒,陈 琪,黎洪展,黄光胜
(南方医科大学中医药学院中西医结合临床教研室,广州510315)
目前研究认为动脉粥样硬化(atherosclerosis,AS)过程不仅是脂质在动脉壁中的积聚,而是一种慢性炎症疾病[1],也有学者提出AS是一种自身免疫性疾病[2]。树突状细胞(dendritic cell,DC)是目前发现的功能最强的专职性抗原提呈细胞,在特异性细胞免疫和体液免疫中均起着十分重要的作用[3]。近年来研究发现DC在AS斑块中聚集增多,提示其免疫机制可能参与了AS的发生和发展,抑制免疫炎症反应可能是抗AS的新途径[4]。临床及实验证实,血管紧张素转化酶抑制剂(ACEI)的应用可部分逆转 AS或对 AS起到预防作用,但其机制尚未完全明确,ACEI对炎症反应的抑制可能是其中之一[5]。目前ACEI对DC的作用尚少有报道。本研究探讨了AS大鼠DC的功能状态,为DC参与AS的病理过程提供实验依据,并观察了ACEI类药物依那普利(Enalapril)对大鼠树突状细胞功能的影响,以进一步阐明ACEI对免疫功能的可能影响以及ACEI防治AS的可能机制。
1 材料与方法
1.1 材料 RPMI1640(L-glutamine)培养基、胎牛血清(FBS)购自Gibco公司;淋巴细胞分离液购自天津灏洋生物制品有限公司;四唑盐(M TT)、二甲亚砜(DSMO)购自广州威佳公司;重组鼠粒细胞巨噬细胞集落刺激因子(rmGM-CSF)、重组鼠白介素-4(rmIL-4)购自英国Peprotech公司;PE antimouse CD86(B7-2)单抗购自 Biolegend公司;IL-1β、TNF-α试剂盒购自深圳晶美公司;依那普利购自常州制药厂;Wistar大鼠购自南方医科大学实验动物中心。
1.2 方法
1.2.1 建立大鼠AS模型 雄性Wistar大鼠30只,体质量(210±10)g,随机分为3组,正常对照组(n=10);AS组(n=10),口服依那普利组(n=10)。大鼠分组后,饲以不同饮食,正常对照组为普通饮食;AS组饲以高脂饮食(参照文献[6]方法造模,其饲料配制是:4%胆固醇、10%猪油、0.2%甲基硫氧嘧啶、86%基础饲料,基础饲料中面粉 20%、米粉 2%、玉米20%、麸皮25%、豆料20%、骨粉 2%、鱼粉2%);口服依那普利组饲以高脂饮食同时予蒸馏水灌胃法饲以依那普利0.5 mg◦kg-1◦d-1,4周后实验。
1.2.2 DC制备 抽取大鼠静脉血20 mL,淋巴细胞分离液中离心(2 000 r/min,20 min),收集单个核细胞(PBMC),PBS液冲洗2次,RPMI1640冲洗1次,用完全RPM I1640培养基(含10%FBS)在6孔培养板中培养2 h(37℃、5%CO2),吸除非贴壁细胞。贴壁细胞用完全 RPMI1640培养基(含10%FBS、rmGM-CSF 100 ng/mL、rmIL-4 500 u/mL),置 37 ℃、5%CO2培养箱中培养7 d,24 h换液1次。收集第7天的悬浮细胞即DC进行实验。
1.2.3 DC形态 于培养第 1、3、5、7天在倒置显微镜下观察DC形态。
1.2.4 流式细胞学分析 收集DC细胞,用PE标记的CD86(B7-2)单抗标记细胞,用流式细胞仪(FACS,美国 BectonDickinson)检测。
1.2.5 混合淋巴细胞反应(M LR)反应中T淋巴细胞来自其他大鼠的PBM C,经尼龙毛柱分离后,得到纯的T淋巴细胞。浓度为2×105/mL的T淋巴细胞与浓度为2×104/mL的DC各100μ L在96孔平底培养板中37℃、5%CO2条件下混合培养,第4天吸取上清液,-20℃冻存备测细胞因子,沉淀细胞加M TT液(25 μ L/孔),继续培养 4 h后每孔加DMSO100 μ L,波长570 nm处测 A值(代表刺激 T淋巴细胞增殖能力)。
1.2.6 细胞因子测定 酶联免疫吸附法(ELISA法)分别检测保存的MLR上清液细胞因子 IL-1β和TNF-α浓度,操作严格按试剂盒说明进行。
1.3 统计学方法 应用SPSS10.0软件系统分析,所有资料采用表示,组间差异采用单向方差分析(One-way ANOVA),以P<0.05为差异有统计学意义。
2 结 果
2.1 DC形态学特点 本研究借鉴前人经验[7],成功培养出DC并进行鉴定,培养第7天的 DC表达 CD1а阳性率为92%。光学显微镜下可见细胞表面伸出树突样结构,长短不一,呈簇状生长,为典型的DC形态。3组DC形态无差异。
2.2 CD86表达率 结果显示,DC培养第7天,AS组DC表面CD86表达明显高于对照组(P<0.001);AS经应用依那普利干预组的DC表面CD86表达明显低于AS组(P<0.001)(见表1)。
2.3 M LR AS组DC刺激T细胞增殖的能力明显高于对照组DC(P<0.001);AS经应用依那普利干预组DC刺激T细胞增殖的能力明显低于AS组DC(P<0.001)(见表1)。
表1 依那普利对DC功能的影响
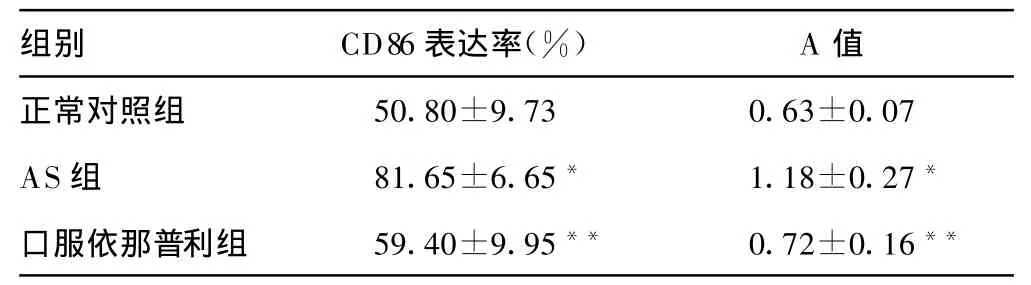
表1 依那普利对DC功能的影响
与正常对照组比较,*:P<0.001;与AS组比较,**:P<0.001。
组别 CD86表达率(%)A值正常对照组 50.80±9.73 0.63±0.07 AS组 81.65±6.65* 1.18±0.27*口服依那普利组 59.40±9.95** 0.72±0.16**
2.4 细胞因子测定 AS组M LR上清液中促炎细胞因子IL-1β、TNF-α高于对照组(P<0.001),AS组和依那普利组 MLR上清液中促炎细胞因子IL-1β、TNF-α低于 AS组(P<0.001)(见表2)。
表2 MLR上清液中细胞因子浓度(pg/mL

表2 MLR上清液中细胞因子浓度(pg/mL
与正常对照组比较,*:P<0.001;与AS组比较,**:P<0.001。
组别 IL-1β TNF-α正常对照组 13.4±5.12 9.5±2.18 AS组 22.2±4.40* 18.2±6.52*口服依那普利组 15.6±5.38** 13.6±5.88**
3 讨 论
目前研究认为免疫机制参与了AS的发生发展,在AS斑块中有大量免疫炎性细胞如T淋巴细胞、巨噬细胞等[8]。最近发现在AS斑块中DC亦聚集增多[4]。DC是体内效应最强的专职性抗原呈递细胞,原始T细胞被激活的前提是DC提呈的MHC抗原的识别[9-10],以及共刺激分子CD86(B7-2)与其在T细胞表面的受体CD28的配对[11],共刺激分子的缺乏可诱导特异性T淋巴细胞的免疫耐受,使局部炎性细胞对特异性抗原无反应[12]。
已有研究表明[13-14],ACEI具有抗AS作用。ACEI是通过抑制循环和组织局部的血管紧张素转化酶(ACE)使血管紧张素Ⅱ(AngⅡ)水平降低而发挥效应的。研究表明,几乎所有的RAS成分均在免疫细胞中表达,AngⅡ可以由免疫细胞产生并直接作用于免疫细胞,通过自分泌方式调节免疫细胞功能,干预RAS可以调节T淋巴细胞的增生、凋亡,甚至抗原递呈细胞的抗原递呈作用;在体内,ACEI类药物卡托普利对一些免疫介导的疾病有保护作用,如心肌炎、慢性移植排斥反应等,说明ACEI对免疫功能有一定的调节作用。有研究认为AngⅡ及其受体在DC中有高表达,AngⅡ可能介导了先天及获得性免疫反应的起始过程[15]。Danilov等[16]研究认为ACE可能参与了DC抗原的提呈。以上研究结果提示ACEI可能对DC的作用有一定影响。但其具体作用目前尚未见报道。本研究结果表明,DC在AS时处于激活状态。表现在DC表面共刺激分子CD86表达的明显升高,对同种异体T淋巴细胞的促增殖能力增强,T淋巴细胞分泌炎性因子增加。由于DC刺激同种异体T淋巴细胞增殖作用的强度与其表面共刺激分子表达有关,共刺激分子表达率越高,对T淋巴细胞的刺激能力越强[17],因而AS时可能通过DC表面CD86等共刺激分子的差异表达,从而使抗原递呈功能增强,T淋巴细胞过度活化,激活局部免疫反应。
本研究结果显示,应用依那普利并不影响单个核细胞向DC的分化,但可抑制AS大鼠DC表面共刺激分子CD86的表达,从而抑制其成熟和抗原呈递功能。经依那普利处理的DC对同种异体T淋巴细胞的促增殖能力下降,从而避免了T细胞在局部的聚积,同时促炎性因子分泌明显减少。低表达CD86的DC可诱导特异性T淋巴细胞的免疫耐受,使局部炎性细胞对特异性抗原无反应[11]。低表达CD86的DC诱导T淋巴细胞分泌活动降低,表现在促炎性细胞因子IL-1β、TNF-α等分泌减少,通过抑制局部平滑肌增生,单核巨噬细胞的聚集、泡沫细胞的形成等作用,影响AS的发生发展过程[18]。由于DC对损伤抗原提呈不足,相应的免疫炎性反应受到抑制,对血管壁的损伤相应降低,AS斑块的稳定性增加,动脉斑块进展得以减缓,从而延缓了AS的进展过程。本实验结果表明,ACEI可通过降低DC表面共刺激分子的表达从而抑制DC介导的免疫炎性反应,进一步达到干预AS的发生与发展的目的。基于ACEI对ACE及AngⅡ的影响,推测此作用的机制可能是ACEI通过拮抗DC细胞内的ACE,细胞内AngⅡ水平降低,抑制了DC的抗原提呈能力,甚至引起T淋巴细胞的免疫耐受,从而抑制了DC引起的免疫损伤反应。但其确切机制尚需进一步研究。
综上所述,作为最强的抗原提呈细胞,DC介导的免疫机制参与了AS的发生与发展,ACEI对DC的抑制可能是其抗AS的机制之一。但DC参与AS发病的具体过程,AS时DC激活,迁移以及ACEI对其影响的机制等需要深入的研究探讨。
[1]Ross R.Atherosclerosis is an inflammatory disease[J].Am Heart J,1999,138(5):419.
[2]Wick G,Xu Q.Atherosclerosis is a paradigmatic disease of the elderly,the roots of which are laidin youth,whereas the clinically manifested consequences become evident at old age[J].Exp Gerontol,1999,34(4):559.
[3]Cao X,Zhang W,He L,et al.Lymphotaccin genemodified bone marrow dendritic cells act as more potent adjuvants for peptide delivery to induce specific antitumor immunity[J].J Immunol,1998,161(11):6238.
[4]Bobryshev YV,Lord RS.S-100 positive cells in human arterial intima and in atherosclerotic lesions[J].Cardiovasc Res,1995,29(5):689.
[5]Cunha V,Tham DM,Martin-M cNulty B,et al.Enalapril attenuates angiotensin Ⅱ-induced atherosclerosis and vascular inflammation[J].Atherosclerosis,2005,178(1):9.
[6]苗明三.实验动脉和动物实验技术[M].北京:中国中医药出版社,1997:199.
[7]Chapuls F,Rosenzwajg M.Differentiation of human dendrtic cell from monocytes in vitro[J].Eur J Immunul,1997,27(2):431.
[8]Hansson GK,Libby P,Schonbeck U,et al.Innate and adaptive immunity in the pathogenesis of atherosclerosis[J].Circ Res,2002,91:281.
[9]Banchereau J,Steinman RM.Dendritic cells and the control of immunity[J].Nature,1998,392:245.
[10]蒋东波,杨锡强.哮喘患儿外周血树突状细胞共刺激分子表达研究[J].重庆医学,2003,32(4):396.
[11]Carreno BM,Collins M.The B7 family of ligands and its receptors:new pathways for costimulation and inhibition of immune responses[J].Annu Rev Immunol,2002,20:29.
[12]Steinman RM,Hawiger D,Liu K,et al.Dendritic cell function in vivo during the steady state:a role in peripheral tolerance[J].Ann NY Acad Sci,2003,987:15.
[13]廖宏荣,龚建平.血管紧张素所致炎症机制研究新进展[J].重庆医学,2006,35(15):1409.
[14]苏江利,郭春杰.动脉粥样硬化药物治疗进展[J].山东医药,2006,46(5):77.
[15]Lapteva N,Nieda M,Ando Y,et al.Expression of reninangiotensin system genes in immature and mature dendritic cells identified using human cDNA microarray[J].Biochem Biophys Res Commun,2001,285(4):1059.
[16]Danilov SM,Sadovnikova E,Scharenborg N,et al.Angiotensin-converting enzyme(CD143)is abundantlyexpressed by dendritic cells and discriminates human monocyte-derived dendritic cells from acute myeloid leukemiaderived dendritic cells[J].Exp Hematol,2003,31(12):1301.
[17]Wolfrum S,Richard G,Dominiak P,et al.Apstatin,a selective inhibitor of aminopeptidase,reduces myocardial infarction size by a kinin dependent pathway[J].Br J Pharmacol,2001,134(2):370.
[18]Steinbrink K,Jonuleit H,Muller G,et al.Interleukin-10-treated human dendritic cells induce a melanoma-antigenspecific anergy in CD8(+)T cells resulting in a failure to lyse tumor cells[J].Blood,1999,93(5):1634.

