RNAi对肝癌细胞放射增敏的实验研究*
李高峰,王宏梅,陈龙华△
(1.广西柳州市工人医院肿瘤科 545005;2.南方医科大学南方医院放疗科,广州510515)
原发性肝癌是中国常见的恶性肿瘤之一,具有发病率高、进展快、疗效差、死亡率高等特点,首选的治疗手段是手术,但大多数患者丧失了手术机会,放射治疗已成为肝癌非手术治疗的重要手段。由于肝细胞的耐受量低于肝癌细胞的根治量,且放疗中存在的辐射抗拒,导致疗效不满意,为了能够降低辐射抗性而达到放疗增敏作用,作者以前的研究成功地对HepG2细胞的 ATM基因进行沉默,本研究对 ATM基因沉默的HepG2细胞进行放射,观察 RNA干扰(RNA interference,RNAi)前后HepG2细胞的生长情况及放射生物学参数,评价是否具有放射增敏作用。
1 材料与方法
1.1 材料 HepG2肝癌细胞株为南方医科大学病理教研室自存;T RIzol和 LipofectaminTM2000购自 Invitrogen公司;DNAaseⅠ购自上海生工生物公司;Reverse Transcription System试剂盒购自Promega公司,直线加速器:美国Varian公司。
1.2 细胞培养 肝癌细胞株HepG2采用含10%胎牛血清的RPMI-1640培养基培养;送至37℃、5%CO2培养箱内培养,取生长状态良好的细胞用于实验。
1.3 细胞照射 将指数生长细胞用0.25%胰酶消化后,制成单细胞悬液,计数细胞悬液浓度,然后稀释成1×104/mL、2×104/mL、4×104/mL、1×105/mL 4组不同的浓度梯度,分成6组,接种于直径 9 cm 的玻璃培养皿中,按 0、2、4、6、8、10 Gy 共6个剂量组给予照射,采用varian2100C直线加速器6 MV X线为放射源,源皮距照射,剂量率200 cGy/min,SSD=100 cm,PDD=80%,照射野100 mm×100 mm,并用有机玻璃进行组织补偿。每个剂量点3个平行样本,每组实验重复3次。
1.4 集落形成实验 照射后将细胞置于37℃孵箱,5%CO2进行培养,连续10~14 d。终止培养后常规以PBS缓冲液洗涤细胞2次,经甲醇固定后采用姬姆萨(Giemsa)染液染色,在普通光学显微镜下计数细胞数大于50的细胞克隆,计算克隆形成率(克隆形成率=生成的克隆数/接种细胞数×100%)以及存活分数(survival fraction,SF),SF=受照射细胞的克隆形成率/对照组细胞克隆形成率×100%。
1.5 放射生物学参数的获取及剂量存活曲线的绘制 以3次照射的存活分数均值进行分析,运用GraphPad公司Prism 5.0软件进行单击多靶模型和L-Q线性模型曲线拟合,绘制出剂量存活曲线。根据单击多靶模型求出D0、Dq、N和SF2(survival fraction at 2 Gy),其中logN=Dq/D0,根据线性二次模型求出α、β、α/β 值及 SF2。放射增敏比(sensitizing enhencement ratio,SER),SER=干扰前组SF2/干扰后组SF2。
表1 HepG2细胞RNAi前后集落形成率和细胞存活率(n=3
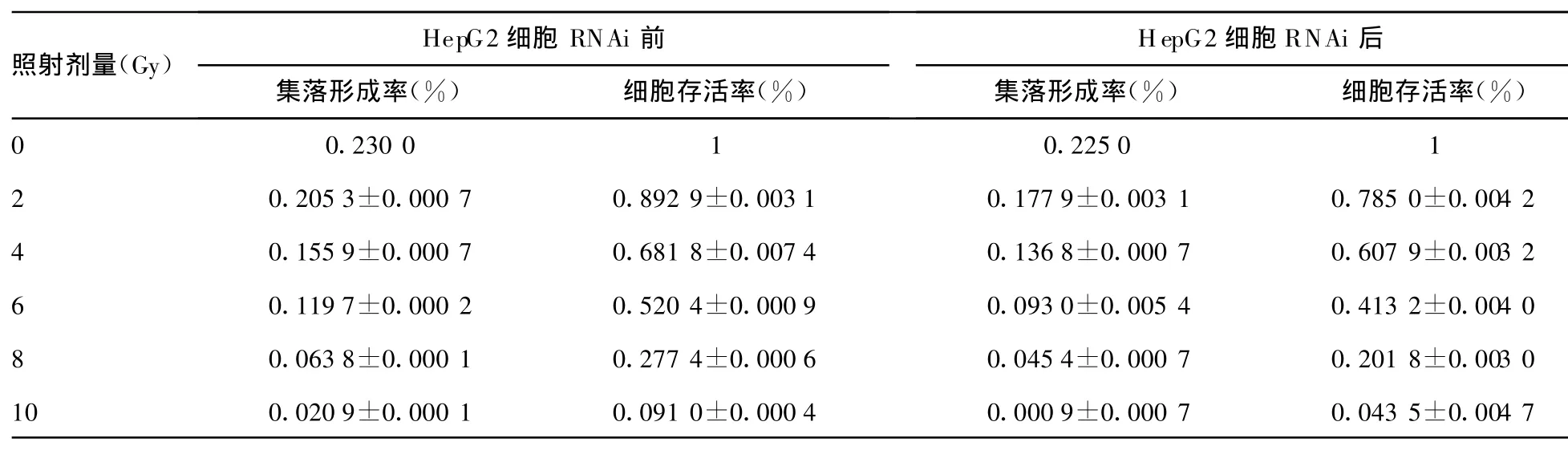
表1 HepG2细胞RNAi前后集落形成率和细胞存活率(n=3
HepG2细胞 RNAi前HepG2细胞RNAi后照射剂量(Gy)集落形成率(%)细胞存活率(%)集落形成率(%)细胞存活率(%)0 0.230 0 1 0.225 0 1 2 0.205 3±0.000 7 0.892 9±0.003 1 0.177 9±0.003 1 0.785 0±0.004 2 4 0.155 9±0.000 7 0.681 8±0.007 4 0.136 8±0.000 7 0.607 9±0.003 2 6 0.119 7±0.000 2 0.520 4±0.000 9 0.093 0±0.005 4 0.413 2±0.004 0 8 0.063 8±0.000 1 0.277 4±0.000 6 0.045 4±0.000 7 0.201 8±0.003 0 10 0.020 9±0.000 1 0.091 0±0.000 4 0.000 9±0.000 7 0.043 5±0.004 7
2 结 果
RNAi前后HepG2细胞经过照射后,计算出各剂量组细胞集落形成率和细胞存活率,见表1。将各实验组得到的数据输入Prism5.0软件,进行单击多靶模型和L-Q线性模型曲线拟合,绘制出剂量存活曲线见图1。求出各放射生物学参数值α、β 、α/β、D0、Dq 、N 、SF2,并进行统计学处理,具体结果见表 2,最后得到放射增敏比SER=1.137。
表2 HepG2细胞RNAi前后放射生物学参数比较(n=3

表2 HepG2细胞RNAi前后放射生物学参数比较(n=3
Paired-samples T T est α=0.05。
参数 n 干扰前 干扰后 t P SF2 3 0.892 8±0.003 0 0.785 0±0.004 2 1.368 0.230 α 3 0.013 3±0.001 9 0.060 7±0.003 0 2.173 0.082 β 3 0.018 6±0.000 2 0.017 2±0.000 5 2.153 0.084 α/β 3 0.716 3±0.113 4 3.522 0±0.299 1 -3.929 0.011 D0 3 3.370 3±0.031 6 3.505 6±0.059 2-15.395 0.000 Dq 3 1.734 6±0.018 0 1.214 0±0.025 2 -2.865 0.035 N 3 3.272 3±0.074 9 2.221 0±0.065 1 -4.890 0.005
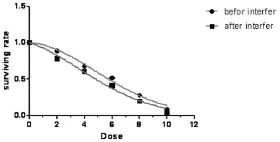
图1 HepG2细胞 RNAi前后细胞存活曲线(L-Q线性二次模型)
3 讨 论
野生型ATM位于 11q22~23,有150 kb DNA,66个外显子,其表达基因 mRNA长为 13 kb。整个 ATM 基因编码3 056个氨基酸,相对分子质量约350×103。ATM 最主要的功能区为磷脂酰胺醇-3-激酶(phosphatidylinositol 3-kinase,PI3K),它位于ATM蛋白C末端。此功能区主要参与细胞周期的调控,DNA损伤识别和修复[1]。ATM通过磷酸化和去磷酸化一系列蛋白底物如P53、c2abl(一种非受体酪氨酸激酶)、复制蛋白A(replication protein A,RPA)等参与激活细胞周期检测点和DNA损伤后修复信号网络系统,使受损的DNA停止于细胞周期检测点并对其进行修复[2],当A TM由于突变而功能受损时,细胞则丧失这一功能,DNA双链断裂修复障碍[3-4],从而出现对放射的高度敏感性。对ATM蛋白在细胞信号传导通路,细胞周期检测点以及DNA的修复的研究可为肿瘤的放射增敏的治疗提供新的方法。
DNA双链断裂(DSB)是放射治疗杀死肿瘤细胞的基本机制,在人类细胞内有2条DSB的修复途径:HR和NHEJ,前者所修复的DNA片段来自同一条DNA链,且末端每一个碱基完全按照互补配对原则进行重组修复,而后者所修复DNA链可来自不同的DNA链,其末端连接时仅部分碱基结合即可[5]。ATM与HR的关系密切,故而ATM基因缺失或表达受抑制会导致细胞放射敏感性增高[6-7]。
RNA干扰是在小干扰RNA(small interfering RNA,siRNA)的介导下特异性降解相应序列mRNA的现象,属于转录后基因沉默机制[8],而siRNA的持续表达能引发更为持久的基因沉默,从而为研究基因功能创造有利条件。本实验利用RNAi技术抑制肝癌 HepG2细胞的ATM 基因表达或活性,观察细胞对放射线的敏感性变化。
目前集落形成法被认为是测定细胞内在辐射敏感性的黄金标准,是测定细胞存活的最可靠方法。L-Q模型定义:假定辐射引起的细胞死亡是由两部分组成,一部分与照射剂量成比例,另一部分与照射剂量的平方成比例,用公式表达:SF=EXP(-α D-βD2)。其中α值越大,表明细胞对辐射越敏感,参数β的贡献随照射剂量增加而加大[9]。本实验用集落形成法及L-Q模型拟合分析了HepG2细胞干扰后的辐射敏感性,发现干扰后的辐射敏感性明显增加。
D0为曲线斜率倒数,它反映细胞在相对高剂量区对射线的敏感性,D0值越大,细胞对放射越敏感。Dq是存活曲线的直线部分向上延长与通过存活率等于1的横轴相交点的剂量,表明亚致死损伤修复能力的大小,Dq小则细胞对亚致死损伤修复能力弱。本实验测得数据为:HepG2细胞干扰前后D0值分别为:3.370 3±0.031 6、3.505 6±0.059 2,Dq值分别为:1.734 6±0.018 0、1.214 0±0.025 2。干扰后 D0、Dq值均较干扰前减小,且差异有统计学意义(P<0.05)。说明干扰后细胞的放疗敏感性增加。组织的α/β值越低,对损伤修复能力强,反之α/β值越高,对损伤修复能力弱。HepG2细胞干扰前后α/β值分别为0.716 3±0.113 4、3.522 0±0.299 1,差异有统计学意义,即 HepG2细胞 RNAi后的α/β值较前明显增大,对放射损伤修复能力减弱,亦说明具有一定的增敏作用。SF2为评价恶性肿瘤细胞放射敏感性指标之一,SF2高,放射敏感性低。HepG2细胞干扰前后分别为0.892 8±0.003 0、0.785 0±0.004 2,干扰后较干扰前有所降低,但差异无统计学意义。通过计算放射增敏比值SER为1.137,说明干扰后放射敏感性增高。
总之,本实验结果说明ATM基因沉默后促进了细胞对X线的敏感性,亦即对肝癌细胞HepG2具有一定的放射增敏作用。ATM可能成为预示肿瘤细胞放射敏感性的指标,更有可能成为肝癌放疗增敏的理想靶点,今后还将进行动物实验以进一步观察其放射增敏作用。本研究为肝癌的基因治疗和放疗增敏提供了新的方法和思路。
[1]Dasika GK,Lin SC,Zhao S,et al.DNA damage-induced cell cycle checkpoints and DNA strand break repair in development and tumorigenesis[J].Oncogene,1999,18:7883.
[2]Olsen JH,Hahnemann JM,Borresen Dale AL,et al.Cancer in patients with ataxia-telangiectasia and in their relatives in the nordic countries[J].J Natl Cancer Inst,2001,93(2):121.
[3]Grebaek K,Worm J,Ralfkiaer E,et al.ATM mutations are associated with inactivation of the ARF-TP53 tumor suppressor pathway in diffuse large B-cell lymphoma[J].Blood,2002,100(4):1430.
[4]Iliakis G,Wang Y,Guan J,et al.DNA damage checkpoint control in cells exposed to ionizing radiation[J].Oncogene,2003,22:5834.
[5]Willers H,Dahm-Daphi J,Powell SN.Repair of radiation damage to DNA[J].Br J Cancer,2004,90:1297.
[6]Sarkaria JN,Eshleman JS.ATM as a target for novel radiosensitizers[J].Semin Radial Oncol,2001,11(4):316.
[7]李高峰,陈龙华.ATM在肿瘤放射增敏治疗中的研究进展[J].重庆医学,2007,36(2):2224.
[8]Lee SR,Collins K.Physical and functional coupling of RNA-dependent RNA polymerase and Dicer in the biogenesis of endogenous siRNAs[J].Nat Struct Mol Biol,2007,14(7):604.
[9]Wang JZ,Li XA,Souza WD,et al.Impact of prolonged fraction delivery times on tumor control:a note of caution for intensity-modulated radiation therapy(IM RT)[J].Int J Radiat Oncol Biol Phys,2003,57(2):543.

