胰岛素对大鼠创伤性脑损伤后脑GLUT-3表达的影响
王 亮,唐文渊,杨 刚,朱 继,陈 亮
(重庆医科大学附属第一医院神经外科 400016)
葡萄糖是神经元代谢的主要能源底物,因其是极性分子,必须通过分布于神经元胞膜的葡萄糖转运蛋白3(glucose transporter 3,GLUT-3)介导才能进入神经元胞浆内代谢产能以维持神经元结构和功能的完整。正常情况下,GLUT-3的表达可受其周围葡萄糖浓度的影响[1]。创伤性脑损伤后(traumatic brain injury,TBI)神经元无氧酵解的增加使得其对葡萄糖的需求增加,作为葡萄糖转运载体的GLUT-3能否相应增加就成为TBI后神经元耐受因能量耗竭所致损伤的关键。目前研究表明,脑损伤后高血糖对脑有损害作用[2],胰岛素强化治疗能显著改善高血糖患者的预后[3-4]。本文拟通过检测正常对照组、TBI组和胰岛素治疗组伤后GLUT-3表达,神经特异性烯醇化酶(neuron specifienolase,NSE)阳性染色细胞数及神经瘫痪程度的差异,探讨TBI急性期胰岛素降糖治疗的脑保护作用机制。
1 材料与方法
1.1 实验动物分组 清洁级雄性SD大鼠180只,体质量(250.5±12.8)g,采用随机数字抽样法分成正常对照组、TBI组和胰岛素治疗组,每组又分为受伤前以及伤后 6、12、24、48、72 h共6个时间点,每组每个时间点各10只,5只用于免疫组化标本的采集,5只用于逆转录-聚合酶链反应(RT-PCR)标本的采集。大鼠均取造模前及处死前10 min尾静脉血,采用美国Johnson公司One-TouchⅡ型微型血糖仪测定其血糖值。
1.2 主要仪器与试剂 脑外伤头颅打击装置、One-TouchⅡ型微型血糖仪、PCR仪、LEICA光学显微镜、凝胶成像仪、NSE和GLUT-3多克隆抗体、Trizol试剂、RT-PCR试剂盒、SABC法免疫组化试剂盒、中效低精蛋白锌胰岛素(NPH)。
1.3 动物模型的制作和标本的收集 伤前动物禁食禁水8 h。采用刘媛等[5]的方法制作中型脑外伤模型,打击冲量50 g/cm术后以撞击区出现明显硬膜下血肿,动物苏醒即刻行走向左转圈或偏倒,术后HE染色撞击区出现明显挫裂伤作为造模成功的标志。伤后动物均采用鼻饲法喂养。胰岛素治疗组于伤后即刻皮下注射NPH 1.0 u,后每12 h追加1.0 u[6]。正常对照组动物不做致伤处理,但禁食禁水和鼻饲法喂养同TBI组和胰岛素治疗组。选取伤侧损伤周围2 mm内及健侧对称部位脑皮层为观察兴趣区[8],免疫组化标本经心灌注4%冷多聚甲醛固定后断头取脑,以前后囟连线中点为基线冠状位切取4 mm厚(基线前后各2 mm)完整脑片按常规制作成石蜡包埋块。RT-PCR标本于深度麻醉动物后断头取脑,迅速选取损伤周围2 mm范围内及健侧对称部位皮层脑组织置于液氮中保存。
表1 大鼠创伤性脑损伤急性期血糖值变化(mmol/L,n=10)

表1 大鼠创伤性脑损伤急性期血糖值变化(mmol/L,n=10)
与正常对照组相比较,▲:P<0.05,△:P<0.01;与胰岛素治疗组相比较,★:P<0.05,☆:P<0.01;与自身受伤前相比较,○:P<0.05,○:P<0.01。
组别 受伤前 6 h 12 h 24 h 48 h 72 h正常对照组 4.41±0.36 4.45±0.37 4.43±0.40 4.40±0.34 4.52±0.39 4.47±0.35 T BI组 4.53±0.31 4.88±0.34▲★○ 5.23±0.40△☆○ 5.78±0.44△☆○ 5.40±0.34△☆○ 4.94±0.42▲★○胰岛素治疗组 4.50±0.44 4.56±0.32 4.50±0.35 4.40±0.40 4.52±0.27 4.60±0.36
1.4 相关指标的测定
1.4.1 兴趣区皮层脑组织GLUT-3 mRNA表达测定 按Trizol试剂说明书提取总RNA,-80℃保存备用。采用Primer 5引物设计软件设计GLUT-3和β-actin上下游引物,委托上海生物技术有限公司合成。GLUT-3上游引物序列5′-AGC GGA GTC GGT TGA AAT-3′,下游引物序列 5′-CCT CAG AGC CCA GAA TAA AG-3′,产物长度 206 bp。β-actin 上游引物列 5′-TCA GGT CAT CAC TAT CGG CAA T-3′,下游引物序列 5′-AAA GAA AGG GTG TAA AAC GCA-3′,产物长度483 bp。按试剂盒说明书加样。RT反应条件:30℃10 min,50℃30 min,94℃5 min;PCR反应条件:94℃2 min,94℃30 s,55℃30 s,72℃30 s,循环30次。产物经2%琼脂糖凝胶电泳分离;采用Quanity-one软件分析 RT-PCR产物带、本底吸光度和条带面积,计算出条带吸光度值A,用GLUT-3条带A值与内参β-actin A值比值表示GLUT-3 mRNA的相对表达量。
1.4.2 兴趣区皮层脑组织GLUT-3、NSE免疫组化测定 石蜡包埋块5 um厚冠状位切片,按SABC法试剂盒说明书进行GLUT-3(抗体 1∶200倍稀释)和 NSE(抗体 1∶100倍稀释)免疫组化染色,显微镜下观察摄像保存。采用impro-plus6.0软件分析图像,计算出伤侧及健侧相应部位兴趣区皮层脑组织GLUT-3表达的平均光密度值和NSE阳性染色细胞数;各组阴性对照均采用0.01 mmol/L PBS液代替一抗,其余步骤同前。
2 结 果
2.1 创伤性脑损伤急性期血糖变化 正常对照组各时间点血糖变化不明显(P>0.05);TBI组血糖于伤后 6 h开始升高,一直持续到伤后72 h;胰岛素治疗组伤后各时间点血糖升高不明显(与伤前比较,P>0.05;与正常对照组相应时间点比较,P>0.05);各组伤前血糖差异不明显(P>0.05)。见表1。
2.2 创伤性脑损伤急性期兴趣区皮层GLUT-3 mRNA表达
正常对照组伤侧兴趣区皮层脑组织各时间点GLUT-3表达变化不明显(P>0.05);TBI组伤侧兴趣区皮层脑组织GLUT-3表达于伤后 12 h开始增加(0.34±0.03,与正常对照组0.29±0.01相比,P<0.05),一直持续到伤后 72 h(0.35±0.03,与正常对照组0.28±0.02相比,P<0.01),如图1。胰岛素治疗组伤后12 h(0.38±0.01,与 TBI组相比,P<0.05),24 h(0.43±0.02,与TBI组0.40±0.02相比,P<0.05),48 h(0.46±0.01,与 TBI组 0.43±0.02相比,P<0.05),72 h(0.40±0.03,与TBI组0.35±0.03相比,P<0.05)伤侧兴趣区皮层GLUT-3表达明显高于TBI组,如图2。各组健侧皮层相应部位GLUT-3表达变化不明显(P>0.05)。
2.3 创伤性脑损伤急性期兴趣区皮层GLU T-3蛋白表达GLUT-3表达于神经元胞膜,免疫组化染色可见其胞膜被染成棕黄色。正常对照组各时间点伤侧兴趣区皮层脑组织GLUT-3表达量差异无统计学意义(P>0.05);TBI组伤侧兴趣区皮层GLUT-3蛋白表达于伤后 12 h开始升高(0.28±0.02,与正常对照组0.23±0.02相比,P<0.05),48 h达到顶峰(0.34±0.01,与其他各时间点相比,P<0.01),72 h仍处于较高水平(0.29±0.03,与正常对照组相比,P<0.05)。胰岛素治疗组动物伤后 12 h(0.31±0.02,与TBI组相比,P<0.05),24 h(0.35±0.02,与 TBI组 0.31±0.02相比,P<0.05),48 h(0.38±0.02,与 TBI组相比,P<0.01),72 h(0.33±0.01,与TBI组相比,P<0.05)伤侧兴趣区皮层GLUT-3表达量明显高于TBI组;各组健侧相应部位脑皮层GLUT-3表达变化均无统计学意义(P>0.05)。
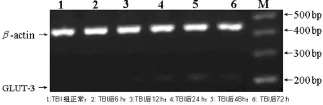
图1 RT-PCR法测TBI组大鼠伤侧兴趣区皮层GLUT-3 M RNA表达

图2 RT-PCR法测胰岛素治疗组大鼠伤侧兴趣区皮层GLUT-3M RNA表达
2.4 创伤性脑损伤急性期兴趣区皮层NSE阳性染色细胞数
NSE分布于神经元胞浆,免疫组化染色可见其胞浆被染成棕黄色。正常对照组伤侧兴趣区皮层脑组织各时间点NSE阳性染色细胞数差异无统计学意义(P>0.05);TBI组伤侧兴趣区皮层NSE阳性染色细胞数于伤后6 h开始降低(36.14±4.91,与正常对照组 45.31±3.76相比,P<0.05),一直持续到伤后72 h(9.07±2.41,与正常对照组 46.30±4.11相比,P<0.01);胰岛素治疗组动物伤后12 h(34.65±5.24,与TBI组27.52±4.17相比,P<0.05),24 h(28.97±5.30,与 TBI组18.15±3.52相比,P<0.01),48 h(24.57±4.41,与 TBI组10.47±3.00相比,P<0.01),72 h(20.16±3.55,与 TBI组相比,P<0.05),NSE阳性染色细胞数明显多于TBI组;各组健侧皮层NSE阳性染色细胞数变化均不明显,差异无统计学意义(P>0.05)。
3 讨 论
脑的生理代谢特点决定了其必须依靠细胞内持续的葡萄糖代谢供能才能维持结构和功能的完整。TBI后,效率极低的无氧酵解成为局部主要甚至是惟一的供能方式,使得局部葡萄糖的需求量大幅度增加。葡萄糖是极性分子,其从细胞外进入细胞内的过程必须依靠GLUT的介导,同时因葡萄糖的摄取是无氧糖酵解的限速步骤,所以脑外伤后局部GLUT的表达一方面可以反映脑摄取葡萄糖的能力[8],另一方面也间接反映了损伤局部脑细胞对葡萄糖的需求程度和局部葡萄糖的代谢率[9]。NSE是糖酵解过程中催化2-磷酸甘油酸脱水生成磷酸烯醇式丙酮酸的一种关键酶,特异性地存在于神经元胞浆[10],脑损伤后,NSE从神经元胞浆漏出,通过受损的血脑屏障进入脑脊液和血液,导致受损部位NSE阳性染色细胞数减少,因此,受损部位神经元和血浆中NSE的变化可作为判断神经元损伤的特异性指标之一[11]。近年来,临床和基础研究均指出,中重度颅脑损伤后血糖会不同程度的升高,且伤后早期升高水平可作为判断预后的独立危险指标[12-13]。虽然血糖升高从理论上可增加脑组织葡萄糖供应量,但胡卫星和顾培元[14]研究却发现TBI后伤侧葡萄糖代谢量降低,这种降低是否与伤后高血糖导致GLUT表达变化有关,现仍不清楚。故本文通过测定伤后正常对照组、TBI组和胰岛素治疗组伤后GLUT表达的差异,探讨TBI后胰岛素降糖治疗脑保护作用的可能机制。同时,因神经元是永生化细胞,自身糖元储备少,细胞代谢率高,受损后后果严重,且NSE染色后可计算其细胞数,便于评估损伤程度,故本文以其为研究对象,观察TBI后胰岛素降糖对其胞膜GLU T-3表达的影响,从神经元角度探讨TBI后胰岛素降糖治疗脑保护作用的可能机制。
本研究资料表明,TBI后6 h就有血糖的升高,48 h到达顶峰,72 h仍明显高于正常水平;正常对照组各时间点血糖升高不明显,说明TBI是导致伤后血糖升高的直接原因。关于TBI导致伤后血糖升高的相关机制现仍不清楚,目前研究提示其可能与以下几个方面有关:(1)TBI应激兴奋交感神经-肾上腺髓质系统和下丘脑-垂体-肾上腺糖皮质激素系统,产生大量的儿茶酚胺和糖皮质激素[15],增加了伤后糖原的分解和糖异生作用。(2)TBI应激产生的儿茶酚胺和糖皮质激素可促使胰腺a细胞大量分泌胰高血糖素[14],促使伤后血糖进一步升高。(3)TBI后胰岛素、细胞膜胰岛素受体结合活性下降[16],胰岛素作用相对减弱所致的伤后血糖升高。(4)高血糖的形成也可能与TBI所致的伤后胰岛素抵抗[17]有关。
本研究资料亦显示,TBI后12 h就有伤侧兴趣区皮层GLUT-3表达的上调,且持续高表达至伤后72 h;正常对照组伤侧皮层各时间点GLUT-3表达变化不明显,说明TBI是导致伤后GLUT-3表达增加的直接原因。关于 TBI导致伤后GLUT-3表达上调的相关机制尚不明确,推测可能因应激反应产生的大量糖皮质激素会减弱 GLUT-3转运葡萄糖的能力[18],TBI后早期GLUT-3表达的增加很有可能是机体应对GLUT-3转运能力下调所做出的一种代偿性的反应[19]。应用胰岛素控制大鼠血糖后,伤后12、24、48、72 h GLUT-3表达量明显增加,提示TBI后高血糖对伤后神经元GLU T-3表达的增加有明显的抑制作用。同时控制 TBI后高血糖在增加GLUT-3表达的同时,神经元缺失(表现为NSE阳性染色细胞数减少)和神经瘫痪程度均明显减轻,说明TBI后高血糖可通过抑制伤后GLU T-3表达的增加,进而加重TBI后神经元的损伤。目前,关于TBI后高血糖抑制GLUT-3表达增加的相关机制尚不清楚,对其的深入探讨也将是作者下一步研究的重点和方向之一。
[1]Bruekner BA,Ammini CV,Otal M P,et a1.Regulation of brain glucosetransporters by glucose and oxygen deprivation[J].J Metabolism,1999,48(4):422.
[2]Jeremitsky E,Omert LA,Dunham CM,et a1.The impact of hyperglycemia on patients with severe brain injury[J].J T rauma,2005,58(1):47.
[3]Yoder J.Tight control of blood glucose in the brain-injured patient is important and desirable[J].J Neurosurg Anesthesiol,2009,21(1):52.
[4]Azevedo JR,Lima ER,Cossetti RJ.et al.Intensive insulin therapy versus conventional glycemic control in patients with acute neurological injury:a prospective controlled trial[J].Arq Neuropsiquiatr,2007,65(3B):733.
[5]刘媛,王莉,王正国,等.一种改良的创伤性脑损伤模型的建立[J].中国临床神经外科杂志,2008,13(7):416.
[6]Uehara Y,Nipper V,Mc Call AL.Chronic insulin hypoglycemia induces GLUT-3 protein in rat brain neurons[J].Am J Physiol,1997,272(4Pt1):E716.
[7]刘科,唐文渊.创伤性脑损伤后动态CT灌注像的实验研究[J].第三军医大学学报,2008,30(13):1299.
[8]Vannucci SJ,Simpson IA.Developmental switch in brain nutrient transport expression in the rat[J].Am J Physiol Endocrinol Metab,2003,285(5):1127.
[9]Ismail BF.Metabolic regulation of glucose transport[J].J MembrBiol,1993,135(1):1.
[10]M c Aleese SM,Dunbar B,Fothergill JE,et a1.Complete aminoacid sequenceoftheneurone-specific gamma isozyme of enolase from human brain and comparison with the non-neuronal alpha form(NNE)[J].Eur J Biochem,1988,15:178.
[11]Vos PE,Lamers KJ,Hendriks JC,et a1.Glial and neuronal proteins in seruln predict outcome after severe traumatic brain injury[J].Neurology,2004,62(8):1303.
[12]胡怡,刘岚.儿童严重颅脑损伤急性期血糖水平与预后的相关性分析[J].重庆医学,2002,31(4):318.
[13]Salim A,Hadjizacharia P,Dbbose J,et al.Persistent hyperglycemia in severe traumatic brain injury:an independent predictor of outcome[J].Am Surg,2009,75(1):25.
[14]胡卫星,顾培元.实验性脑损伤超急性期脑糖代谢的变化[J].中华实验外科杂志,1998,15(6):553.
[15]屈强,史忠.严重颅脑外伤患者早期外周血TNF-α、IL-1β、ACTH、皮质醇和淋巴细胞GR的变化[J].重庆医学,2007,36(18):1801.
[16]路红杜,粟波,朱诫,等.大鼠颅脑外伤后胰岛素与胰岛素受体的变化[J].第二军医大学学报,1998,19(1):36.
[17]何朝晖,支兴刚,孙晓川,等.大鼠创伤性脑损伤后胰岛素抵抗与伤后高血糖的相关分析[J].南方医科大学学报,2007,27(3):315.
[18]Reagan LP,Magari˜nos AM,Lucas LR,et al.Regulation of GLUT-3 glucose transporter in the hippocampus of diabetic rats subjected to stress[J].Am J Physiol,1999,276(5Pt1):E879.
[19]Miyazawa T,Hossmann KA.Methodological requirement for accurate measurement of brain and body temperature during global fore brain ischemia of rat[J].J Cereb Flow Metab,1996,12:817.

