芪类化合物及其合成酶的研究进展
孟旭辉,张评浒,张朝凤*
(1.中国药科大学生药学研究室,江苏南京211198;2.中国药科大学新药筛选中心江苏南京210009)
芪类化合物及其合成酶的研究进展
孟旭辉1,张评浒2,张朝凤1*
(1.中国药科大学生药学研究室,江苏南京211198;2.中国药科大学新药筛选中心江苏南京210009)
芪类化合物,是一种抗菌的植物抗毒素,因其具有抑菌、抗氧化、抗肿瘤等多种生物活性,越来越受到人们的重视。近年来与合成芪类化合物直接相关的芪合酶功能基因也相继在不同植物中被发现,以芪合酶为基础的转基因研究范围也不断扩大。对芪类化合物的生物合成途径、生物活性,芪合酶的结构、功能,以及芪合酶基因和转芪合酶基因的最新研究进展情况进行综述,以期为进一步的研究该类成分及获取相关功能基因而提供科学依据。
芪类化合物;芪合酶;芪合酶基因
芪类化合物是一类以二苯乙烯为结构母核的化合物总称,多存在于植物的木质部,最早从蓼科植物大黄中被发现[1]。现代药理学研究表明,该类化合物具有抗菌、消炎、抗肿瘤等多种活性[2]。目前已从23科59属植物中分离得到芪类化合物[1](表1),在一些微生物如链霉菌属[3]、酵母[4]和细菌[5]中也发现芪类化合物。芪合酶(Stilbene synthase,STS)是合成芪类化合物的关键酶,它以苯丙酸途径中间物的辅酶A(如香豆酰辅酶A,肉桂酰辅酶A等)和丙二酰辅酶A为底物合成芪类化合物的分子骨架,再由其他酶进行修饰[6]。由于芪类化合物是作为植物应激反应的产物而产生的,是植物免遭外在环境包括微生物等刺激的代谢产物,随着科学研究的进步,这类化合物的活性越来越受到人们的重视,而阐明芪类化合物合成关键酶即芪合酶,具同时具有十分重要的意义。
1 芪类化合物的研究进展
1.1 芪类化合物的生物合成途径
苯丙酸代谢途径作为植物特有的代谢途径,是大多数物种中均有的一种产生次生代谢产物的方式,通过苯丙酸途径提供花青素类、黄酮苷类以及各种多聚木质素类成分。花青素类物质是植物色素形成的前提物质,黄酮类成分可用以保护植物免于UV的损伤,一些黄酮苷和异黄酮苷类还可以作为根瘤菌结瘤基因的诱导物,多聚木质素类物质用以结构支持以及作为各种植物抗毒素等。
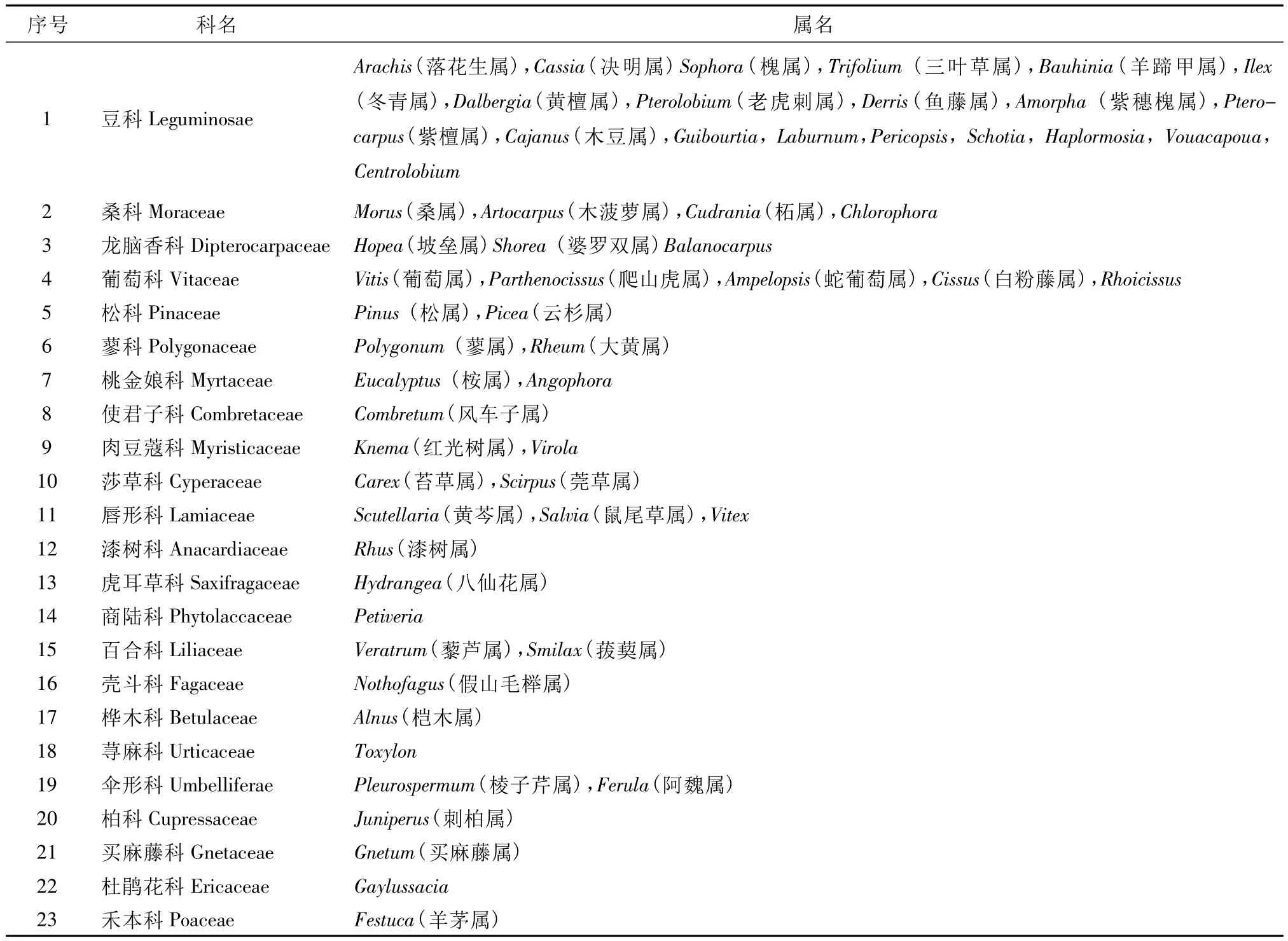
表1 芪类化合物在植物界中的分布情况
芪类化合物作为植保素也是来源于苯丙酸代谢途径[8],在芪类化合物的苯丙酸代谢途径中,三种酶的转化作用使碳流从初级代谢产物转化[9],将苯丙氨酸转化为辅酶A(CoA)-活性的苯基丙酸硫酯,苯丙氨酸在苯丙氨酸裂解酶(PAL)脱氨基作用形成肉桂酸,肉桂酸在肉桂酸-4-羟基化酶(C4H)的催化作用下形成反式香豆酸,在反式香豆酸-CoA连接酶(4CL)作用下,在反式香豆酸的羧基处形成硫酯键,生成反式香豆酸-CoA。反式香豆酸-CoA和两个丙二酰-CoA可在芪合酶(STS)催化作用下合成芪类次生代谢物(图1),另外,反式香豆素-CoA等也可在查尔酮合成酶(CHS)的催化作用下进入黄酮类和异黄酮类合成支路[10],由此可见,STS为芪类化合物的关键合成酶。
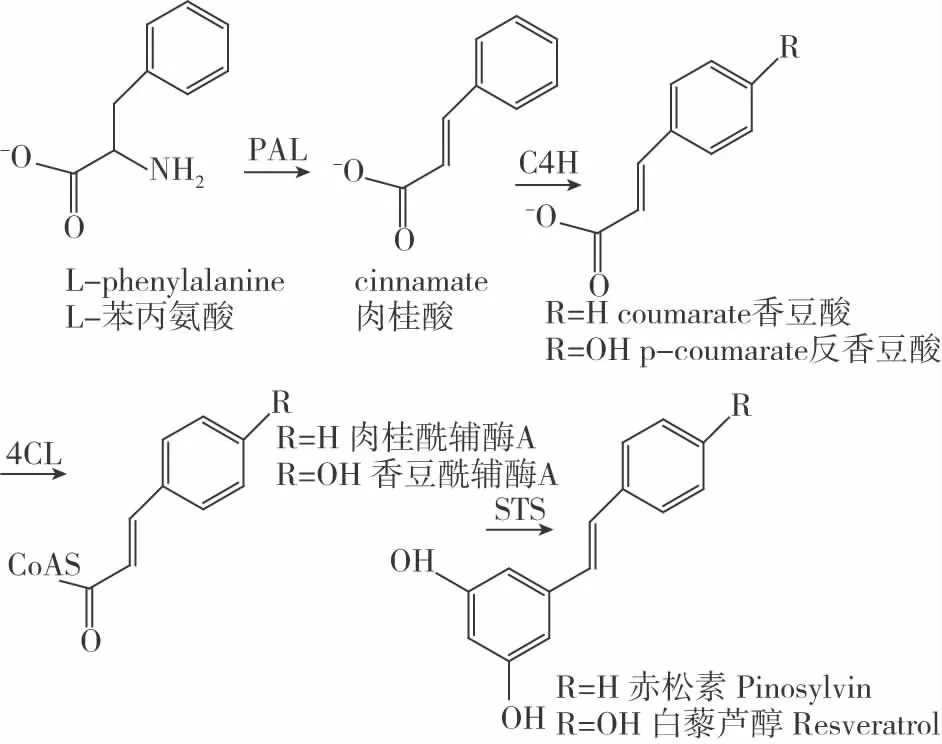
图1 芪类化合物合成路线
1.2 芪类化合物的生物活性
(1)抗菌活性。当植物受到病原菌侵染时,赤松素、白藜芦醇、四羟反式芪等植保素在植物体内的合成明显增加以抑制病原菌的生长。Ingham从真菌感染的落花生中提取的白藜芦醇能抑制炭色长蠕孢的生长(ED50=50 μg/mL)[2]。Yoshihiko 等合成了四羟反式芪的衍生物四羟反式芪-3,4-O-异丙叉,发现后者的抗真菌活性比前者提高10倍以上,毒性降低一半。具有抗菌活性的芪类化合物结构的共同特征是反式分子骨架和3、5位酚羟基取代[2]。
(2)抗炎活性。白三烯(leukotrienes,LTs)是花生四烯酸(AA)经5-脂氧酶(5-LO)代谢产生的一系列化合物,包括 LTA4、B4、C4、D4和 E4,是炎症、过敏反应的重要介质,参与多种疾病的发病过程。侯艳宁等[11]研究认为从小叶买麻藤中分离的一种二苯乙烯类Gn-3对LTD4受体具有较高的亲和力,是高效的LTD4受体拮抗剂(IC50为5.71×10-7mol·L-1)。
(3)抗肿瘤活性。自1996年Jang等[12]报道以白藜芦醇为代表的天然芪类化合物具有抗癌作用以来,目前认为芪类化合物对体外多种肿瘤生长均具有显著抑制作用。韩雪莲等[13]的研究结果表明多种芪类化合物对 SMMC27721、BGC2823、HepG2、Bel27402、MCF27、SGC27901等细胞系具有较强的抑制作用,其具体作用机制为阻滞细胞G2 PM周期并诱导细胞凋亡。
(4)酪氨酸酶抑制活性。从桑科植物Artocarpus gomezianus中分离得到的2个氧化白黎芦醇的链状二聚体artogomezinaol和nadalasniA对酪氨酸酶显示有较强的抑制活性,其IC50值分别为68 μM和39 μM。依据构效关系表明后者的活性是前者的近二倍,原因在与后者结构中2个游离的4-羟基间苯二酚基团为活性结构域,而前者相似的基团仅有1 个[14]。
2 芪合酶(STS)基因的研究进展
2.1 芪合酶基因的发现与分类
Schröder G. 等 (1988) 从 花 生 (Arachis hypogaea)cDNA文库中分离得到2个基因:pGSCl和pGSC2,用白藜芦醇诱导花生的细胞培养物,由其富集poly(A)RNA,从而验证2个基因的活性[21]。通过比较发现,这2个基因和查尔酮合酶(CHS)基因非常相关,编码区完全相同,但在相同位置上,CHS内含子要比该基因的保守。虽然利用相同的底物,但是产物却不一样。Melchior F等(1990)从葡萄(Vitis vinifera)得到全长的芪合酶cDNA,并进行测序。把此cDNA在大肠杆菌中表达,能表现出单一的芪合酶活性[22]。Fliegmann J等(1992)从苏格兰赤松(Pinus sylvestris)中提取到STS基因和CHS基因,并检测了2种相似的酶在大肠杆菌中表达的不同[23]。Raiber S 等(1995)又在东方白松(Pinus strobus)发现并克隆到2个芪合酶基因[24]。Yamazaki Y等(2001)从最原始的具维管束植物裸蕨属植物Psilotum nudum Griseb中利用RT-PCR方法得到4种CHS超家族基因:PnJ,PnI,PnL and PnP。其中 PnI和PnL选择肉桂酰CoA,并催化生成芪类化合物,归为银松素合酶(PS)(EC 2.3.1.146)[25]。Kodan A等(2002)在日本红松(Pinus densiflora)中分离得到1个结构罕见的STS cDNA,此cDNA由于移码突变,而没有STS普遍存在的C-末端延伸[20]。Samappito S等(2003)在药用植物蓼科大黄属圆叶大黄的根茎中发现1个编码芪合酶的基因RtSTS,该基因合成白藜芦醇和少量的柚皮素查尔酮,从而支持把此酶划分为合成白藜芦醇型的芪合酶[26]。Yu CK等(2005)在高粱属Sorghum bicolor中发现1种类似查尔酮合酶(CHS)的基因SbCHS8,经Genomic Southern分析为一单拷贝基因[27]。后来,把该基因和SbCHS2共同进行转基因研究,SbCHS2可以显示出查尔酮合酶活性,而SbCHS8则不能。把重组体用不同的苯丙氨酸类辅酶 A进行检测,检测SbCHS8具有生成二苯乙烯类的能力,故把该基因修正为SbSTS1,即芪合酶,Sorghum SbSTS1是第一个在单子叶植物中发现的芪合酶基因[27]。
原来一直认为在葡萄、花生、松树等植物中具有诱导型芪合酶基因的表达机制,但大多数植物细胞中虽然有STS酶的底物,但缺少STS基因,从而缺乏在诱发因子作用下合成该类植物芪类化合物的能力[28],但从最近的报道中可以发现,芪合酶基因也存在于最原始的具维管束植物裸蕨属植物[25]、蓼科圆叶大黄[26]、单子叶植物高粱属中[27]。
目前已克隆的STS基因可分为2种类型[18],一种是以反香豆酰-CoA为特异性底物,称为白藜芦醇合成酶(RS),另一种是肉桂酰-CoA为特异性底物,称为赤松素合成酶(PS)。葡萄、花生、圆叶大黄等植物中芪合酶属于前一种类型,而存在于苏格兰赤松(Pinus sylvestris)、东方白松(Pinus strobus)和裸蕨属植物(Psilotum nudum Griseb)等植物中芪合酶属于后一种类型。
2.2 芪合酶(STS)结构与功能
芪合酶(STS)和查尔酮合酶(CHS)同属于聚酮化合物合酶(PKS)超家族,PKSs催化以CoA类(如乙酰CoA)为启动子、以另外一种CoA类为添加物(如丙二酰CoA)的缩合反应[15]。PKSs根据其结构形态分为3种,即 I型、II型和 III型[16]。I型主要是一种或多种多功能蛋白,在装配和修饰聚酮化合物碳链的过程中,每个酶促反应都包含不同的活性位点[9]。I型是一个有机的整体,至少包含有酰基转移酶(AT)、酰基载体蛋白(ACP)和β-酮酰基合酶(β-KS)活性,主要存在于真菌和细菌中[17]。II型都是特异性的酶,催化不同的特异酶促反应。它种类较少,主要包括两种酮类合酶(α/β-KS)和1种ACP,主要用于固定碳链的增长。另外的PKS亚单元包括酮还原酶、环化酶、芳香酶,用于决定聚酮中间体的折叠类型和后续PKS的修饰等。目前只有在土壤和海洋中传播的放线菌利用该型聚酮合酶[9]。III型存在于细菌、植物和真菌中,基本上都是缩合酶,但缺少ACP,直接作用于酰基-CoA底物。一般认为,STS是伴随着陆生植物的演化而由CHS演化而来的。紫花苜蓿(Medicago sativa)CHS的晶体结构显示CHS具有αβαβα蛋白折叠,在所有的β-酮脂酰合酶和乙酰辅酶(包含了脂肪酸合成和分解的主要代谢酶)也具有这样的折叠结构。STS的结构具有与CHS相似的乙酰辅酶折叠,但STS不具有硫酯酶活性,这就把环化反应从CHS的克莱森缩合变为STS的羟醛缩合[18]。
STS和CHS之间在催化位点功能上具有一定的可变性。例如,将花生的STS和野葛 CHS cDNA分别在大肠杆菌中表达,它们的表达产物存在着部分重叠,即在CHS催化产物中有白藜芦醇,约为柚皮素含量的2.7% ~4.2%,而在STS的催化产物中含有有柚皮素,约为白藜芦醇含量的1.4% ~2.3%[19]。STS和CHS二者的功能同二聚体 PKSs一样,拥有一个单一的活性位点,形成相对小型的二聚体。STS和CHS利用共同的底物,3种丙二酰单酰辅酶A,1种桂皮酰基-CoA/p-香豆酰-CoA,通过相似的反应机制生成各自的产物[20]。
3 芪合酶的转基因研究
由于芪合酶在白藜芦醇等芪类化合物的生物合成途径中起着重要的调节作用,芪合酶的基因工程应用研究受到了人们的高度重视,并取得了重要的进展。通过转基因技术将芪合酶基因导入到目标植物基因组中,有望使转基因植物表达芪合酶活性,启动芪类次生代谢合成途径,从而可改变植物性状,增强植物抵御外来侵害的能力[29]。
最早研究芪合酶转基因的是Hain R等人的课题组,早在1990年他们构建了花生(Arachis hypogaea)STS基因和卡那霉素抗性基因的嵌合基因并将该嵌合基因转入到烟草原生质体的基因组中,转化烟草(Nicotiana tabacum)悬浮细胞培养物,在真菌细胞壁诱发因子或紫外线诱导作用下可以迅速表达STS酶活性[30]。为了进一步获得具有杀菌能力的植保素含量水平转基因烟草,Hain R等[31]又从葡萄中分离出STS基因与植物选择基因和报道基因连接,一道转入烟草原生质体基因组,并表达出STS酶活性。利用烟草病原菌Botrytis cinerea(灰霉)侵染烟草,转化烟草表现出持续抗性。该结果说明,通过基因的添加,使植物合成外源植保素,从而提高植物的抗病作用从技术上来说是可行的。2005年,Serazetdinova L 等[32]把2 种来自葡萄 Vitis vinifera L.的白藜芦醇合酶基因vst1和vst2以及来自松树Pinus sylvestris L.的赤松素合酶基因pss转录进入小麦中。结果显示所有转vst和pss基因的小麦中芪类诱导物要比用紫外照射诱导的高,所检测到的芪类化合物亲水性较强,结构与白藜芦醇和赤松素非常相似。与植物相比,用Puccinia recondita f.sp.tritici侵染的小麦,比野生型植株相比,vst转基因植株的疾病症状明显减少。而Septoria nodorum Berk.侵染时,疾病症状减少的幅度更大些,但是转pss基因的小麦却没有表现出相应的抗性。
至今已经有许多研究人员进行了芪合酶基因的转基因研究,为了获得具有抗性的植株,做了大量有益的尝试和实验,大部分转基因植株中都能表现出芪合酶活性,并且有芪类产物的生成。目前,转基因研究的植株有苹果、白杨、番木瓜、银白杨、油菜、小麦、番茄、豌豆、莴苣、蛇麻草、拟南芥[32-42]。
4 展望
通过研究发现芪类化合物确实有很多的活性,如抗菌、抗肿瘤等,但是我们也应该了解芪类在植物体内的作用机制还不是特别清楚,其作为植保素的抵抗能力也尚难以量化[43]。PKSs广泛存在于植物中,在认识植物PKSs反应机理上取得了巨大进步,一些晶体结构也已经确定,但芪合酶在植物中发现的不是很多,对整个机制和反应的还有待于进一步研究。芪合酶已经在微生物、哺乳动物细胞和植物中大量表达,改善植物对微生物的抵抗性,农作物的特性,以及改变植物的特征如颜色、不育性[9],相信会有越来越多的芪类化合物在植物中出现,也会在更多的植物中发现芪合酶。另外,芪类化合物在天然界中分布较窄,且结构比较有特征性,在利用植物化学分类学研究植物自然系统方面具有一定的分类价值。
[1] 斯建勇.天然芪类化合物的研究概况[J].天然产物研究与开发,1994,6(4):71-79.
[2] 王世盛,赵伟杰,刘志广.天然多羟基芪类化合物的生物活性[J].国外医药(植物药分册),2001,16(1):9-11.
[3] Johnson B C,Polonsky J,Cohen P,et al.Piloquinone: a new phenanth rene-O-quinone isolated from the mycellium of Strep tomyces pilosus[J].Nature,1963,199: 285.
[4] Meisinger M A P,Kuehl F A,Rickes E L,et al.The structure of a new product from yeast: 2-(6-hydroxy-2-methoxy-3,4-methylenedioxyphenyl)-benzofuran[J].J Am Chem Soc,1959,81:4979.
[5] Paul V J,Frautschy S,Fenical W,et al.Antibiotics in microbial ecology:Iso lation and structure assignment of several new antibacterial compouds from the inset-symbiotic Bacteria xenorhabd us spp[J].J Chem Ecol,1981,7: 589-597.
[6] 张永丽,金志强,徐碧玉,等.芪合酶基因的研究进展[J].现代农业科技,2007,13:195-196.
[7] Ingham,I.L.3,5,40-trihydroxystilbene as a phytoalexin from groundnuts(Arachis hypogaea)[J].Phytochemistry,1976,31:1791-1793.
[8] Michael B.Austin and Joseph P.Noel.The chalcone synthase superfamily of type III polyketide synthases[J].Nat Prod Rep,2003,20:79-110.
[9] Isvett J.Flores-Sanchez,Robert Verpoorte.Plant Polyketide Synthases: A fascinating group of enzymes[J].Plant Physiology and Biochemistry,2009,47: 167-174.
[10] Kati Hanhineva,Harri Kokko,Henri Siljanen,et al.Stilbene synthase gene transfer caused alterations in the phenylpropanoid metabolism of transgenic strawberry(Fragaria×ananassa) [J].Journal of Experimental Botany,2009,60(7):2093-2106.
[11] 侯艳宁,朱秀媛,程桂芳.豚鼠肺膜LTD4受体结合特征及二苯乙烯低聚体(Gn-3)的LTD4受体拮抗作用[J].中国药学杂志,2000,35(10): 667-669.
[12] Jang M,Cai L,Udeani GO,et al.Cancer chemopreventive activity of resveratrol,a natural product derived from grapes[J].Science,1997,275(5297) :2182220.
[13] 韩雪莲,方志杰,陈军浩,等.合成芪类化合物抑制肿瘤细胞增殖并诱导Bel27402细胞凋亡[J].中国生物化学与分子生物学报,2007,23(11):963-970.
[14] Likhitwitayawuid K,Sritularak B.A new dimeric stilbene with tyrosinase inhibitory activity from Artocarpus gomezianus[J].J Nat Prod,2001,64:1457-1459.
[15] Jean-Luc Ferrer,Joseph M.Jez,Marianne E,et al.Structure of chalcone synthase and the molecular basis of plant polyketide biosynthesis[J].Nature structural biology,1999,6(8): 775-784.
[16] M.A.Fischbach,C.T.Walsh.Assembly-line enzymology for polyketide and nonribosomal peptide antibiotics: logic,machinery,and mechanisms[J].Chem Rev,2006,106: 3468-3496.
[17] Holger Jenke-Kodama,Elke Dittmann.Evolution of metabolic diversity: Insights from microbial polyketide synthases[J].Phytochemistry,2009,10:1016.
[18] J.-L.Ferrer,M.B.Austin,C.Stewart Jr.,J.P.Noel,et al.Structure and function of enzymes involved in the biosynthesis of phenylpropanoids [J].Plant Physiology and Biochemistry,2008,46:356-370.
[19] Yamaguchi T,Kurosaki F,Suh D Y,et al.Cross-reaction of chalcone synthase and stilbene synthase overexpressed in Escherichia coli[J].FEBS Lett,1999,460: 457-461.
[20] Atsushi Kodan,Hiroyuki Kuroda,and Fukumi Sakai,et al.A stilbene synthase from Japanese red pine(Pinus densiflora):Implications for phytoalexin accumulation and down-regulation of flavonoid biosynthesis[J].PNAS 2002,(99)5: 3335-3339.
[21] Schröder G,Brown J W,Schröder J.Molecular analysis of resveratrol synthase: cDNA,genomic clones and relationship with chalcone synthase[J].Eur J Biochem 1988,172: 160-169.
[22] Melchior F,Kindl H.Grapevine stilbene synthase cDNA only slightly differing from chalcone synthase cDNA is expressed in Escherichia coli into a catalytically active enzyme[J].FEBS Lett,1990,268(1):17-20.
[23] Fliegmann J,Schröder G,Schanz S,et al.Molecular analysis of chalcone and dihydropinosylvin synthase from Scots pine(Pinus sylvestris),and differential regulation of these and related enzyme activities in stressed plants[J].Plant Mol Biol,1992,18(3):489-503.
[24] Raiber S,Schröder G,Schröder J.Molecular and enzymatic characterization of two stilbene synthases from Eastern white pine(Pinus strobus).A single Arg/His difference determines the activity and the pH dependence of the enzymes[J].FEBS Lett,1995,361(2-3):299-302.
[25] Yamazaki Y,Suh DY,Sitthithaworn W,et al.Diverse chalcone synthase superfamily enzymes from the most primitive vascular plant,Psilotum nudum[J].Planta,2001,4(1): 75-84.
[26] Samappito S,Page JE,Schmidt J,et al.Aromatic and pyrone polyketides synthesized by a stilbene synthase from Rheum tataricum[J].Phytochemistry,2003,62(3): 313-23.
[27] Yu CK,Springob K,Schmidt J,et al.A stilbene synthase gene(SbSTS1)is involved in host and nonhost defense responses in sorghum[J].Plant Physiol,2005,138(1): 393-401.
[28] Wilfried Schwab.Metabolome diversity: too few genes,too many metabolites[J].Phytochemistry,2003,62 : 837-849.
[29] 何水林,郑金贵,林 明等.植物芪类次生代谢物的功能、合成调控及基因工程研究进展[J].Journal of Agricultural Biotechnology 2004,12(1): 102-108.
[30] Hain R,Bieseler B,Kindl H,et al.Expression of a stilbene synthase gene in Nicotiana tabacum results in synthesis of the phytoalexin resveratrol[J].Plant Mol Biol,1990,15(2): 325-35.
[31] Rüdiger Hain,Hans-Jörg Reif,Elvira Krause,et al.Disease resistance results from foreign phytoalexin expression in a novel plant[J].Nature,1993,361: 153-156.
[32] Serazetdinova L,Oldach KH,Lörz H.Expression of transgenic stilbene synthases in wheat causes the accumulation of unknown stilbene derivatives with antifungal activity[J].Plant Physiol,2005,162(9):985-1002.
[33] Szankowski I,Briviba K,Fleschhut J,et al.Transformation of apple(Malus domestica Borkh.)with the stilbene synthase gene from grapevine(Vitis vinifera L.)and a PGIP gene from kiwi(Actinidia deliciosa) [J].Plant Cell Rep,2003,22(2):141-9.
[34] Seppänen SK,SyrjäläL,von Weissenberg K,et al.Antifungal activity of stilbenes in in vitro bioassays and in transgenic Populus expressing a gene encoding pinosylvin synthase[J].Plant Cell Rep,2004,22(8):584-93.
[35] Zhu YJ,Agbayani R,Jackson MC,et al.Expression of the grapevine stilbene synthase gene VST1 in papaya provides increased resistance against diseases caused by Phytophthora palmivora[J].Planta,2004,220(2): 241-50.
[36] Giorcelli A,Sparvoli F,Mattivi F,et al.Expression of the stilbene synthase(StSy)gene from grapevine in transgenic white poplar results in high accumulation of the antioxidant resveratrol glucosides[J].Transgenic Res,2004,13(3): 203-14.
[37] Hüsken A,Baumert A,Milkowski C,et al.Resveratrol glucoside(Piceid)synthesis in seeds of transgenic oilseed rape(Brassica napus L.)[J].Theor Appl Genet,2005,111(8):1553-62.
[38] Morelli R,Das S,Bertelli A,et al.The introduction of the stilbene synthase gene enhances the natural antiradical activity of Lycopersicon esculentum mill[J].Mol Cell Biochem,2006,282(1-2):65-73.
[39] Richter A,Jacobsen HJ,de Kathen A,et al.Transgenic peas(Pisum sativum)expressing polygalacturonase inhibiting protein from raspberry(Rubus idaeus)and stilbene synthase from grape(Vitis vinifera)[J].Plant Cell Rep,2006,25(11): 1166-73.
[40] Liu S,Hu Y,Wang X,et al.High content of resveratrol in lettuce transformed with a stilbene synthase gene of Parthenocissus henryana[J].Agric Food Chem,2006,54(21): 8082-5.
[41] Schwekendiek A,Spring O,Heyerick A,et al.Constitutive expression of a grapevine stilbene synthase gene in transgenic hop(Humulus lupulus L.)yields resveratrol and its derivatives in substantial quantities[J].Agric Food Chem,2007,55(17):7002-9
[42] Lo C,Le Blanc JC,et al.Detection,characterization,and quantification of resveratrol glycosides in transgenic arabidopsis over-expressing a sorghum stilbene synthase gene by liquid chromatography/tandem mass spectrometry[J].Rapid Commun Mass Spectrom,2007,21(24):4101-8.
[43] Julie Chong,Anne Poutaraud,Philippe Hugueney.Metabolism and roles of stilbenes in plants[J].Plant Science,2009,177:143-155.
Advance on the Stilbenes and Its Synthase
Meng Xuhui1Zhang Pinghu2Zhang Chaofeng1
(1.Research Department of Pharmacognosy,China Pharmaceutical University,Nanjing 211198,China;2.Jiangsu Center for Drug Screening,China Pharmaceutical University,Nanjing 210009,China)
Stilbenes,as antimicrobial phytoalexins,have been paid extensively attention for its activitivies of antibaceteria,antioxidative and antineoplastic and so on.In recent years,the stilbene synthase gene(STS)has been cloned in different plants and the scope of transgenic research has been expanded.This review introduces the biosynthesis pathway and bioactivities of stilbene compounds,the structure and function of stilbene synthase,stilbene synthase gene(STS)were also reviewed.
stilbenes;stilbene synthase;stilbene synthase gene(STS)
Q946
A
1006-9690(2010)03-0015-06
10.3969/j.issn.1006-9690.2010.03.004
2009-11-20
国家自然科学基金(30700060)
孟旭辉(1983-),男,硕士研究生,研究方向:植物相关功能基因及分子系统学。E-mail:mengxh1983@hotmail.com
* 通讯作者:张朝凤,E-mail:njchaofeng@126.com

