7厂家盐酸环丙沙星滴眼剂微生物方法验证对比
刘萍
(丹东市食品药品检验所 辽宁 丹东 118000)
7厂家盐酸环丙沙星滴眼剂微生物方法验证对比
刘萍
(丹东市食品药品检验所 辽宁 丹东 118000)
通过多不同厂家滴眼剂微生物方法的验证材料的对比,我们发现微生物方法验证存在很多问题,相同品种应该生产工艺相似的,应有相同的验证方法。而对这些厂家的同品种考察中,我们发现,验证的方法差异太大,缺乏准确性、科学性,目前,药检所,还不能对所检验的药品进行批批验证,这样做不仅工作量大,耗时长,只能用厂家提供的验证材料,这样一来出现很多问题,为验证方法的问题,可能影响实验的假阴性或假阳性。所以本文呼吁国家应抓紧出台标准的验证方法,或对企业的化验人员进行统一培训,理顺目前验证中存在的问题。
验证方法 微生物 阳性菌 冲洗量
药品微生物方法学验证的目的是为了去除药品因品种、剂型、规格、原料来源、工艺、辅料等不同,可能表现出不同的抑菌作用[1]。只有通过方法验证,才能确定供试品的检验条件和方法,保证“无菌检查”或“微生物限度检查”方法的科学性和检验结果的准确性。
试验用仪器:薄膜过滤器,滤膜孔径:0.45μm,滤器直径:50mm,电子天平,GHP细菌恒温培养箱(DYJ-149),SPX霉菌培养箱(DYJ-148)、酒精灯、高压灭菌锅。器材:平皿、1mL和10mL刻度吸管、100mL和250mL的三角烧瓶、试管。实验用培养基及培养条件:营养琼脂和玫瑰红钠琼脂培养基,pH7.0的蛋白胨缓冲溶液,营养肉汤,细菌培养温度为30~35℃,霉菌、酵母菌培养温度为25~28℃。所用菌株:大肠埃希菌[CMCC(B)44 102],第3代;金黄色葡萄球菌[CMCC(B)26 003],第3代。
目前,部分企业药检机构人员和实验条件达不到要求。2010年10月份,我所接到省所评价性抽检的10批盐酸环丙沙星滴眼剂的检验任务,通过索取微生物检验方法的验证,实验的情况如下。
从表1可以看出:同品种不同厂家验证时冲洗液、阳性菌、冲洗量、压力等均不同。药典规定冲洗量一般不超过1000mL[2]。阳性对照用菌也不同。很多厂家,记录中没有体现相关数据。并且阳性菌应根据抑菌的情况定位大肠埃希菌,压力也应该写明,否则实验中有可能,因为压力过大,引起泄露、过滤器炸裂或实验污染、也可能造成滤膜开裂[3]。
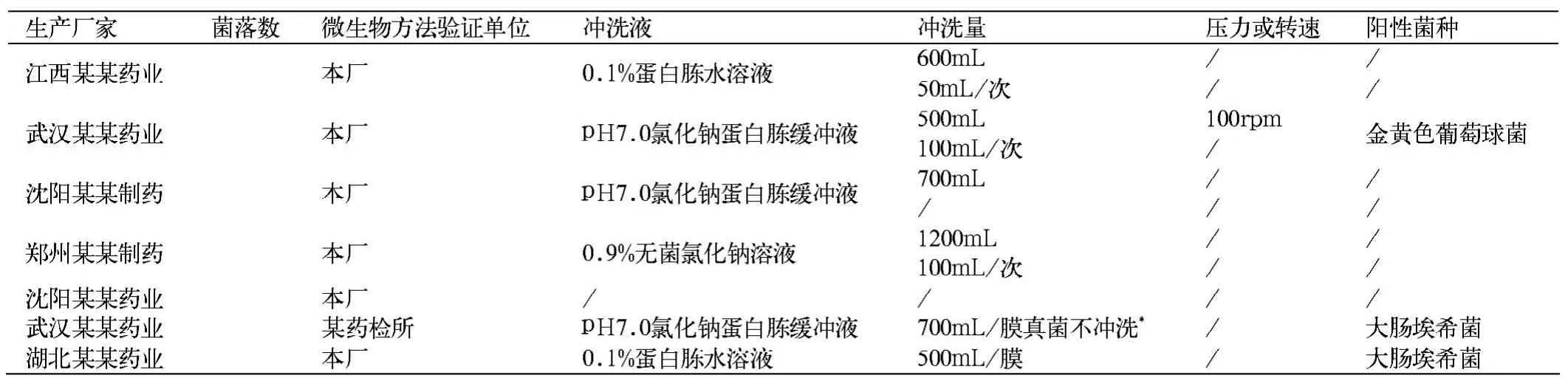
表1 实验情况
“微生物限度检查”和“无菌检查”是药品安全性检查的重要项目。虽然近几版《中国药典》均收载有“微生物限度检查法”和“无菌检查法”,但在如何保证检验方法的科学性和检验结果的准确性方面与国外药典相比仍具有一定差距,为此,药典会设立专项科研课题,对2005年版《中国药典》的“微生物限度检查法”和“无菌检查法”增加验证试验的必要性进行研讨。根据研究结果,2005年版《中国药典》规定当进行药品的“微生物限度检查”或“无菌检查”时应进行方法验证。而生产厂家的验证方法及标准尚需规范,存在弊端很多,如果按厂家提供的方法检验,势必存在一些问题。如何规范生产和检验,坚决杜绝“无菌检查”及“微生物限度检查”未经方法学验证的药品出厂,不仅能保证实验的准确性,也是应该是药品监管的一个重要的课题。建议由国家统一验证方法,以制止目前药品检验中的验证方法失控的现象。
[1]国家药典委员会.中国药典(2005年版第二部)[M].北京:化学工业出版社,2005.
[2]中国药品生物制品检定所.中国药品检验标准操作规范(2005年版)[M].北京:中国医药科技出版社.
[3]易大为,陈野,潘强.薄膜过滤法在局部给药制剂微生物限度检查中的应用[J].中国药事,2000,4.
R927.1
A
1674-0742(2011)08(b)-0122-01
2011-06-28

