生长抑素类似物奥曲肽对人胃癌生长的抑制作用研究
田 蕾,李 舒
胃癌是最常见的恶性肿瘤之一,在我国,胃癌的死亡率占所有恶性肿瘤死亡的23.02%,居各类癌死亡的第一位。尽管大多数胃癌患者应用手术、全身化疗等综合治疗,但5年存活率 (20%~30%)仍较低。近年来非细胞毒性药物治疗肿瘤的研究备受关注,其中生长抑素类似物生长抑素在抑制肿瘤生长方面的研究已有很多进展。有研究表明,奥曲肽在体外或动物实验中能明显抑制胃癌生长[1],但有关奥曲肽对人体内胃癌的研究尚少。故本研究通过临床随机对照研究,观察奥曲肽对人体内胃癌生长的影响。
1 资料与方法
1.1 一般资料 选取2008年3月—2009年11月在辽宁医学院附属第一医院接受胃癌根治术或胃大部切除术的50例胃癌患者,术前均做内镜活检,并经病理检查确诊为胃癌。其中男35例,女15例;年龄30~72岁,平均 (55.4±10.8)岁,中位年龄为55岁。将患者采用随机数字表随机分为两组:奥曲肽组 (25例)和对照组 (25例)。奥曲肽组中,男18例,女7例;平均年龄 (54.9±10.7)岁;患者对所用药物充分知情,并同意术前接受奥曲肽治疗。对照组中,男17例,女8例;平均年龄 (55.9±10.9)岁;患者同意术前不用任何药物。两组患者术前均未经化疗或放疗。
1.2 方法 奥曲肽组患者术前给予奥曲肽 (诺华公司)100 μg皮下注射,1次/d,共7 d。对照组患者术前不用任何药物。两组患者经上述处理后,术中切除标本送组织学研究及免疫组化检测。
1.2.1 组织学研究 取肿瘤最大横断面边缘、癌进展活跃部位组织,中性甲醛固定,常规脱水,石蜡包埋。从所取标本中心切片,制备4μm厚的连续切片,HE染色。由病理科医师在不知分组情况下观察肿瘤坏死、炎性细胞浸润及纤维组织增生程度。参照日本 (胃癌处理规约)组织学判定标准以及李国立等[2]方法,观察切片二维图像中肿瘤坏死、炎性细胞浸润及纤维组织增生所占面积大小,将其组织学变化分为3级:轻度变化:≤1/3的癌组织变化;中度变化:<1/3~<2/3的癌组织变化;重度变化:≥2/3的癌组织变化。
1.2.2 原位凋亡检测 用上述切片,采用DNA末端原位标记染色法 (TUNEL)检测胃癌细胞凋亡。TUNEL试剂盒购自Roche公司。按照说明书进行操作。凋亡细胞呈棕色~黄色,细胞核呈蓝色。每张切片选取10个高倍视野 (×400),每个视野计数100个胃癌细胞中的阳性细胞数,共1 000个细胞,凋亡指数 (apoptosis index,AI)=凋亡阳性细胞数/1 000个胃癌细胞×100%。
1.2.3 免疫组化法检测组织p63、增殖细胞核抗原 (PCNA)的表达 免疫组化染色采用SP法进行 (鼠抗人p63单克隆抗体及SP试剂盒均购自北京中杉金桥生物技术有限公司),主要步骤:4μm切片脱蜡至水;微波热修复10 min;消除内源性过氧化物酶活性,蛋白阻断液阻断10 min,滴加第一抗体,置入4℃冰箱过夜,分别滴加第二、第三抗体,室温下各孵育10 min,DAB显色液,苏木精复染,脱水、透明、封片。
p63、PCNA结果判断:以细胞核内出现棕褐色颗粒为阳性细胞,高倍镜下随机计数10个视野,计数不少于500个细胞进行评分。根据染色程度及染色细胞百分率进行分析评定。首先将染色强度计分:0分为无色,1分为淡黄色,2分为棕黄色,3分为棕褐色。再将阳性细胞所占的百分比计分:0分为阴性,1分为阳性细胞≤10%,2分为11% ~50%,3分为51%~75%,4分为>75%。染色强度计分与阳性细胞百分比的乘积>3分为免疫反应阳性。
1.3 统计学方法 采用SPSS 13.0统计学软件包进行统计分析。两个样本率间的比较采用四格表的χ2检验,多个样本率的比较采用趋势χ2检验;计量资料以 (x-±s)表示,3组间的比较采用方差分析;两个分类变量间的相关采用行×列表的关联性分析,等级资料采用Mann-Whitney秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 术后TNM分期及病理诊断 两组胃癌患者的肿瘤均原发于胃部。根据TNM分期,50例患者中Ⅱ、Ⅲ、Ⅳ期者分别占14.0%(7/50)、46.0%(23/50)和40.0%(20/50)。根据世界卫生组织的组织学分类,50例患者中管状腺癌46例(92.0%),印戒细胞癌 4例 (8.0%);高分化 7例(14.0%),中分化21例 (42.0%),低分化 (将印戒细胞癌归为低分化癌)22例 (44.0%)。
2.2 两组患者胃癌组织的组织学差异 与对照组比较,奥曲肽组出现明显的胃癌组织坏死,纤维组织增生也显著增加,两组间差异有统计学意义 (P<0.05);两组胃癌组织炎性细胞浸润程度比较差异无统计学意义 (P>0.05,见表1)。
2.3 两组患者胃癌组织细胞凋亡情况比较 细胞凋亡阳性表达位于细胞核内,呈红棕色散在分布 (见图1、2)。定量分析显示,奥曲肽组胃癌组织肿瘤细胞的凋亡率为 (8.85±1.92)%,显著高于对照组的 (6.47±1.68)%,组间比较差异有统计学意义 (t=4.664,P<0.05)。
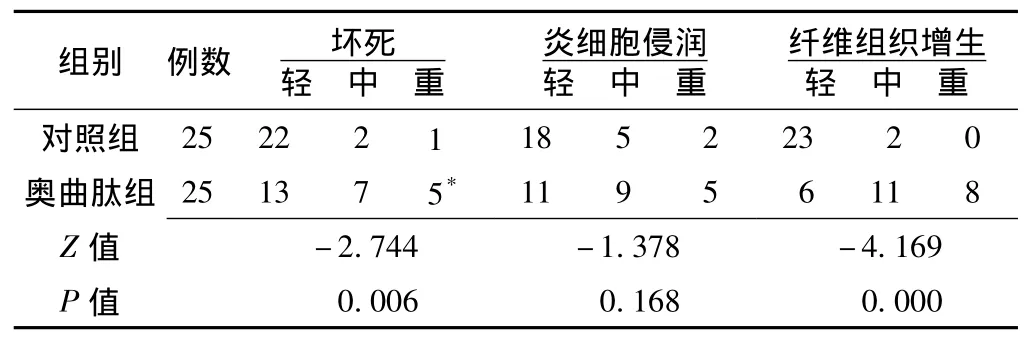
表1 两组患者胃癌组织的组织学变化 (例)Table 1 Histologic changes of stomach cancer between two groups
2.4 两组患者胃癌组织中p63蛋白、PCNA的表达 p63蛋白、PCNA阳性染色主要位于细胞核,为棕褐色颗粒,阳性细胞呈片状、弥漫或灶性分布 (见图3~6)。奥曲肽组胃癌组织中p63蛋白及PCNA阳性表达率分别为56.0%(14/25)和52.0%(13/25),对照组分别为84.0%(21/25)和86.0%(22/25),两组比较差异有统计学意义 (χ2值分别为4.667和9.441,P值分别为0.031和0.002)。
2.5 胃癌分化程度与组织学改变、凋亡及p63蛋白、PCNA表达的关系 胃癌分化程度与癌组织炎细胞浸润、肿瘤坏死、纤维组织增生程度无关,按照胃癌高-中-低分化程度,癌细胞凋亡程度随之减弱,PCNA、p63蛋白表达逐渐增强 (P<0.05,见表2)。
2.6 药物不良反应及并发症 在本研究治疗过程中,两组均未发现药物不良反应,也无因肿瘤坏死而出现的呕血、发热等并发症。
3 讨论
近年有研究表明,胃癌的发生发展与癌基因激活、抑癌基因失活等因素有关。1998年,Yang等[3]发现了p53的同源基因p63,由于启动子的不同和剪切方式的不同,p63基因编码至少6种亚型的蛋白质,可分成两大类:从外显子1开始转录生成具有反式激活区的亚型称为全长p63异构体 (TAp63);另一个从外显子3'启动子开始转录生成没有反式激活区的亚型称为截短 p63异构体 (ΔNp63)。p63在 DNA结合结构(DNA binding domain)、转录激活结构 (transcriptional transactivation domain)、四聚体化结构 (tetramerization domain)与p53基因的同源性分别达到60%、22%和37%。在DNA结合区,TAp63与p53的同源性高达60%,提示TAp63和p53能够结合同一DNA位点,从而与同一靶基因结合,如p21、bax。然后在反式作用域 (TA域)的作用下激活下游基因,诱导细胞周期阻滞或细胞凋亡,抑制肿瘤的发生;没有反式激活域的亚型 (ΔNp63)则不能激活下游基因,以显性失活的方式促进肿瘤的发生。本研究结果显示,胃癌组织中p63蛋白阳性表达率为84.0%,且p63蛋白表达与肿瘤的分化程度有关,按照高分化-中分化-低分化的病理表现,p63蛋白表达逐渐增强。提示胃癌中高表达的p63蛋白很可能是以ΔNp63的形式表达,并执行了癌基因的角色,这也阐明了p63蛋白的过表达并没有阻止胃黏膜病变的发生发展,相反在恶性程度高的胃癌组织中高表达的原因。刘荣等[4]研究发现p63蛋白过度表达参与调控胃癌发生。由此推测,p63蛋白在胃癌的发生发展中起癌基因作用,它们的高表达参与胃癌的发生,p63蛋白高表达可作为临床早期诊断胃癌的实验指标。另外,本研究发现经过奥曲肽干预后,表达棕黄色颗粒的阳性细胞数逐渐减少,这证实了奥曲肽能够抑制p63蛋白表达。其机制可能与奥曲肽与生长抑素受体结合后,上调蛋白酪氨酸磷酸的活性,使酪氨酸激酶去磷酸化而失活,并抑制有丝分裂原激活的蛋白激酶等多种蛋白激酶,从而抑制癌基因 c-fos、c-myc、c-jun等的激活,抑制DNA和蛋白质的合成,从而发挥干扰细胞周期、抗有丝分裂的作用[5]。本研究应用奥曲肽抑制了p63蛋白的表达,从而间接引起胃癌细胞周期阻滞,诱导胃癌细胞凋亡,从而抑制胃癌细胞的生长。
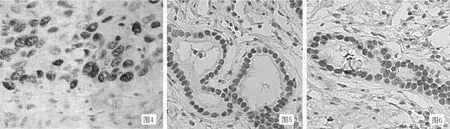
图1 对照组胃癌细胞凋亡 (Tunel法,×400) 图2 奥曲肽组胃癌细胞凋亡 (Tunel法,×400)Figure 1 Gastric cancer cells apoptosis in control group Figure 2 Gastric cancer cells apoptosis in octreotide group图3 对照组p63蛋白的表达 (SP法,×400) 图4 奥曲肽组p63蛋白的表达 (SP法,×400)Figure 3 p63 protein expression in control group Figure 4 p63 protein expression in octreotide group图5 对照组PCNA的表达 (SP法,×400) 图6 奥曲肽组PCNA的表达 (SP法,×400)Figure 5 PCNA expression in control group Figure 6 PCNA expression in octreotide group
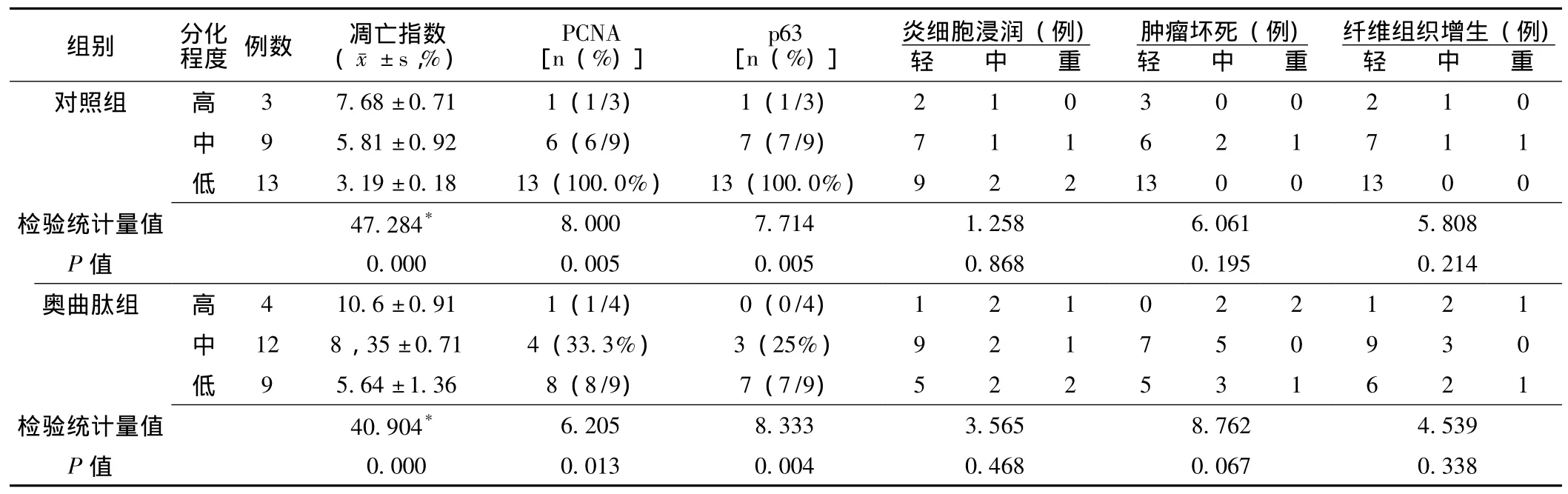
表2 两组胃癌组织的分化程度与治疗反映的关系Table 2 The relation of gastiric cancer cells differentiation between the therapy in the two groups
PCNA是一种细胞周期调节蛋白,是细胞DNA合成期必不可少的因子,可作为细胞增殖的标志物,且能确切反映细胞生长速度及状态。本研究发现,胃癌组织PCNA阳性表达率为86.0%,经过奥曲肽干预后PCNA阳性表达率 (52.0%)显著下降,且PCNA表达与胃癌的分化程度有关,低分化胃癌组织中PCNA表达显著高于高中分化胃癌组织,即分化越差,PCNA表达越强,肿瘤细胞的增殖活性越高、肿瘤的恶性程度越高,与文献报道[6]一致。奥曲肽组PCNA的表达减少,其机制可能为通过抑制蛋白激酶C和c-src活性阻止细胞周期G1/S过渡,阻滞细胞周期,从而抑制胃癌细胞的增殖[7]。
近年来人们开始关注细胞凋亡的减少在肿瘤的发生、发展中所起的作用,认为细胞凋亡的减少是肿瘤发生和发展的重要因素[8]。伍楚蓉等[9]报道胃癌组织细胞凋亡指数低于癌旁组织,在胃癌的发生、发展过程中细胞凋亡受到抑制。因此提示胃癌的恶性生长不仅是癌细胞过度生长所致,癌细胞凋亡被抑制也是其重要原因之一。本研究应用Tunel技术检测两组胃黏膜组织的凋亡情况,结果发现奥曲肽组肿瘤细胞凋亡率显著增加,能明显促进胃癌患者肿瘤组织坏死和纤维组织增生,从而有效抑制胃癌的生长。其作用机制主要是生长抑素及生长抑素类似物与生长抑素受体 (SSTR3)结合,触发细胞内酸化,并通过 PTP激活 wtp53和bax基因,导致细胞凋亡[10]。此外,占优势的ΔNp63α水平的下调可能是诱导凋亡的一个因素[11]。以往一些研究表明,胃癌的肿瘤细胞可表现出对射线、化疗、TNF介导的凋亡抵抗,本研究中奥曲肽组降低了肿瘤细胞抗凋亡的作用,提示我们是否可以通过使用其他生长抑素及生长抑素类似物药物来降低肿瘤细胞耐药性。
目前手术仍然是胃癌的最佳治疗方法,但手术本身可引起一定程度的免疫抑制,导致外周血淋巴细胞减少以及癌细胞微转移,甚至促进胃癌细胞增生。因此,胃癌术前治疗一直受到重视。有文献报道,对可根治切除的胃癌患者术前给予有效抗肿瘤治疗,有助于提高手术切除率[12]。目前,术前抗肿瘤治疗多采用细胞毒性的化疗药物,虽在部分病例可抑制肿瘤生长,甚至使瘤体缩小,但化疗药物对骨髓和免疫的抑制可削弱机体对肿瘤酶免疫,术后复发率增加。本研究采用非细胞毒性药物奥曲肽治疗,可明显抑制胃癌生长,呈现较好的组织病理学反应,且无明显骨髓抑制。理论上有助于提高手术切除率和存活率,降低复发率。该治疗方案若用于术后,可成为防止胃癌复发的手段之一;用于姑息治疗,可延缓患者带瘤生存时间。有关奥曲肽在临床上的多方面应用,尚需在剂量、疗程等方面做进一步的探讨。
1 苏海燕,刘文天,王邦茂,等.生长抑素类似物联合丝裂霉素对胃癌细胞的抑制作用 [J].世界华人消化杂志,2010,18(8):815-818.
2 李国立,刘福坤,陈忠豪,等.胃癌术前选择性动脉化疗对组织和细胞结构的影响[J].中华外科杂志,1997,35:259-261.
3 Yang A,Kaghad M,Wang Y,et al.p63,a p53 homolog at3q27-29,encodes multipe products with transactivating,death - inducing,and dominant negative activities [J].Mol Cell,1998,2(3):305-316.
4 刘荣,贺降福,朱尤庆,等.胃腺癌组织p53、p63、p73蛋白表达的意义[J].世界华人消化杂志,2006,14(24):2416-2420.
5 Charland S,Boucher MJ,Houde M,et al.Somatostain inhibitsAkt phosphorylationand cell cycle entry,butnot p42/p44mitogen-activated protein(MAP)kinase activation in normal and tumoral pancreatic acinar cells[J].Endocrinology,2001,142:121-128.
6 卢书明,张竹青,刘丽娜,等.P57KIP2和PCNA在胃癌组织中的表达及意义 [J].大连医科大学学报,2010,32(5):516-520.
7 Hu C,Yi C,Hao Z,et al.The effect of somatostatin and SSTR3 on proliferation and apoptosis of gastric cancer cells[J].Cancer Biol T-her,2004,3:726 -730.
8 Tsujimoto Y,Shimizu S.Another way to die:autophagic programmed cell death [J].Cell Death Differ,2005,12(2):1528 -1534.
9 伍楚蓉,黄红东,姜海行.胃癌组织p53、p63、p73蛋白表达及细胞凋亡的研究 [J].现代肿瘤医学,2006,14(11):1402-1404.
10 高凌,温程,朱兴国,等.生长抑素对胃癌SGC-7901细胞VEGF、NFκB表达的影响 [J].苏州大学学报 (医学版),2010,30(3):483-486.
11 Grisanzio C,Signoretti S.p63 in prostate biology and pachology[J].JCell Biochem,2008,103(5):1354-1368.
12 Persiani R,D'Ugo D,Rausei S,etal.Prognostic indicators in locally advanced gastric cancer(LAGC)treated with preoperative chemotherapy and D2 -gastrectomy[J].JSurg Oncol,2005,89(4):227-238.

