鸭脾坏死症的病原学初步观察
黄显明,张小飞,尹秀凤,王 伟,靳雨田
(南京天邦生物科技有限公司,江苏 南京 211102)
自2006年以来,山东、江苏、浙江、福建、安徽等养鸭比较密集的地区相继出现了一种新的传染性疾病,临床表现为软腿,生长发育不良,剖检以脾脏有白色坏死灶为主要病变特征,死亡率大约在20%左右,因而临床上大多称“鸭脾坏死症”[1]。近两年,该病情越来越严重,造成雏鸭大批死亡,给养鸭业造成了巨大的经济损失。关于该病的病原,至今还没有一个明确的定论。本研究通过患病鸭体内分离病毒、动物回归试验、理化特性、分子生物学等方法进行病原鉴定,最终分离鉴定出1株新型鸭源呼肠孤病毒。初步结果报告如下。
1 材料与方法
1.1 病料来源 病料来自安徽安庆周边地区疑似脾坏死症的某樱桃谷肉鸭养殖场。无菌采集14日龄病死鸭的肝、脾等组织,按1∶5加入灭菌生理盐水,充分研磨匀浆并反复冻融三次后,4℃,8000r/min离心5min,取上清液,保存备用。
1.2 试验动物和禽胚 4日龄雏鸭和10日龄鸭胚,购自安徽和县健康鸭场。
1.3 病毒分离与传代 将处理好的病料样品经尿囊腔接种10日龄鸭胚,共5枚,每枚0.3mL,接种后置37℃下继续孵化观察144h。接种后收获死亡的鸭胚尿囊液继续盲传3代,收集死胚胚液,置于-20℃保存备用。另选取长满单层的鸭胚成纤维细胞,接种0.5mL病料上清,37℃二氧化碳培养箱中培养,同时设立未接毒的正常细胞做对照。每日观察,待DEF产生80%细胞病变,收获病毒或连续盲传3代。
1.4 病毒对氯仿敏感性测定 参考文献[2],在单层DEF上测定分离毒对氯仿的敏感性。
1.5 病毒的血凝性测定 参考文献[2],测定分离毒对鸡红细胞的血凝性。
1.6 序列测定与分析 根据鸭源呼肠孤病毒的S2基因序列,设计合成了1对特异性的引物,S2F:5′-ATGGCGCGTGCCGTGTAC-3′,S2R:5′-CTGGACGGTAAAAGTGGC-3′。目的片段大小为1251bp。对获得的死胚尿囊液进行RT-PCR扩增,扩增的产物经克隆转化后,送往上海美吉生物工程有限公司进行测序,用DNAStar等分子生物学软件对测序结果进行序列同源性分析及进化树构建。
1.7 动物试验 对5只3日龄的健康雏鸭进行皮下注射第2代含毒尿囊液,每羽0.5mL,另设5只雏鸭作对照,隔离饲养观察,连续观察7d,记录试验鸭发病情况及病死鸭病变。试验结束后,采集攻毒鸭脾脏样品进行病毒的再分离,以RT-PCR方法进行鉴定。
2 结果
2.1 流行情况及临床症状 2011年4月份,安徽安庆市周边地区发生一种以软腿,行走困难严重者发生瘫痪,腹泻排白色粪便,生长发育不良,部分鸭爪部弥漫性出血为临床特征的鸭病,发病日龄从4日龄开始,死亡率在20%左右,而且发病日龄越小,死亡率越高。剖检可见心内膜少量出血点;肝脏点状出血、质脆;胆囊肿大,胆汁渗出;肾脏微肿;胰腺表面散在出血点;脾脏肿大、边缘增生、表面存在白色坏死灶甚至呈紫黑色实变等。
2.2 病毒分离结果 无菌过滤处理的病料上清液通过尿囊腔接种10日龄鸭胚,基本在接种后96~132h之间全部死亡,收获死亡的尿囊液连续盲传3代,对照组未出现死亡。死亡鸭胚胚体点状出血,尿囊液清亮。DEF在接种分离毒后72h开始出现病变,单层细胞变性出现空泡,拉网;继续培养,细胞开始圆缩,脱落,而对照组正常。因此,通过病毒分离,获得1株病毒分离株,命名为AH株。
2.3 病毒的氯仿敏感测定 分离毒对氯仿不敏感,表明分离毒为无囊膜的RNA病毒。
2.4 病毒的血凝性测定 分离毒不能凝集鸡的红细胞,表明该分离毒无血凝活性。
2.5 序列测定与分析 通过RT-PCR方法从AH分离株中扩增出一条与预计片段大小相符的目的条带,大小约1200bp(图1)。目的片段经回收测序,结果完全正确。经过在线Blast程序对测定的S2基因进行序列分析,发现与鸭源新型呼肠孤病毒NP03株、GZ株、HC株具有高度的核酸同源性,约为97%;与番鸭呼肠孤病毒、鹅源呼肠孤病毒和鸭源呼肠孤病毒的核酸同源性约为93%;与鸡源呼肠孤病毒的核酸同源性仅约为77%。因此,初步认为该病毒分离株为新型鸭源呼肠孤病毒。禽源呼肠孤病毒的S2基因核苷酸序列系统进化树表明(图2),禽源呼肠孤病毒分为两个群,分别为鸡源呼肠孤病毒群和水禽源呼肠孤病毒群,而且新型鸭源呼肠孤病毒又单独分立为一个亚群,说明了禽源呼肠孤病毒已经发生变异。
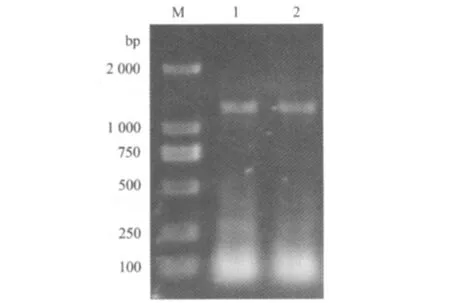
图1 AH株病毒的RT-PCR扩增
2.6 动物试验 试验组雏鸭攻毒后观察7d内未见试验鸭死亡。剖检试验组的5只鸭,可见脾脏肿大,边缘有增生,表面有明显的白色坏死灶,心内膜见少量出血点,对照组均正常。结果显示,AH株攻毒感染致死的雏鸭病变与自然感染病死雏鸭病变相同。采集的试验鸭脾脏组织上清液经处理后接种DEF细胞能够产生相应的病变,并通过RT-PCR扩增出该病毒。
3 讨论
综合临床症状、剖检病变、病原分离鉴定及RTPCR结果,最终鉴定分离的病毒为新型鸭源呼肠孤病毒。序列分析结果表明,禽源呼肠孤病毒分为两个群,分别为鸡源呼肠孤病毒群和水禽源呼肠孤病毒群,而且新型鸭源呼肠孤病毒又单独分立为一个亚群,说明了禽源呼肠孤病毒已经发生变异。张宝来等对湖北省一些肉鸭场均出现一种以脾脏有大量白色坏死斑块为特征的急性传染病进行研究,结果表明,引起以脾脏坏死为主要特征的鸭传染病病原是禽呼肠孤病毒[3]。梁鲜便等对南宁市饲养的樱桃谷鸭发生具有“脾坏死症”特征的两群发病鸭进行病原的分离与鉴定,最终分离到1株鸭源的禽呼肠孤病毒[4]。王劭等对1株鸭呼肠孤病毒NP03株的S3基因进行序列分析,结果表明,NP03株的S3基因具有不同于禽呼肠孤病毒和番鸭呼肠孤病毒的特征,认为NP03株是一株新型鸭呼肠孤病毒[5],而且本次分离的AH株和NP03株具有高度同源性。2011年,Liu等首次报道了呼肠孤病毒引起鸭的“脾坏死症”[6]。因此,我们认为鸭脾坏死症的病原为新型鸭源呼肠孤病毒。
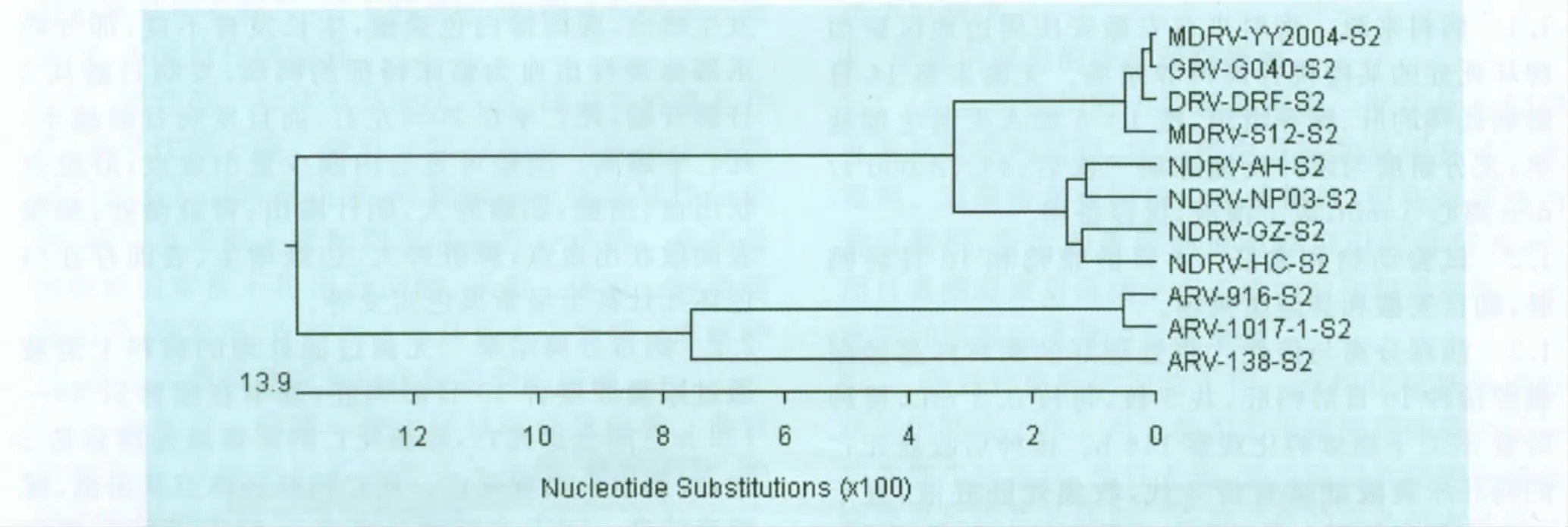
图2 禽源呼肠孤病毒的S2基因核苷酸序列系统发生树
近年来国内外研究表明,禽源呼肠孤病毒已呈现出宿主多样性的特点,感染后引起的鸭临床致病型也日益复杂,目前已报道有多脏器坏死型、多脏器出血型和脾脏坏死型3种[7]。鸭脾坏死症几乎发生于所有品种鸭,不仅对番鸭、半番鸭、樱桃谷鸭易感,最近还报道对麻鸭易感[8]。该病尤其对7~22日龄的雏鸭最易感,可造成20%~80%的发病率和5%~20%的死亡率。对于鸭脾坏死症的防治尚无有效的治疗药物,防治本病的主要方法是采取综合防制措施。该病毒既可通过水平传播,也可以垂直传播,更加难于防治。目前市场上还缺乏针对性的疫苗,鸡源呼肠孤病毒的疫苗和刘思枷等[9]研制的番鸭呼肠孤病毒弱毒疫苗还无法确定是否可用于该病的预防,迫切需要针对该病毒的疫苗的相关研制,防止其对养鸭业造成更严重的损失。
[1]黄瑜,苏敬良,施少华,等.我国鸭呼肠孤病毒感染相关的疫病[J].中国兽医杂志,2009,45(7):57-58.
[2]殷震,刘景华.动物病毒学[M].北京:科学出版社,1997.
[3]张宝来.鸭源呼肠孤病毒的分离与鉴定[S].武汉:华中农业大学硕士学位论文,2009.
[4]梁鲜便,韦平.两起鸭“脾坏死症”的诊断[J].广西畜牧兽医,2011,27(2):89-90.
[5]王劭,陈少莺,陈仕龙,等.新型鸭呼肠孤病毒NP03株S3基因序列分析[J].农业生物技术学报,2010,18(3):567-572.
[6]Liu Qinfang,Zhang Guozhong,Huang Yu,et al.Isolation and characterization of a reovirus causing spleen necrosis in Pekin ducklings[J].Veterinary Microbiology,2011,148:200-206.
[7]黄瑜,傅光华,施少华,等.新致病型鸭呼肠孤病毒的分离鉴定[J].中国兽医杂志,2009,45(12):29-31.
[8]胡小春,胡世君.荣昌某鸭场呼肠孤病毒的分离与鉴定[J].黑龙江畜牧兽医,2011,6:121-122.
[9]刘思枷,黄爱芳,邹永新,等.番鸭呼肠孤病毒病弱毒疫苗的研制[J].中国兽医杂志,2009,45(7):36-37.

