原发性胆汁性肝硬化并发真菌感染2例并文献复习
王炎焱,路 辉,张江林,黄 烽
1解放军总医院 风湿科,北京 100853;2解放军总医院第304临床部 肾内科,北京 100037
原发性胆汁性肝硬化合并真菌感染的报道较少,现将我科收治的2例原发性胆汁性肝硬化并发真菌感染的病例报告如下。
病例资料
病例1:女性,20岁,主因肝功能异常2年余,皮肤黄染3月,下肢浮肿1周于2008年入我院。患者于2005年体检时发现肝功能异常,未正规治疗。2007年逐渐出现颜面、巩膜黄染,尿黄,服用保肝、退黄药物时出现发热5d,停药后热退。随后出现腹胀、食欲减退、肝功能异常、全血细胞减少、腹腔积液。当地诊断干燥综合征,肝硬化,脾亢,给予甲强龙40mg×8d静滴,之后给予甲强龙1g×1d冲击治疗。此后甲强龙维持用量为40mg 1/d,熊去氧胆酸等保肝治疗。患者肝功能未明显改善,出现双上肢散在瘀点,面部、双上肢手掌充血疹,全身乏力,血细胞进行性下降,下肢膝以下浮肿,呈渐进性加重而入我院。体格检查:满月脸,颜面及双手掌可见对称性充血性红斑,双上肢、腹壁可见散在瘀点、瘀斑,以上肢明显。全身皮肤未见黄染。浅表淋巴结不大,心肺检查未见异常。肝脾肿大,移动性浊音未触及。化验检查:血常规WBC 0.59(3.5-10)×109/L,RBC 3.12(3.5-5.5)×1012/L,Hb 94(110-176)g/L,PLT 42×109/L;尿常规 WBC 2-3/HP,尿蛋白(-);便常规幽门螺杆菌弱阳性,ESR 11mm/h;IgG 1 730(700-1 600)mg/dl,IgA 35.7(70-400)mg/dl,C3 43.2(90-180)mg/dl,C4 7.63(10-40)mg/dl,C-反应蛋白测定<0.308(0-0.8)mg/dl;自身抗体:ANA(1∶1 000颗粒型)阳性,抗SSA抗体、抗SSB抗体阳性;AMA(+)。血生化:Alb 27.1(35-50)g/L,TBIL 66.8(0-21)μmol/L,DBIL 48.9(0-8.6)μmol/L,ALT 296.7(0-40)U/L,AST 109.5(0-40)U/L,ALP 244.9(0-130)U/L,GGT 213.1(0-50)U/L,LDH 346.6(0-200)U/L,GLU 9.07mmol/L;BUN 7.35(1.8-7.5)mmol/L,Cr 76(30-110)μmol/L,CA125 421.3μ/ml,CA 19-9 455.7μ/ml,血氨92.1μmol/L,结核三项阴性,PPD试验(-);腹部超声:肝硬化、脾大,少量腹水。腹部MR平扫:肝硬化、脾大,少量腹水(图1)。入院后患者出现咳嗽、咳痰,咳白色痰。行肺CT检查示上肺片状阴影,不排除结核可能,给予盐酸莫西沙星0.4g,1/d,链霉素0.75g静滴,1/d,乙胺丁醇0.75g,1/d,症状无明显好转,出现喘憋、呼吸急促、呼吸困难。血气分析提示低氧血症,呼吸性碱中毒。肺CT示:满肺高密度影(图2),G试验阳性,痰涂片PCR检测找到肺孢子菌包涵体。治疗给予醋酸卡泊芬净70mg静滴,1/d;复方新诺明2片,3次/d,同时给予床旁血滤。患者病情仍进行性加重,胸片示双上肺炎症加重(图3),尽管抗感染等积极治疗,终因病情危重抢救无效死亡。最后诊断:原发性胆汁性肝硬化,卡氏肺孢子虫肺炎,呼吸循环衰竭。
病例2:女性,49岁,主因“间断发热、腹胀1年余,腹痛1周”于2006年入我院。患者1年前无诱因间断发热,体温38℃左右,无规律性,伴有乏力、纳差、咳嗽、咳黄色痰、盗汗、腹胀。查抗核抗体(ANA)阳性,抗双链-DNA(ds-DNA)弱阳性,肝功转氨酶轻度升高,给予改善微循环,调节免疫及保肝治疗,病情无明显缓解并逐渐加重,体温升高,最高达40℃,以午后发热为主。化验抗平滑肌抗体(AMA)、抗线粒体抗体(ASMA)均为阳性,考虑自身免疫性肝硬化、肺部感染,给予保肝、抗炎对症治疗,咳嗽、咳痰症状减轻,但仍有间断发热。入院1周前出现下腹部疼痛,为持续性钝痛,无恶心、呕吐、腹泻等症状。病程中有口干,关节疼痛,但无明显进干性食物受限,无眼干、肌痛、肌无力,无面部蝶斑、光过敏等。既往患肺结核12年,已治愈。体格检查:颈前部及左手掌面可见散在蜘蛛痣,双下肢肌肉轻度压痛,双下肢轻度凹陷性水肿。余未见异常。化验检查:自身抗体ANA(1∶1 000均质颗粒型)阳性,抗ds-DNA原液阳性,抗SSA抗体、抗SSB抗体阴性;IgA 853(70-400)mg/dl,IgG 2 820(700-1 600)mg/dl,IgM 924(40-230)mg/dl,IgE 1 400(0-100)IU/ml,C3 79.3mg/dl,C4 17.6mg/dl,RF 5 410(0-20)IU/ml;血常规:Hb 107g/L,RBC 3.46×1012/L,WBC 1.0×109/L,PLT 86×109/L;血沉:129(<20)mm/h;CRP<0.313mg/dl;尿常规、便常规、血清四项及肝炎病毒检测未见明显异常。血生化:Alb 32.9(35-50)g/L,TBIL 33.9 μmol/L,DBIL 19.4 μmol/L,ALT 35U/L,AST 84.1U/L,ALP 184.2U/L,GGT 140.8U/L,BUN 2.42(1.8-7.5)mmol/L,Cr 38.8(30-110)μmol/L,K 3.47(3.5-5.5)mmol/L,Ca 2.20(2.25-2.75)mmol/L;结核三项阴性,PPD试验(-),抗酸染色(痰)阴性,肿瘤标记物阴性。痰涂片革兰氏阴性球菌,革兰氏阴性杆菌;Schirmer's试验双眼0cm,唇腺活检示涎腺组织间质灶性淋巴细胞浸润(图4);骨穿提示:骨髓增生活跃,粒、红二系增生,巨核细胞各型可见;腹部超声提示肝硬化、脾大、门静脉高压,胆囊壁增厚,脾脏旁等回声结节,副脾,少量腹水,双肾未见异常;肺CT平扫显示:右肺上叶后段、下叶基底段及在左肺上叶舌段,下叶背段内见片状高密度影,边界欠清,部分可见钙化,双肺改变考虑炎症,双侧腋下及纵隔内可见多个淋巴结;入院诊断:干燥综合征,原发性胆汁性肝硬化,脾功能亢进。治疗给予激素(甲泼尼龙36mg/d)、免疫抑制剂(吗替麦考酚脂1g,2/d)、熊去氧胆酸(0.25g,3/d)、保肝及抗感染,治疗后体温即降至正常,上腹部疼痛较入院前明显减轻。但患者于入院后半个月复查尿常规示WBC 15-18/HP,PRO阴性;红细胞满视野,多形(皱,棘)80%,均一20%。之后出现肉眼血尿,右侧肋脊角有压痛、叩击痛,双下肢凹陷性水肿。双肾超声示:右肾积水伴右侧输尿管上段扩张,右肾盂内絮状回声,考虑凝血块可能性大;静脉肾盂造影示:右肾及输尿管未显影(图5)。核磁泌尿系水成像:右肾实质内见5cm×6cm片状影;肾脏MRI平扫和动态增强扫描提示:肝硬化,脾大,少许腹水,右肾异常改变(图6)。患者突然出现左眼视力下降,球结膜充血、畏光、流泪;眼科检查提示:左眼前房积脓,液平约1/5前房高度,房水浮液物(+++)晶体前纤维素样渗出,玻璃体混浊。考虑为左前房积脓,左眼葡萄膜炎;行1%阿托品眼液点左眼,1/d;地塞米松、庆大霉素合剂左球旁,1/d,但视力未见明显改善。为明确疾病性质行超声引导下肾脏穿刺活检,结果提示为肾脏毛霉菌感染(图7);给予积极抗真菌两性霉素B治疗及营养支持治疗,但终因病情危重,抢救无效死亡。最后诊断:干燥综合征,原发性胆汁性肝硬化,毛霉菌感染。
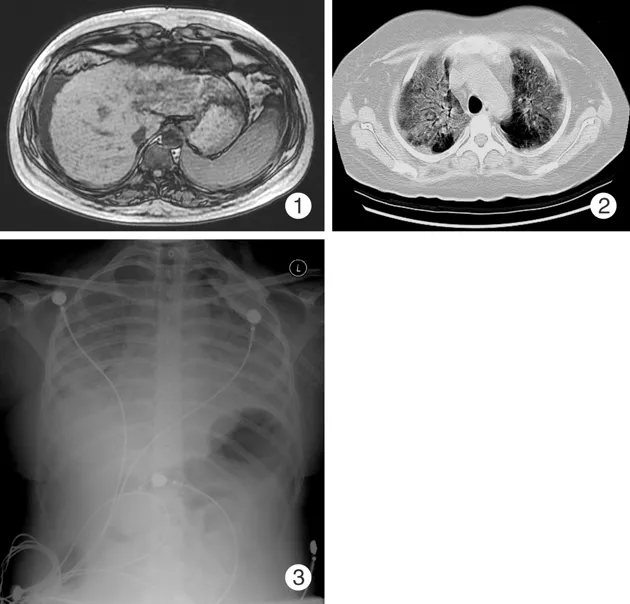
图1 病例1腹部MR平扫:肝硬化、脾大图2 病例1胸部CT平扫:满肺的高密度影图3 病例1胸片:双上肺炎症,肝硬化、脾大、腹水
讨 论
原发性胆汁性肝硬化是一种慢性肝内胆汁淤积性肝病,病因不清。好发于中年女性,以肝内进行性小胆管破坏,伴汇管区和汇管周围炎症及纤维化为特点,最终导致门脉高压、肝硬化,甚至肝功能衰竭。随着近年诊断技术和对本病认识水平的提高,国内本病有逐渐增多趋势。
PBC是免疫系统异常导致的自身免疫性疾病,越来越多的研究已证实PBC和其他自身免疫性疾病,如干燥综合征和类风湿关节炎等有共同的免疫病理学基础。本病目前尚缺乏满意的治疗方法,对症治疗仍为主要治疗方法。熊去氧胆酸对部分患者可缓解症状和改善肝功能指标,延缓病情进展,改善生活质量。如果合并有其他结缔组织病则需同时服用激素及免疫抑制剂治疗。但长期服用激素及免疫抑制剂增加了并发各种感染的机会,尤其是机会菌感染。
本报告2例患者诊断均符合2000年美国肝病学会(AASLD)关于PBC的诊断建议。病例1患者因有严重的血液系统受累,病例2患者合并干燥综合征,两例患者均服用激素及免疫抑制剂治疗,之后并发肺孢子虫感染和毛霉菌感染。肺孢子虫感染及毛霉菌感染均是机会菌感染。
肺孢子虫肺炎(PCP)一种机会感染性疾病。任何年龄的人群均可感染肺孢子菌,但免疫功能正常的人感染后并不发病,只有当宿主免疫功能低下时,侵入人体的肺孢子菌才开始进行大量繁殖,并在肺组织内扩散,导致间质性浆细胞性肺炎。结缔组织病患者因需大剂量长期服用激素及免疫抑制剂,增加了感染PCP的机会。近年随着生物制剂广泛应用等原因使真菌感染的发病率有明显增加趋势[1-4]。在日本应用英夫利昔治疗RA患者并发PCP的感染比例为0.4%,平均在应用英夫利昔后8.5周[5]。利妥昔单抗治疗RA和韦格纳肉芽肿并发PCP的报道也很多[6]。
系统性红斑狼疮和韦格纳肉芽肿(WG)并发PCP感染的报道很多。WG并发PCP感染的报道最常见。一项11 905例结缔组织病患者的荟萃分析中,578例WG患者中12%合并PCP感染,相比皮肌炎/多肌炎并发PCP感染仅有6%,SLE 5%,RA 1%[7]。结缔组织病患者并发霉菌感染及PCP感染不但与结缔组织病本身的免疫失调有关,而且与长期应用激素及免疫抑制剂治疗关系密切[8]。但很难明确具体是哪种因素致病。本文2例病人入院时都有白细胞下降,考虑2例患者可能是因为粒细胞缺乏继发机会菌感染。
结缔组织病并发PCP感染和环磷酰胺、甲氨蝶呤(MTX)、激素、硫唑嘌呤、环孢素、新型生物制剂(抗TNF抑制剂和抗CD20抑制剂)的治疗相关[9-10]。激素治疗是最主要的危险因素,合并PCP感染患者中90%以上均长期应用激素治疗。如果高龄患者、营养缺乏患者或低淋巴细胞血症患者,应用>16mg/d相等量激素(>2月)或>20mg/d>1月激素治疗,相关增加PCP感染的机会。环磷酰胺治疗并发PCP感染可能和显著抑制淋巴细胞数相关,因此应用环磷酰胺常规治疗的患者应考虑监测CD4+淋巴细胞计数。
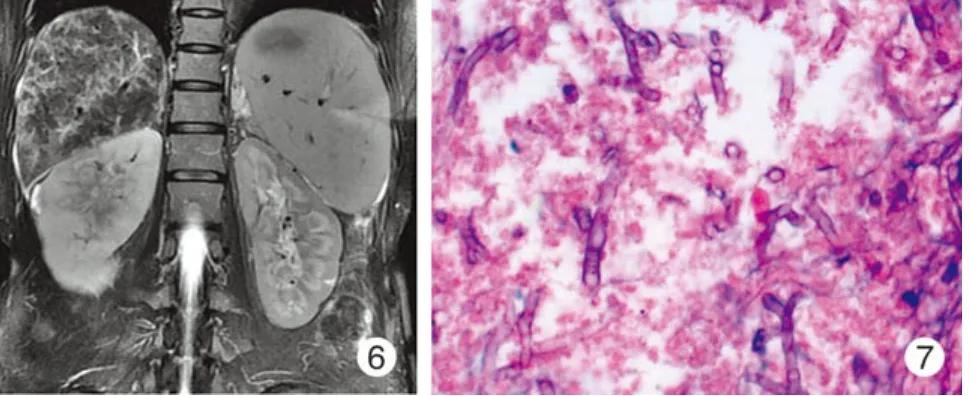
图 6 肾脏MRI T2W:肝硬化,脾大,少许腹水,右肾异常改变 图 7 病例2 毛霉菌菌丝Fig 6 Kidney MRI T2W showing cirrhosis, a small amount of ascites, and abnormal right kidneyFig 7 Mucoraceous hypha in case 2(×400)
文献中尚无原发性胆汁性肝硬化并发肾毛霉菌感染报道。临床上有少数肝移植后并发毛霉菌感染的报道,多为肺部毛霉菌感染多见,肾脏毛霉菌报道十分罕见。毛霉菌病大多数系由接合菌亚门接合菌纲毛霉目毛霉科中的毛霉属、犁头霉属、根霉属和根毛霉属等的某些菌种[11]所引起的严重机会性感染,发病率不高,诊断较为困难。该病患者大多合并有糖尿病酸中毒、营养不良、大面积严重烧伤、外伤手术、白血病、淋巴瘤、艾滋病或其他严重消耗性疾病,或者应用免疫抑制剂及细胞毒药物和肾上腺皮质激素等药物,大多病情凶险,死亡率高。
毛霉病主要特征为有性繁殖产生接合孢子,无性繁殖形成孢子囊。特点为:1)菌丝较粗大,不分隔或极少分隔;2)菌丝壁较厚,侧枝与母枝成直角;3)好侵犯血管壁和血管腔,使血管栓塞,导致邻近组织缺血、出血性梗死和坏死性炎症。毛霉菌感染临床表现为脑型、肺型、胃肠型、皮肤型和全身播散型,急性者病情进展,可在数日-数周内死亡,慢性感染可表现为单纯肉芽肿或化脓性炎与肉芽肿性混合炎症[12-13],临床诊断常依据临床症状、易感因素、霉菌学检查和病理组织检查,其中病理组织中发现菌丝最有诊断意义。肺部毛霉菌影像学的报道较多,初起表现为单侧或双侧支气管肺炎,迅速融合成大片实变,常有空洞形成。亦可见到单发或多发性结节者。若有较大肺血管栓塞,则可见底部贴近胸膜的楔形阴影,有诊断参考意义。HRCT能发现普通X线不能显示的征象,如支气管内毛霉病所引起的管腔堵塞、晕影和肺动脉假性动脉瘤。肾脏的毛霉菌感染影像学文献中尚未见描述。毛霉菌感染进展迅速,故早期诊断和有效治疗对毛霉菌病的预后具有决定性意义。
全身播散型毛霉病肾脏受累较为少见,单纯肾毛霉菌病更为少见。病例2患者因干燥综合征合并原发性胆汁性肝硬化给予激素及免疫抑制剂治疗后合并肾脏毛霉菌感染,尽管经过积极的两性霉素B抗感染治疗,但病程仍进展较快,最终死亡。
本文回顾分析了2例原发性胆汁性肝硬化并发机会致病菌的病例,均因长期服用激素及免疫抑制剂后感染真菌。这提示我们,风湿免疫性疾病患者因长期服用激素及免疫抑制剂,因此增加了机会致病菌感染的几率,临床工作中要拓宽思路,遇到对广谱抗生素治疗反应效果不佳的感染,要进一步行真菌及痰涂片等检测,必要时行早期病理组织学活检,为患者治疗争取时间。同时,积极寻求病理学诊断有助于提高我们对疑难疾病的认识。
1 Wissmann G,Morilla R,Martín-Garrido I,et al. Pneumocystis jirovecii colonization in patients treated with infliximab[J]. Eur J Clin Invest,2011,41(3):343-348.
2 Takeuchi T,Kameda H. The Japanese experience with biologic therapies for rheumatoid arthritis[J]. Nat Rev Rheumatol,2010,6(11):644-652.
3 Karino T,Osaki K,Kanamori K,et al. Case of pulmonary cryptococcosis which developed in a patient receiving abatacept therapy for rheumatoid arthritis[J]. Nihon Kokyuki Gakkai Zasshi,2010,48(12):980-984.
4 Yamazaki H,Nanki T,Miyasaka N,et al. Methotrexate and trimethoprim-sulfamethoxazole for Pneumocystis pneumonia prophylaxis[J]. J Rheumatol,2011,38(4):777-778.
5 Kameda H,Tokuda H,Sakai F,et al. Clinical and radiological features of acute-onset diffuse interstitial lung diseases in patients with rheumatoid arthritis receiving treatment with biological agents:importance of Pneumocystis pneumonia in Japan revealed by a multicenter study[J]. Intern Med,2011,50(4):305-313.
6 Hugle B,Solomon M,Harvey E,et al. Pneumocystis jiroveci pneumonia following rituximab treatment in Wegener's granulomatosis[J]. Arthritis Care Res(Hoboken),2010,62(11):1661-1664.
7 Falagas ME,Manta KG,Betsi GI,et al. Infection-related morbidity and mortality in patients with connective tissue diseases:a systematic review[J]. Clin Rheumatol,2007,26(5):663-670.
8 Ogawa J,Harigai M,Nagasaka K,et al. Prediction of and prophylaxis against Pneumocystis pneumonia in patients with connective tissue diseases undergoing medium- or high-dose corticosteroid therapy[J]. Mod Rheumatol,2005,15(2):91-96.
9 Jenks KA,Stamp LK,O’Donnell JL,et al. Leflunomide-associated infections in rheumatoid arthritis[J]. J Rheumatol,2007,34(11):2201-2203.
10 Meuli K,Chapman P,O’Donnell J,et al. Audit of pneumocystis pneumonia in patients seen by the Christchurch Hospital rheumatology service over a 5-year period[J]. Intern Med J,2007,37(10):687-692.
11 Ribes JA,Vanover-Sams CL,Baker DJ. Zygomycetes in human disease[J]. Clin Microbiol Rev,2000,13(2):236-301.
12 Nampoory MR,Khan ZU,Johny KV,et al. Invasive fungal infections in renal transplant recipients[J]. J Infect,1996,33(2):95-101.
13 Chkhotua A,Yussim A,Tovar A,et al. Mucormycosis of the renal allograft:case report and review of the literature[J]. Transpl Int,2001,14(6):438-441.

