猕猴桃白兰地专用酵母菌的选育及鉴定*
田殿梅,张良,,卢中明,,秦辉,侯长军,霍丹群
1(重庆大学生物工程学院,重庆,400044)2(国家固态酿造工程技术研究中心,泸州老窖股份有限公司,四川泸州,646000)
猕猴桃又名阳桃、茅梨,果实中除了含有大量VC外,还含有糖、钙、镁、铁、磷、有机酸以及多种氨基酸,是人们所喜爱的特色水果。据不完全统计,我国栽培猕猴桃面积已达4万余公顷,年产量达到近9万t。有关人士预测:我国现有的猕猴桃在全部进入盛果期后,产量会超过目前的消费需求。目前,猕猴桃的贮藏保鲜技术尚不完善,销售方式以鲜果为主,造成大量鲜果积压与腐烂,因此,对其进行深加工是发展的必然趋势。在酿酒方面,由于原料供应充足,具有显著的资源优势,有利于保护果农的栽培积极性,带动地方经济的发展。目前,我国在猕猴桃酒酿制过程中,缺乏猕猴桃酒专用菌种,使用的酵母基本是AADY活性酵母或是葡萄酒酵母,它不是猕猴桃酿酒的理想酵母,猕猴桃酒用酵母最好从成熟的猕猴桃果实上分离选育,性能可满足发酵彻底、产香能力强、产酸能力适度、对酒的风味贡献大等基本要求。本试验通过富集培养和划线分离源自成熟猕猴桃果皮、果汁自然发酵液中的微生物,并进行有效的分离筛选,通过稳定性测试、发酵力测试、发酵及蒸馏结果分析,筛选出适合猕猴桃白兰地的优良酿酒酵母[1-4],并通过ITS1-5.8S-ITS2 rDNA区域序列测定及系统发育分析对筛选菌株进行分子生物学鉴定[5]。
1 材料与方法
1.1 材料仪器
猕猴桃,四川长青县海沃特品种;葡萄糖、酵母膏、蛋白胨,北京奥博星生物技术有限公司;TTC(2,3,5-氯化三苯基四氮唑),Amresco;安琪酵母,安琪酵母股份有限公司。
7890 A/5975C气相色谱-质谱联用仪;美国Agilent公司;BIO-RAD mylyder,PCR扩增仪;SW-CG-1C超净工作台,苏净安泰;LDZX-50KBS高压蒸汽灭菌锅:上海申安医疗器械厂
1.2 方法
1.2.1 培养基的配制
TTC下层培养基:葡萄糖10.1 g,蛋白胨2.0 g,酵母浸膏1.5 g,酸性磷酸钾 1.0 g,硫酸镁 0.4 g,柠檬酸 0.27 g,琼脂 30.0 g,水 200 mL。
TTC上层培养基:TTC 0.05 g,葡萄糖0.5 g,琼脂 1.5 g,水 100 mL。
YPD培养基:酵母膏10 g,蛋白胨20 g,葡萄糖20 g,琼脂粉 20 g,加水至 1 000 mL。
1.2.2 酵母菌的分离
用腐烂猕猴桃的果皮及部分果肉加到新鲜猕猴桃汁中发酵后取发酵液25 mL,用无菌水稀释至250 mL,通过梯度稀释方法将稀释液接种至TTC分离培养基中培养,挑选出产酒精能力强的红色菌株[6],并通过划线培养进行分离纯化菌株,观察单菌落的形态大小,将分离出的单菌落接种于YPD斜面试管中,28℃培养2 d,置于4℃冰箱中保存备用。
1.2.3 酵母菌的初筛
采用杜氏管发酵法,将10 mL猕猴桃汁加入试管中,灭菌冷却后加入酵母菌,在相同的培养条件下,测定菌株产气能力,初步比较各株酵母菌的起酵能力和发酵能力,筛选发酵性能优良的菌株。记录产气时间和产气量,重复3次。活化条件:28℃条件下,10°Brix麦芽汁恒温振荡10 h:发酵条件:28℃条件下,猕猴桃汁静止发酵 48 h;接种量:l×106CFU/mL[7]。
1.2.4 酵母菌的复筛
按1×106CFU/mL的接种量,将筛选出的各菌种分别接至500 mL成分调整后的猕猴桃果浆中20℃培养,比较各酵母发酵力,以安琪酿酒酵母为对照菌株;待发酵结束后进行初次蒸馏,蒸馏条件:过滤发酵产物,取滤液400 mL,添加蒸馏水400 mL,功率选择600 W,截取滤液400 mL供分析检测。按照GB15038—2005规定的方法对各酵母酿造酒液进行理化测定[8]。猕猴桃果浆成分调整方法:用葡萄糖调整糖度至18%,用CaCO3调整果浆至pH3.6,SO2添加量为75 mg/L。
1.2.5 气相色谱-质谱分析条件
色谱柱条件:进样口温度250℃,起始温度50℃,保留3 min,以 5℃/min升至 220℃,保留 30 min,载气 He,检测器温度250℃。质谱条件:电离方式 EI,电离电压70 eV,恒压10 Pa,连接杆温度280 ℃,进样口温度为 250 ℃ 。[9]
1.3 菌株鉴定
1.3.1 形态学鉴定
将菌种接种到盛有 YPD固体培养基的平板中,28℃ 培养2~3 d后涂片,用美兰对细胞染色后镜检,观察其细胞形态;将活化好的酵母在产孢子培养基上划线,25℃ 培养3 d,镜检是否有子囊孢子。
1.3.2 分子生物学鉴定
1.3.2.1 基因组DAN提取
收集过夜培养的酵母细胞,在液氮中充分研磨后用4 mLDNA提取液溶解并转移至1.5 mL灭菌的离心管中,加入与离心管中DNA提取液等体积的氯仿-异戊醇(V∶V=24∶1),剧烈振荡后 13 000 r/min离心。取上清液用等体积氯仿-异戊醇重复处理1次。加入等体积预冷的异丙醇,混匀后于-20℃下静置15 min,13 000 r/min 离心 7 min。沉淀用 100 μL 70%无水乙醇各洗涤1次,真空抽干后加入50 μL无菌水,溶解后-20℃下保藏备用[10]。
1.3.2.2 ITS1-5.8S-ITS2 rDNA序列扩增
PCR扩增条件为95℃预变性5 min,95℃变性1 min,55℃退火 1 min,72℃ 延伸 2 min,共循环 35次,最后72℃延伸10 min,4℃保存,PCR产物纯化后测序。反应体系(25 μL)为:模板 DNA 3 μL 引物ITS1(10 mol/L)和 ITS4(10 mol/L)各 1μL,dNTPs(2.5 mmol)1 μL ,buffer 2.5μL,Taq 酶1 μL,用灭菌的双蒸水将体系补齐至25 μL。
1.3.2.3 克隆
对扩增的ITS1-5.8S-ITS2 rDNA序列进行纯化(按PCR产物纯化试剂盒说明进行操作),然后与克隆质粒PUM-T载体连接(参照产品说明书),4℃连接过夜,连接产物转化E.coli感受态细胞后,涂于含有 Amp(100 μg/mL)、IPTG(0.5 mmol/L),X-gal(80 μg/mL)的LB平板上,倒置培养过夜。用灭菌牙签挑取孵性克隆至5 mL的LB培养基(含5 μL 50 μg/mL Amp)中.37℃下200 r/min摇床培养24 h。
1.3.2.4 序列测定及系统发育树构建
将培养24 h的菌液送至华大基因有限公司进行测序,得到菌株PCR扩增片段的原始序列。在Gen-Bank核酸序列数据库中对得到的序列进行比对;为进一步显示供试菌株和已知酵母菌的亲缘关系及系统地位,根据同源序列搜索结果,采用MEGA5.0软件,Neighbour-Joining方法构建系统发育树,并进行1 000次 Bootstrap 检验[11]。
2 结果与分析
2.1 酵母菌的初筛
在TTC显色平板上共选取红色较深的菌落23株,酵母菌在含有杜氏小管的试管中20℃发酵48 h产气能达到约等于杜氏小管满体积的酵母菌有10株,说明这些酵母菌起酵能力比较强,可能有较高的发酵度和发酵效率,将这10株酵母菌作为出发菌株进行复筛。杜氏小管产气情况如表1所示。

表1 杜氏小管产气情况
2.2 酵母菌的复筛
将初筛到的10株酵母菌及对照菌株安琪酿酒酵母分别接种到20°Brix的猕猴桃果浆中20℃发酵10 d,测定其残糖、酒精度及总酸度,如表2所示。

表2 酵母菌发酵性能情况
通过GC-MS[12]分析不同酵母酿造的白兰地香气成分得知,猕猴桃白兰地酒中的非酒精挥发物,包括高级醇、酯类物质、挥发酸、以及醛酮类物质是主要的香气成分。这四类物质在猕猴桃白酒中的含量比较如图1。
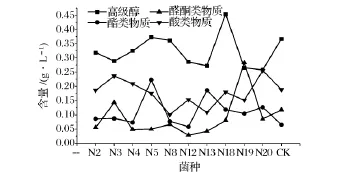
图1 各株酵母产高级醇、酯、醛酮及酸类物质能力比较
由图1可以看出N5和N13酵母酿造的白兰地产酯性能均较其他酵母优秀,同时其刺激性香气成分包括高级醇、醛酮类物质及酸类物质的含量较其他酵母酿造的白兰地均处于较低的水平。
其中具体香气成分中对猕猴桃白兰地贡献较大的主要有β-苯乙醇(PEA)、乙酸乙酯及丁酸乙酯,其中β苯乙醇(PEA)是一种带有淡雅细腻玫瑰气味的芳香醇;丁酸乙酯具有菠萝芳香气味;乙酸乙酯具有果香味。这些物质在猕猴桃白兰地中的含量比较如图2。
由图2可以看出各组酵母产β-苯乙醇的能力基本处于相同的水平,而N5产乙酸乙酯及丁酸乙酯的能力明显优于其他酵母,其中乙酸乙酯的含量为0.094 4 g/L,丁酸乙酯的含量为0.122 0 g/L;N13酵母发酵产物中乙酸乙酯含量为0.150 g/L。
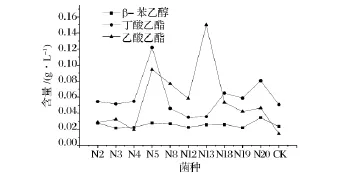
图2 各株酵母产β-苯乙醇、丁酸乙酯及乙酸乙酯能力比较
2.3 菌株形态学观察:
N5和N13酵母菌在PDA平板上培养2 d后形成的菌落呈椭圆形或卵圆形,乳白色,表面隆起,边缘整齐,表面光滑,无光泽,质地粘稠,闻其有酒香味;菌体细胞呈卵圆形,细胞为两端及多端出芽生殖(图3)。

图3 N5和N13酵母菌落形态及显微照片
2.4 DNA提取和PCR扩增结果
以ITS1和ITS4为引物通过酵母菌特异性PCR反应:扩增得到ITS1-5.8S-ITS2 rDNA序列扩增产生的DNA片段为单一条带,大小长度约为760bp,扩增产物无明显非特异扩增现象,结果见图4。

图4 N5与N13酵母ITS1-5.8S-ITS2 rDNA的PCR扩增结果
2.5 ITS1-5.8S-ITS2 rDNA序列相似性
对两株菌株的ITS-5.8S-ITS2序列进行分析,并将得到的序列与NCBI Gen-Bank核酸序列数据库中进行同源性序列搜索。比对结果显示,这2株菌株与葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)的相似性均达到99%,利用 MEGA 5.0软件,Neighbor Joining方法构建两株酵母与相关菌种的ITS1-5.8S-ITS2rDNA序列系统发育树,进行1000次的相似度重复计算(图5):结果表明,N5酵母和N13酵母均能与FR751341.1 Hanseniaspora uvarum聚在一起,与其遗传距离最近,并且置信度均达到97%。据此可以认为菌株N5与N13均属于Hanseniaspora uvarum有孢汉逊酵母属。

图5 N5和N13酵母ITS1-5.8S-ITS2 rDNA系统发育树
3 结论
本研究从腐烂的猕猴桃果实自然发酵液中成功分离得到2株酿造性能优良的酵母菌株N5和N13,在接种量为1×106CFU/mL、初始糖度为 18°Brix、SO2浓度为75 mg/L、初始pH值为3.6、发酵温度为20℃时,发酵10天,经过一次蒸馏后得到的白兰地在酒精度、乙酸乙酯及丁酸乙酯的含量方面均明显优于安琪酵母在相同条件下的酿造产物。经形态学和ITS1-5.8S-ITS2 rDNA分子生物学鉴定二者与葡萄汁汉逊酵母的相似度达到99%,通过构建其系统发育树得知,二者与葡萄汁汉逊酵母属于同种的置信度达到97%,据此可以认为菌株N5与N13均属于Hanseniaspora uvarum有孢汉逊酵母属。
[1]魏彦锋,蒋锡龙,孙玉霞,等.果酒酵母分离选育的研究进展[J].中外葡萄与葡萄酒,2008(6):66-69.
[2]赵芳.安琪牌葡萄洒活性干酵母在草莓酒酿造中的应用[J].中国酿造,2008(13):70 -72.
[3]李静.果酒酿造中优良酵母菌株的筛选[J].酿酒,2008,35(2):63-65.
[4]赵祥杰,陈卫东,刘学铭,等.果酒酵母选育研究进展[J].酿酒,2006,33(1):57 -59.
[5]Smith BJ,Sivasithamparam K.Internal transcribed spacer ribosomal DNA sequence of five species of Ganoderma from Australial[J].Mycol Res,2000,104(8):943 - 951.
[6]胡晓冰,王振伟.TTC法在筛选西瓜果酒酵母中的应用[J].酿酒科技,2011(2):69 -73.
[7]权英,张伟,李长文,等.酿造红枣果酒的酵母菌选种研究[J].食品与发酵工业,2004,30(11):39-41.
[8]GB/T15038-2005,葡萄酒、果酒通用试验方法[S].
[9]李华,涂正顺,王华,等.猕猴桃果酒香气成分的气相色谱/质谱分析[J].分析化学,2002(6):695 -698.
[10]牛广财,朱丹,王军,等.沙棘果酒优良酵母茵的筛选及分子生物学鉴定[J].中国食品学报,2009,9(6):60-65.
[11]Felsenstein J.Confidence limits on phylogenies:An approach using the bootstrap[J].Evolution,1985,39:783 -791.
[12]Heroult J,Bueno M,Potin Grautier M,et al.Organotin speciation in French brandies and wines by solid-phase microextraction and gas chromatography Pulsed flame photometric detection[J].Journal of Chromatography A,2008,1180(1 -2):122 -130.

