葛根素对高糖诱导的乳大鼠心肌细胞细胞因子及钙离子的影响
张 玲,许 薇,孙 媛,高俊虹
(1.辽宁医学院畜牧兽医学院,辽宁 锦州 121001;2.辽宁医学院附属第一医院,辽宁 锦州 121001;3.中国中医科学院针灸研究所,北京 100700)
糖尿病性心脏病(diabetic cardiomyopathy,DC)是糖尿病患者常见的慢性并发症之一。近年来,心肌细胞因子和钙离子在心血管疾病发病中的重要作用已日益受到重视。葛根素(Puerarin,Pue)为豆科植物野葛干燥根中的提取物。已有动物实验表明,Pue在心血管方面有调节肾素-血管紧张素系统(RAS)、血浆内皮素(endothelin,ET)和一氧化氮(nitric oxide,NO)含量[1],拮抗 β-肾上腺受体[2],降低心肌细胞钙离子浓度[3]等多方面作用。但因整体动物实验影响的因素较多,且是否对高糖诱导的心肌细胞有影响少见报道。本实验用培养的新生大鼠心肌细胞研究Pue对高糖诱导的心肌细胞 NO、ET和钙离子的影响,为进一步Pue在DC方面的应用提供基础及实验依据。
1 材料与方法
1.1 动物、药品与试剂
出生2d~3d的SD大鼠乳鼠,雌雄不拘,由辽宁医学院实验动物中心提供(动物许可证号 SCXK(辽)2007-2011)。Fura-2、HEPES、低 糖 培 养 基DMEM、胰蛋白酶、MTT试剂均购自美国 Sigma公司;NO试剂盒购自南京建成生物工程公司;ET试剂盒购自北京放免技术研究所;Pue购自广东燕塘生物化学药业有限公司;小牛血清为杭州四季青生物材料研究所产品,其他试剂均为分析纯。
1.2 大鼠乳鼠心肌细胞原代培养
取出生2d~3d的 SD大鼠乳鼠,雌雄不拘,引颈法处死动物。无菌条件下用75%乙醇消毒皮肤,开胸剪取心脏,放入盛有无血清培养液的冰冷容器,用磷酸盐缓冲溶液(PBS)洗涤3次后,剪成1mm3大小的碎块,加入0.6 g/L胰蛋白酶消化细胞。将消化完毕的细胞置入含有体积分数分别为0.15的小牛血清、0.84的 DMEM培养基及0.01的双抗液(含100KU/L青霉素,100mg/L链霉素)的培养基。将细胞悬液吹打均匀,以1×108/L的密度接种于24孔培养板,送入5%CO2及95%空气的 CO2孵箱中培养。
1.3 分组及给药方法
常规培养心肌细胞2d~3d后,更换含0.4%小牛血清的培养基,以减少血清成分对实验结果的影响。设不给药组为空白对照组,其他组分别给药:给予 25mmol/L 高糖(highglucose,HG)组、HG+10-3mol/L Pue组 (Pue先孵育30min)、25mmol/L HG+2×l0-3mol/L Pue组(Pue先孵育 30min)。继续培养2d~3d后进行各项指标的测定。
1.4 MTT法测定心肌细胞的存活率
取1.3中经各药物处理48h的细胞接种于96孔板中,加入 MTT(5 g/L)20μL,置 37℃5%CO2培养箱中孵育4 h后去除培养基后,加入150μl DMSO溶解结晶体,轻轻晃动15min~20min后,酶标仪在波长为490 nm处测定吸光度(A)值,用此计算细胞的存活率。
1.5 NO和ET浓度的测定
取细胞培养液,10000r/min,离心 10min取上清,硝酸还原酶法检测各组NO浓度,放免法测定各组ET-1含量。
1.6 Ca2+的测定
将有自发性搏动的心肌细胞从培养板中取出,置于含有 Fura-2/AM(3μmol/L)的 DMEM培养基中,其中含有白蛋白0.2%,在37℃水浴中孵育30 min,用HEPES缓冲液冲洗后,放于荧光显微镜下的灌流槽中,恒温37℃,用 HEPES缓冲液冲洗灌流,灌流速度为1mL/min,所有药物均在指定时间加入灌流液中。所用的测定仪器为Till阳离子测定系统(德国)采用 DM3000软件,激发光波长分别为340 nm及380 nm,发射光波长为505 nm,采样间隙为300ms。每次选取10个细胞,测量心肌细胞[Ca2+]i的瞬间变化,连续记录心肌细胞在给药前后的荧光强度。根据文献[4]方法计算心肌细胞[Ca2+]i,计算[Ca2+]i前应减去细胞自身的荧光。
1.7 统计学处理
数据均采用 SPSS 13.0统计软件进行统计分析,计量资料用均数±标准差(±s)表示,2组间比较采用两样本均数的t检验,多组间均数比较采用方差分析。以 P<0.05为差异有显著性,P<0.01为差异有非常显著性。
2 结果
2.1 Pue对心肌细胞存活率的影响
表1显示,与空白组相比,HG组的细胞存活率降低了36.6%,差异极显著(P<0.01);与高糖组相比,HG+10-3mol/L Pue组和 HG+2 × l0-3mol/L Pue组分别增加了46.2%和53.8%,差异具有统计学意义。
2.2 Pue对心肌细胞NO和 ET的影响
表2显示,HG组细胞的NO水平较对照组降低38.24%,ET水平则升高27.4%,差异极显著(P<0.01);Pue 2个治疗组较 HG组的2项指标有显著性改善,其中 2×l0-3mol/LPue组效果更好,与HG组的差异也最显著(P<0.01)。
表1 Pue对HG诱导的乳大鼠心肌细胞存活率的影响(±s)

表1 Pue对HG诱导的乳大鼠心肌细胞存活率的影响(±s)
注:与正常对照组比较:**P <0.01;与模型组比较:△P <0.05,△△P<0.01
组别A570 0.82 ±0.03 HG(2 5 mmol/L)组 0.52 ±0.02**HG +1 0 -3mol/LPue 组 0.77 ±0.03△HG+2 × l0-3mol/LPue组 0.80 ±0.02空白组△△
表2 Pue对HG诱导心肌细胞NO和ET的影响(±s)
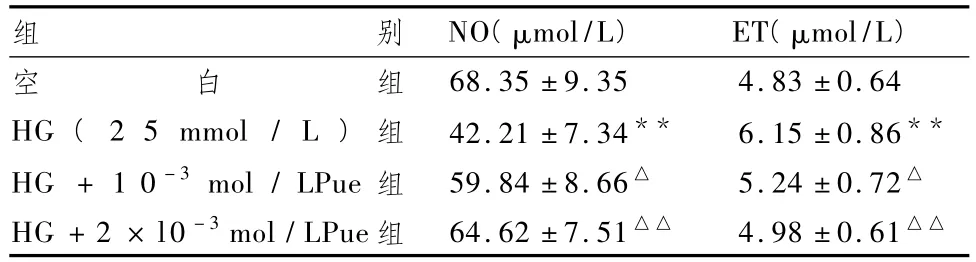
表2 Pue对HG诱导心肌细胞NO和ET的影响(±s)
注:与正常对照组比较:**P <0.01;与模型组比较:△P <0.05,△△P<0.01
组别 NO(μmol/L)ET(μmol/L)68.35 ±9.35 4.83 ±0.64 HG(2 5 mmol/L)组 42.21 ±7.34** 6.15 ±0.86**HG +1 0-3mol/LPue 组 59.84 ±8.66△ 5.24 ±0.72△HG+2 × l0-3mol/LPue组 64.62±7.51△△ 4.98±0.61空白组△△
2.3 Pue对心肌细胞Ca2+的影响
表3显示,HG组心肌细胞[Ca2+]i变化的基线水平与空白组接近,但[Ca2+]i瞬间变化幅度明显增高,频率显著性加快(P<0.01)。Pue 2个剂量组均能降低显著性HG诱导的心肌细胞钙离子瞬间变化,其中在变化幅度上2×l0-3mol/LPue组改善效果更好。
表3 Pue对HG诱导心肌细胞[Ca2+]i瞬间变化的影响(±s)
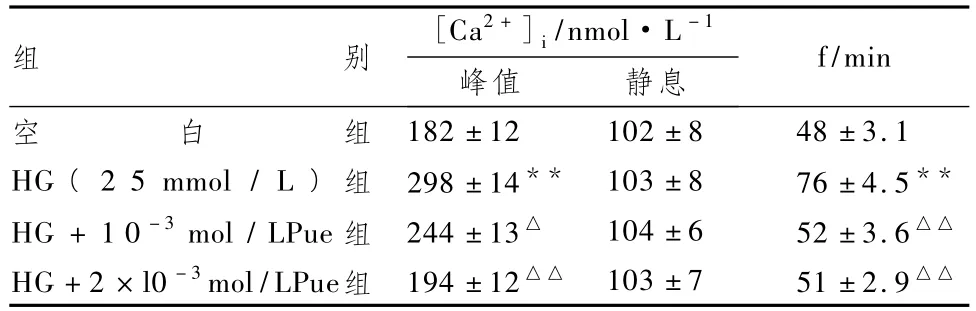
表3 Pue对HG诱导心肌细胞[Ca2+]i瞬间变化的影响(±s)
注:与正常对照组比较:**P <0.01;与模型组比较:△P <0.05,△△P<0.01
组别 [Ca2+]i/nmol·L -1 f/min峰值 静息182±12 102±8 48±3.1 HG(2 5 mmol/L)组 298±14** 103±8 76±4.5**HG+1 0-3mol/LPue组 244±13△ 104±6 52±3.6△△HG+2×l0-3mol/LPue组 194±12△△ 103±7 51±2.9空白组△△
3 讨论
ET是一种很强的缩血管活性肽,由心肌细胞和成纤维细胞合成并分泌。体内外研究表明,ET既可以促进心肌细胞和血管平滑肌合成释放AngⅡ,又是醛固酮合成和释放的强效调节剂。ET及其受体的表达也与糖尿病大鼠心肌纤维化有关,高血糖可引起内皮素受体上调,应用ET受体拮抗剂可对抗高糖下心肌缺血再灌注引起的心肌细胞损伤[5]。NO是内皮细胞合成和分泌的一种内源性调节因子,它有许多血管生理调节功能,如舒张血管、降低血压;维持血管内膜表面无血栓形成,抑制血管平滑肌细胞增殖,维持其正常的有丝分裂;维持正常的心肌收缩功能及心输出量等。有报道显示[6、7],高糖可引起内皮细胞NO合成减少,血液中NO浓度降低,血管平滑肌NO/cGMP通路反应异常。
本实验结果显示,在低血清培养环境下,HG会使培养心肌细胞存活率和NO浓度下降,ET水平增加;应用Pue干预的2组可以使高糖环境的心肌细胞在上述指标方面产生明显改善,即细胞存活率和NO含量较 HG升高,ET水平下降,且2×10-3mol/LPue组效果更好。这说明Pue可以通过影响心肌细胞相关因子水平抑制高糖产生的不良影响。
Ca2+是心肌细胞最重要的信号分子之一,生理状态下主要参与心肌细胞的机械做功和能量代谢。大量实验表明,Ca2+作为一个细胞信号传导过程中的主要信使,介导了糖尿病心肌肥大的形成和发展[8、9]。心肌细胞内 Ca2+超载是糖尿病性心肌病的发病原因之一。ET可增加心肌细胞和成纤维细胞的有丝分裂,直接引起心肌细胞钙超载[10]。李菊香研究发现,Pue能抑制外源性氧化型低密度脂蛋白培养的脐静脉内皮细胞产生一氧化氮合酶(NOS)抑制物,使NO合成增加,ET减少,细胞内[Ca2+]i下降,从而改善内皮细胞功能[11]。本次实验结果可见,HG组与空白组相比心肌细胞钙离子的峰幅度显著升高(P<0.01),频率明显加快(P<0.01);Pue 2个治疗组可以显著改善高糖环境心肌细胞的上述指标,而且结果仍提示2×l0-3mol/LPue组的效果更好。
综上所述,本实验证实Pue能够有效地干预高糖诱导的心肌细胞因子的改变和钙超载,提示这可能是葛根素抑制高糖诱导心肌细胞损伤发生的保护机制之一。
[1]Xie RQ,Du J,Hao YM.Myocardial protection and mechanism of Puerarin Injection on patients of coronary heart disease with ischemia/reperfusion[J].Zhongguo Zhong Xi Yi Jie He Za Zhi,2003,23(12):895-897.
[2]吕欣然,高 尔,许兰芝.葛根素对含 β-肾上腺受体的离体器官和整体动物的阻断作用[J].中国药理学报,1986;7(6):537-539.
[3]张 玲,王洪新,高俊虹,等.葛根素对异丙肾上腺素致大鼠心肌肥厚心肌胶原及细胞内钙离子的影响[J].中成药,2008,30(8):1220-1222.
[4]Chen S,Khan ZA,Karmazyn M,et al.Role ofendothelin-1,sodium hydrogen exchanger-1 andmitogen activated protein kinase(MAPK)activation in glucose-induced cardiomyocyte hypertrophy[J].DiabetesMetab Res Ren,2007,23(5):356-367.
[5]Subodh Verma, Andrew Maitland, Richard D, et al.Hyperglycemia exaggerates ischemia-reperfusion-induced cardiomyocyte injury:Reversal with endothelin antagonism[J].Thoracic and Cardiovascular Surgery,2002,123(6):1120-1124.
[6]Tesfamariam B.Free radicalsin diabetic endothe-lialcell dysfunction[J].Free Radic Biol Med,1994,16:383.
[7]Pieper Gm,Mei DA,Langenstroer P,et al.Bioassay of endothelium-derived relaxing factor in diabetic rat aorta[J].Am J Physiol,1992,263:676.
[8]Jorn op den Buijs,Zsuzsanna Mikols,Natal A.W.van Riel,et al.β-Adrenergic activation reveals impaired cardiac calcium handing at early stage of diabetes[J].Life Sciences,2005,76(10):1083-1098.
[9]Natale Rolim,Tomas Stolen,Charlotte B,et al.Aerobic interval training prevents cardiac dysfunction and mortality by improving calcium handing in MI diabetic mice[J].Biophysical Journal,2010,98(3):101a.
[10]Jennings G,Wong J.Regression of left ventricular hypertrophy in hypertension:changing patterns with successice meta-analyses[J].J Hypertens,1998 16(suppl 6):S29-S34.
[11]李菊香,罗 伟,汪进益,等.葛根素对ox-LDL培养血管内皮细胞内圆形一氧化氮合酶抑制物代谢的研究[J].中国药科大学学报,2004,35(4):353-356.

