环氧化酶2 3′非翻译区+8473T>C基因多态性及其与吸烟、幽门螺杆菌感染的交互作用对食管癌发病的影响研究
卢玉娟,张红岩,代素梅,黎 杰,张 志
食管癌是危害人类生命和健康的严重疾病之一,在全世界范围内的发病率和病死率均较高。虽然临床上治疗食管癌的技术不断改善和提高,但是总体上的疗效并不令人满意。目前,食管癌的病因及发病机制尚不完全清楚。研究表明,饮食因素和环境因素是我国食管鳞癌的最主要危险因素,吸烟是重要的环境致癌因素,在食管癌的发生发展中起重要作用;近年来分子流行病学研究提示,基因多态性也是肿瘤个体易患因素[1-2]。
环氧化酶2(COX-2)是花生四烯酸代谢的关键酶,COX-2的高表达与包括食管癌在内的多种肿瘤的发生密切相关[3-6]。机体在正常情况下,COX-2的表达是被精确控制的,而在恶性转化细胞COX-2的表达调控能力发生了改变;COX-2基因转录调节缺失及其后发生的mRNA降解失调均可导致COX-2的表达增高[7-8],进而增强肿瘤生长及侵袭转移能力。研究发现,COX-2 3′非翻译区(UTR)+8473T>C基因多态性与乳腺癌、非小细胞肺癌的发病风险增加密切相关[9-10],已知幽门螺杆菌在食管癌的发生发展中起重要作用,且幽门螺杆菌感染可诱导COX-2表达。本研究采用病例对照研究方法探讨COX-2 3′UTR+8473T>C基因多态性及其与吸烟、幽门螺杆菌感染的交互作用对食管癌发病的影响。
1 对象与方法
1.1 研究对象 选择2006年1月—2011年1月在唐山市工人医院进行治疗的食管癌患者119例为病例组,均经组织病理学检查确诊,术前未进行放化疗;按照2∶1比例选择同期体检正常者238例为对照组,均无肿瘤病史和体征。按照美国肿瘤联合会(AJCC)2002年制定的肿瘤TNM分期标准,病例组患者中Ⅰ期20例、Ⅱ期37例、Ⅲ期55例、Ⅳ期7例。
1.2 方法
1.2.1 基因分型 COX-2 3′UTR+8473T>C基因多态性的基因分型采用聚合酶链反应-限制性片段长度多态性技术(PCR-RFLP)进行。具体如下:扩增3′UTR含8473C/T多态性位点的引物为u8473F 5′-GTT TGA AAT TTT AAA GTA CTT TTG AT-3′和u8473R 5′-GAC ATG AAA TTA CTG GTA ATG TCT-3′,产物长度为110 bp。限制性核酸内切酶 BclⅠ(New England Biolabs,MA)用于 8473C→T多态性位点的基因型分析。酶切在10 μl反应体系中进行,其中含8 μl 聚合酶链反应(PCR)产物、1×反应缓冲液和3 U相应核酸内切酶。将反应混合液置于37 ℃水浴4 h,限制性酶切产物在3%琼脂糖凝胶上电泳,判断其基因型。在8473C→T多态性位点上游第2个碱基处引入错配碱基A后,8473C等位基因产生一个BclⅠ酶切位点,而8473T等位基因不含BclⅠ酶切位点,因此TT基因型产生一个110 bp片段,CC基因型产生88 bp和22 bp共2个片段,而CT基因型产生110 bp、88 bp和22 bp共3个片段。
1.2.2 幽门螺杆菌感染状态 参考文献[11]中的方法,采用酶联免疫吸附实验(ELISA)检测两组受试者血清幽门螺杆菌抗体IgG和IgA水平,以IgA或IgG水平>1.0 U判定为幽门螺杆菌抗体阳性,表示有幽门螺杆菌感染。

2 结果
2.1 一般资料 两组受试者的性别构成、平均年龄、吸烟率及血清幽门螺杆菌抗体阳性率比较,差异均无统计学意义(P>0.05,见表1)。

表1 两组一般资料比较
注:*为t值
2.2 COX-2 3′UTR+8473T>C基因型分布 两组受试者TT、TC、CC基因型频率比较,除TT基因型外,差异均无统计学意义(P>0.05,见表2);对照组COX-2 3′UTR+8473C等位基因频率为0.134,病例组为0.210,均符合Hardy-Weinberg平衡定律。非条件Logistic回归分析显示,病例组携带1个C等位基因、2个C等位基因、TC+CC基因型者的食管癌发病风险分别为对照组的1.60倍〔95%CI(0.91,2.83),P=0.08〕、3.29倍〔95%CI(1.10,11.62),P=0.03〕、1.76倍〔95%CI(1.12,2.93),P=0.02〕。
表2 两组COX-2 3′UTR+8473T>C基因型分布〔n(%)〕
Table2 Distribution of COX-2 3′UTR+8473T>C genotype between the two groups

组别例数TTTCCC对照组238179(75 2)54(22 7)5(2 1)病例组119 76(63 9) 36(30 1)7(6 0)χ2值5 002 413 49P值0 030 120 06
2.3 COX-2 3′UTR+8473T>C基因多态性与吸烟的交互作用 在吸烟人群中,病例组携带COX-2 3′UTR+8473C等位基因者食管癌发病风险是对照组的2.11倍,差异有统计学意义(P<0.05);在非吸烟人群中,病例组携带COX-2 3′UTR+8473C等位基因者食管癌发病风险是对照组的1.34倍,但差异无统计学意义(P>0.05,见表3)。
表3 COX-2 3′UTR+8473T>C基因多态性与吸烟的交互作用(例)
Table3 Crosscorrelation of COX-2 3′UTR+8473T>C polymorphisms and smoking
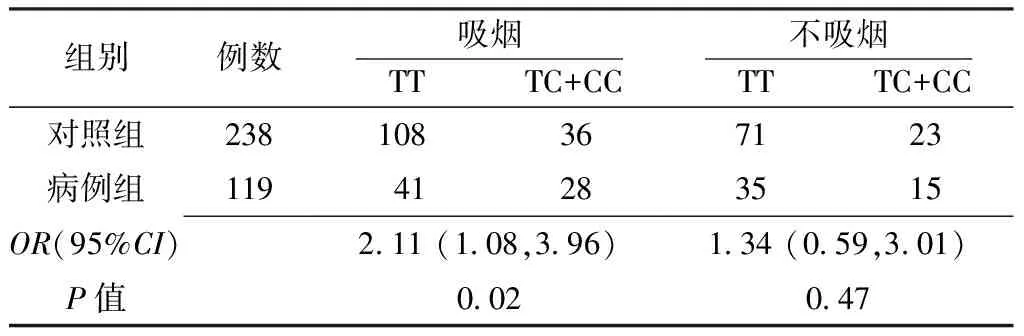
组别例数吸烟 TT TC+CC不吸烟 TT TC+CC对照组238108367123病例组119 41 283515OR(95%CI)2 11(1 08,3 96)1 34(0 59,3 01)P值0 020 47
2.4 COX-2 3′UTR+8473T>C基因多态性与幽门螺杆菌感染的交互作用 在血清幽门螺杆菌抗体阳性人群中,病例组携带COX-2 3′UTR+8473C等位基因者食管癌发病风险是对照组的3.98倍,差异有统计学意义(P<0.001);在血清幽门螺杆菌抗体阴性人群中,病例组携带COX-2 3′UTR+8473C等位基因者食管癌发病风险是对照组的0.86倍,但差异无统计学意义(P>0.05,见表4)。
表4 COX-2 3′UTR+8473T>C基因多态性与幽门螺杆菌感染的交互作用(例)
Table4 Crosscorrelation of COX-2 3′UTR+8473T>C polymorphisms and Helicobacter pylori infection

组别例数幽门螺杆菌抗体阳性 TT TC+CC幽门螺杆菌抗体阴性 TT TC+CC对照组238101197840病例组119 34 254218OR(95%CI)3 98(1 85,8 46)0 86(0 39,1 80)P值<0 0010 60
3 讨论
在人类基因组中,mRNA的转化是一个被高度调控的过程,在哺乳动物基因表达过程中起关键作用。人类COX-2 3′UTR含有22个AUUUA重复序列,可能通过改变多聚腺苷酸位点改变mRNA的长度,从而影响mRNA的降解。对许多哺乳动物COX-2 mRNA进行的分析表明,COX-2的AU元件(ARE)可以被调控而影响COX-2的表达[8,12-13]。ARE调控基因表达是通过和反式作用的RNA结合蛋白相互作用而实现的。COX-2 3′UTR+8473T>C基因多态性可能通过改变mRNA的降解而影响mRNA及其相应蛋白的表达水平,最终影响包括肿瘤在内的复杂疾病的发病进程。
本研究对COX-2基因多态性与食管癌发病风险的关系进行研究,发现携带COX-2 3′UTR+8473C等位基因者食管癌发病风险明显增加,与Langsenlehner等[10]报道其增加乳腺癌发生风险和Campa等[14]报道其增加非小细胞肺癌一致。但Hu等[15]研究结果显示COX-2 3′UTR+8473T>C基因多态性可降低肺癌发生风险[15],提示肿瘤发生发展中除遗传因素外,其他因素同样发挥着重要作用。因此,本研究对COX-2 3′UTR+8473T>C基因多态性与吸烟、幽门螺杆菌感染的交互作用对食管癌发病的影响做了进一步分析。
吸烟是公认的致癌物,特别是肺癌,近年来关于吸烟与食管癌发病风险的研究也有报道。Hashibe等[16]对包括1 000例食管癌患者的人群进行研究,发现吸烟个体罹患食管癌的风险是不吸烟者的7.41倍,本研究结果与之基本一致,提示携带COX-2 3′UTR+8473C等位基因者可能更容易被吸烟而诱导COX-2 mRNA的表达,对吸烟所引起的损伤更敏感。
幽门螺杆菌感染是食管癌重要的危险因素之一,目前认为幽门螺杆菌感染引发炎症反应主要与COX-2有关[17]。研究表明,幽门螺杆菌可诱导白介素(IL)-8、IL-1 和核因子(NF)-κB等细胞因子表达,而这些细胞因子可通过激活细胞内多种细胞调节因子而增加COX-2 mRNA的表达[18-19]。本研究结果显示,在幽门螺杆菌感染人群中,携带COX-2 3′UTR+8473C等位基因者食管癌发病风险明显增加,提示携带COX-2 3′UTR+8473C等位基因者可能更容易被幽门螺杆菌感染而诱导COX-2 mRNA的表达,从而易患食管癌。
总之,COX-2 3′UTR+8473T>C基因多态性是影响食管癌发病的重要的遗传易患因素,可增加食管癌发病风险,且与吸烟、幽门螺杆菌感染存在交互作用。但本研究样本量较小,由于条件有限并未对其他环境因素进行综合分析,存在一定的混杂因素,仍需进一步深入研究。
1 Cheung WY,Liu G.Genetic variations in esophageal cancer risk and prognosis[J].Gastroenterol Clin North Am,2009,38(1):75-91,viii.
2 Hiyama T,Yoshihara M,Tanaka S,et al.Genetic polymorphisms and esophageal cancer risk[J].Int J Cancer,2007,121(8):1643-1658.
3 Richardsen E,Uglehus RD,Due J,et al.COX-2 is overexpressed in primary prostate cancer with metastatic potential and may predict survival.A comparison study between COX-2,TGF-beta,IL-10 and Ki67[J].Cancer Epidemiol,2010,34(3):316-322.
4 Li Z,Schem C,Shi YH,et al.Increased COX2 expression enhances tumor-induced osteoclastic lesions in breast cancer bone metastasis[J].Clin Exp Metastasis,2008,25(4):389-400.
5 Yu HP,Shi LY,Lu WH,et al.Expression of cyclooxygenase-2(COX-2)in human esophageal cancer and in vitro inhibition by a specific COX-2 inhibitor,NS-398[J].J Gastroenterol Hepatol,2004,19(6):638-642.
6 Zhang H,Sun XF.Overexpression of cyclooxygenase-2 correlates with advanced stages of colorectal cancer[J].Am J Gastroenterol,2002,97(4):1037-1041.
7 Liu X,Li P,Zhang ST,et al.COX-2 mRNA expression in esophageal squamous cell carcinoma(ESCC)and effect by NSAID[J].Dis Esophagus,2008,21(1):9-14.
8 Dixon DA.Dysregulated post-transcriptional control of COX-2 gene expression in cancer[J].Curr Pharm Des,2004,10(6):635-646.
9 Zhu W,Wei BB,Shan X,et al.-765G>C and 8473T>C polymorphisms of COX-2 and cancer risk:a meta-analysis based on 33 case-control studies[J].Mol Biol Rep,2010,37(1):277-288.
10 Langsenlehner U,Yazdani-Biuki B,Eder T,et al.The cyclooxygenase-2(PTGS2)8473T>C polymorphism is associated with breast cancer risk[J].Clin Cancer Res,2006,12(4):1392-1394.
11 Zhang X,Miao X,Tan W,et al.Identification of functional genetic variants in cyclooxygenase-2 and their association with risk of esophageal cancer[J].Gastroenterology,2005,129(2):565-576.
12 Khabar KS.Post-transcriptional control during chronic inflammation and cancer:a focus on AU-rich elements[J].Cell Mol Life Sci,2010,67(17):2937-2955.
13 Dixon DA,Kaplan CD,McIntyre TM,et al.Post-transcriptional control of cyclooxygenase-2 gene expression.The role of the 3′-untranslated region[J].J Biol Chem,2000,275(16):11750-11757.
14 Campa D,Zienolddiny S,Maggini V,et al.Association of a common polymorphism in the cyclooxygenase 2 gene with risk of non-small cell lung cancer[J].Carcinogenesis,2004,25(2):t229-235.
15 Hu Z,Miao X,Ma H,et al.A common polymorphism in the 3′UTR of cyclooxygenase 2/prostaglandin synthase 2 gene and risk of lung cancer in a Chinese population[J].Lung Cancer,2005,48(1):11-17.
16 Hashibe M,Boffetta P,Janout V,et al.Esophageal cancer in Central and Eastern Europe:tobacco and alcohol[J].Int J Cancer,2007,120(7):1518-1522.
17 Seo JH,Kim H,Kim KH.Cyclooxygenase-2 expression by transcription factors in Helicobacter pylori-infected gastric epithelial cells:comparison between HP 99 and NCTC 11637[J].Ann N Y Acad Sci,2002(973):477-480.
18 Abdel-Latif MM,Windle H,Terres A,et al.Helicobacter pylori extract induces nuclear factor-kappa B,activator protein-1,and cyclooxygenase-2 in esophageal epithelial cells[J].J Gastrointest Surg,2006,10(4):551-562.
19 Jüttner S,Cramer T,Wessler S,et al.Helicobacter pylori stimulates host cyclooxygenase-2 gene transcription:critical importance of MEK/ERK-dependent activation of USF1/-2 and CREB transcription factors[J].Cell Microbiol,2003,5(11):821-834.

