以白酒酒糟为原料发酵产丁二酸*
周小兵,郑璞
(工业生物技术教育部重点实验室,江南大学生物工程学院,江苏无锡,214122)
丁二酸又名琥珀酸,是三羧酸循环的中间产物,在农业、医药、食品、化工领域有着广泛的应用[1]。目前商业化的丁二酸主要由化学法制得[2],该法依赖于不可再生的石化资源,同时存在环境污染问题[3]。微生物厌氧发酵生产丁二酸是利用微生物将糖和CO2转化成丁二酸,可以摆脱丁二酸产品对化石原料的依赖,具有环境友好,缓解温室效应的优势。生物基丁二酸2004年经美国能源部评估,被认为是未来12种最有价值的生物基化学品之一[3]。虽然微生物发酵法生产丁二酸具有广阔的前景,但发酵成本偏高影响着其工业化的进程,而寻找廉价易得的原料是降低成本的有效手段之一。
白酒酒糟是酿酒工业最主要的副产物,2011年我国白酒产量达到1 025.55万kL[4],固态法生产1 t白酒约产生10 t酒糟[5],我国白酒酒糟产量近1亿t。湿酒糟含有大量水分(60% ~70%),还有残余糖和淀粉,酸度高,不易保存,容易腐烂变质,造成严重的环境污染。同时酒糟中含有的纤维素、蛋白质、氨基酸、维生素和多种微量元素也得不到合理有效的利用,造成资源浪费。目前对酒糟的综合利用开始受到广泛的关注,除了传统的作为饲料[6]和肥料[7],利用酒糟培养食用菌[8],提取蛋白质[9]、植酸[10]、复合氨基酸和微量元素[11],以及利用发酵生产沼气[12]、食醋[13]、甘油[14]等的研究也在进行。本课题组先后开展了以废糖蜜[15]、菊芋[16]和秸秆[17]为原料发酵产丁二酸的研究。本文旨在研究以白酒酒糟为原料发酵生产丁二酸的工艺路线,一方面为发酵丁二酸生产提供新的原料来源,另一方面又为白酒酒糟综合利用提供新的途径。
1 材料与方法
1.1 材料
1.1.1 菌种与酶
琥珀酸放线杆菌A.succinogenes F3-21,由本实验室保藏[18];纤维素酶10 000 U/mL,购自康地恩生物集团;纤维二糖酶购自Sigma公司,≥250 U/mL。耐高温α-淀粉酶20 000 U/mL,购自山东杰诺生物酶有限公司;糖化酶(100 000 U/mL)购自山东隆大生物工程有限公司。
1.1.2 原料
白酒酒糟,由四川泸州老窖集团有限公司提供,经干燥粉碎,过40目筛,其成分经测定为:粗蛋白17.15%,粗纤维37.91%(木质素10.68%,纤维素19.34%,半纤维素7.89%,其中纤维素半纤维素共27.23%,为方便表述将其统称为纤维素),粗脂肪6.02%,无氮浸出物 39.76%,灰分 9.16%,淀粉12.35%。
1.1.3 培养基
种子活化培养基:参照文献[18]。
分批发酵培养基(g/L):白酒酒糟80~400酶水解液(含固型物),K2HPO4·3H2O 1.5,NaH2PO4·2H2O 1.5,MgCl2 ·6H2O 0.2,CaCl20.2。
同步糖化发酵培养基(g/L)白酒酒糟:160~320,K2HPO4·3H2O 1.5,NaH2PO4·2H2O 1.5,MgCl2·6H2O 0.2,CaCl20.2。
1.1.4 仪器
SHZ-88A往复式恒温水浴振荡器,苏州培英实验设备有限公司;752紫外可见光分光光度计,上海精密科学仪器有限公司;厌氧培养箱YQX-Ⅱ上海跃进医疗器械厂;7 L搅拌发酵罐,NBS BIOFLO 110 Fermentor;高效液相色谱仪,美国Waters 1512。
1.2 方法
1.2.1 成分分析方法
粗纤维成分分析采用Van Soest法[19],蛋白质含量分析方法采用凯氏定氮法[19],淀粉含量分析采用酸水解法[19],粗脂肪含量分析采用索氏抽提法[19],灰分分析方法采用灼烧法,还原糖含量测定采用3,5-二硝基水杨酸比色法[20],有机酸含量分析方法采用离子排斥高效液相色谱法[21]。
1.2.2 白酒酒糟中纤维素与淀粉的水解
纤维素水解:称8 g酒糟,加水25 mL调pH至4.8,加纤维素酶和纤维二糖酶(用量分别为5 000 U/g DGS和50 U/g DGS)于50℃恒温水浴水解。
淀粉水解:10 g酒糟加水至25 mL,加α-淀粉酶(2 400 U/g DGS)于90℃液化1 h,冷却调 pH 4.5,加糖化酶(1 800 U/g DGS)于60℃恒温水浴水解。
淀粉和纤维素分步水解:10 g酒糟加水至25 mL,按上述的酶用量与水解条件,先纤维素或淀粉依次水解。
淀粉和纤维素同时水解:10 g酒糟加水至25 mL,先加 α-淀粉酶液化,90℃1 h再调 pH 4.5 ~4.8,同时加入纤维素酶和淀粉酶,在50℃或60℃下恒温水解。
1.2.3 发酵方法
分步糖化发酵:2、4、6、8、10 g 酒糟分别加水至25 mL,先加纤维素酶和纤维二糖酶在50℃、pH 4.8条件下恒温水浴8 h,然后加 α-淀粉酶在90℃ pH 6.0条件下液化1 h,再加糖化酶在60℃、pH 4.5条件下恒温水浴4 h,然后补加无机盐配制成发酵培养基,调节 pH 6.5,121℃灭菌 20 min,37℃在 CO2环境下培养48 h,分析发酵液有机酸含量。
同步糖化发酵:4、5、6、7、8 g 酒精加水至 25 mL,先加纤维素酶和纤维二糖酶在50℃ pH 4.8条件下水解8 h,然后再加α-淀粉酶在90℃ pH 6.0条件下液化1 h,然后补加无机盐配制成发酵培养基,调节pH 6.5,121℃灭菌20 min,接种发酵20 h后,加入膜滤的糖化酶,37℃在CO2环境下培养48 h,分析发酵液有机酸含量。

其中,c为还原糖浓度,g/L;c0为丁二酸浓度,g/L;C为酒糟浓度,g/L;ω1,ω2分别为酒糟中纤维素半纤维素含量;ω3为酒糟中淀粉含量。
2 结果与讨论
2.1 白酒酒糟中纤维素和淀粉的分别水解
2.1.1 纤维素酶水解酒糟
白酒酒糟含有约37.91%的粗纤维(其中纤维素和半纤维素共27.23%),加纤维素酶和纤维二糖酶后纤维素和半纤维素转化为还原糖,可供琥珀酸放线杆菌利用。图1显示,在50℃,pH 4.8条件下,前4 h白酒酒糟中纤维素的水解速率最快,4 h至8 h期间水解速率减慢,8 h之后,还原糖量增加极少,水解率为43.31%,最终还原糖浓度达到35.5 g/L,还原糖对酒糟得率约110 mg/g酒糟,纤维素水解率为44.04%,为减少能耗,水解时间确定为8 h。

图1 水解时间对酒糟纤维素水解的影响Fig.1 Effect of time on hydrolysis of cellulose in SDG
2.1.2 糖化酶水解酒糟
酒糟中残留12.35%淀粉,通过α-淀粉酶和糖化酶水解后,才能被琥珀酸放线杆菌利用。如图2所示,400 g/L酒糟中淀粉经过α-淀粉酶水解后,加入糖化酶,经4 h还原糖浓度达到49.8 g/L,水解率为90.67%,4 h后还原糖含量略有增加,最终还原糖浓度为50.6 g/L,还原糖对酒糟得率约126 mg/g酒糟,淀粉水解率为92.26%。
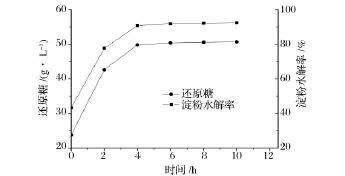
图2 时间对酒糟淀粉水解的影响Fig.2 Effect of time on hydrolysis of starch in SDG
2.2 纤维素酶和糖化酶共同水解白酒酒糟
如表1所示,先水解白酒酒糟中的纤维素,后水解其中的淀粉时,淀粉水解率仅为8.6%;而先水解白酒糟中淀粉再加纤维素酶水解其中的纤维素时,纤维素水解率也仅为9.1%。后者总还原糖得率略高,但远低于两种酶单独作用之和(110+126)mg/g,其原因可能是葡萄糖浓度达到一定量时,糖苷水解酶活性受到产物的反馈抑制,后水解组分水解率低。分别在纤维素酶或糖化酶作用的最适反应温度和pH条件下,同时用两种酶进行水解酒糟,结果两者水解所产生的还原糖浓度相差不大(约为60 g/L),且与分步水解的总还原糖得率相当,进一步说明了产物对糖苷水解酶的抑制可能是制约还原糖浓度提高的主要原因。

表1 酶水解顺序对酒糟水解的影响Table 1 Effect of enzymes adding order on hydrolysis of SDG
2.3 不同浓度酒糟对酒糟分步糖化发酵产丁二酸的影响
初始酒糟浓度与初始还原糖浓度直接相关,初始糖浓度对丁二酸的发酵有明显影响。图3显示,随着酒糟浓度的增加,水解得到的还原糖浓度升高,发酵产丁二酸的浓度也增加。酶处理后得到的酒糟水解液中固形物也增多,同时由酒糟所带入的乳酸也增加,使得发酵丁二酸产率的增加变缓。酒糟浓度为400 g/L时,还原糖浓度为58.3 g/L,丁二酸产量为28.8 g/L。
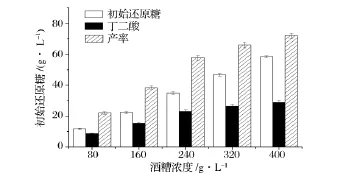
图3 不同酒糟浓度对分步糖化发酵生产丁二酸的影响Fig.3 Effect of SDG concentration on the production of succinic acid using separate hydrolysis and fermentation method
2.4 不同浓度酒糟对酒糟同步糖化发酵生产丁二酸的影响
由于酶水解酒糟时,水解产物对酶反应存在一定的反馈抑制作用,而且经过α-淀粉酶处理后,糖化酶在37℃,pH 6.5时仍能水解酒糟中淀粉,进行了同步糖化发酵实验,结果如图4所示。随着酒糟浓度的增加,初始还原糖浓度增加,但发酵的残糖也增加,发酵后丁二酸浓度先增后减,杂酸(乳酸、甲酸和乙酸)浓度增加,推测可能是发酵受到产物抑制。酒糟浓度为240 g/L时,经过纤维素酶作用之后得到还原糖35.5 g/L,然后加α-淀粉酶液化,再加糖化酶同步发酵后丁二酸浓度达到32.0 g/L。相同酒糟用量下,比分步糖化发酵的丁二酸的浓度提高了37.3%。对酒糟产率从72 mg/g酒糟增加到133 mg/g酒糟。
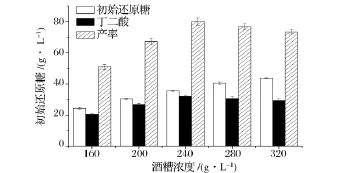
图4 不同酒糟浓度对同步糖化发酵生产丁二酸的影响Fig.4 Effect of SDG concentration on the production of succinic acid using separate hydrolysis and fermentation method
3 结论
白酒酒糟酶法处理过程中,用纤维素酶和糖化酶水解白酒酒糟,得到的还原糖得率要低于2种酶单独水解的还原糖得率之和,白酒糟经两种酶水解后总还原糖得率约为150 mg/g酒糟。采用先水解白酒酒糟,后发酵白酒酒糟水解液的分步糖化发酵工艺,其较佳的白酒酒糟用量为400 g/L,发酵液丁二酸浓度为28.8 g/L;采用先水解白酒糟中纤维素,后对其淀粉进行同步糖化发酵的工艺,较佳的白酒酒糟用量为240 g/L,发酵液中丁二酸浓度为32 g/L。比较两种工艺,同步糖化发酵工艺的丁二酸产率(133 mg/g)是分步糖化发酵(72 mg/g)的1.8倍,具有明显优势。
白酒酒糟用于生产丁二酸不需要外源添加氮源,不需要像秸秆、玉米芯等原料耗费大量酸碱进行预处理,具有一定的优势。白酒酒糟发酵生产丁二酸既为发酵丁二酸生产提供了新的原料来源,又为白酒酒糟综合利用提供了新的途径,具有一定的应用前景。
[1] Zeikus J G,Jain M K,Elannovan P.Biotechnology of succinic acid production and markets for derived industrial products[J].Appl Microbiol Biotechnol,1999,51(5):545-552.
[2] Song H,Lee S Y.Production of succinic acid by bacterial fermentation[J].Enzyme Microb Technol,2006,39(3):352-361.
[3] 郑璞,孙志浩.生物质原料发酵生产丁二酸研究进展[J].生物产业技术,2009(增刊):31-36.
[4] 王延才.中国酿酒工业协会白酒分会2011年工作报告[J].酿酒科技,2012,217(7):17-25.
[5] 施安辉.国内白酒工业固体酒糟环保生态化利用的现状及前景[J].中国酿造,2006,156(3):4-7.
[6] 鲁文普,杨玉能.酒糟的饲料化利用概况[J].贵州畜牧畜医,2009,33(4):9 -10.
[7] 潘保原,曹越.不同剂量酒糟对盐碱土壤的改良作用[J].环境科学与管理,2009,34(10):135-137.
[8] 张鑫,李志强,相里加雄,等.利用汾酒酒糟生产冬虫夏草的工艺条件研究[J].酿酒科技,2010,191(5):95-97.
[9] 姜福佳,王玉萍,周畅,等.酒糟中蛋白质的提取工艺[J].吉林大学学报,2010,48(1):152-156.
[10] 张云鹏,刘军,陈娟.白酒糟植酸提取条件的优化[J].中国酿造,2010,216(3):125-127.
[11] 蒋滢,黄美英.从酒糟中提取复合氨基酸及微量元素[J].食品工业科技,1991(6):14-15.
[12] 郭婷,徐帅,吕孝宇,等.秸秆-酒糟混合液厌氧发酵产沼气的初步研究[J].食品工业科技,2010,31(8):248-250.
[13] 高晓娟,王君高,王欣,等.酒糟在食醋酿造中的应用研究[J].中国调味品,2010,35(7):45-47.
[14] 丁琳,聂英龙,化兴仇,等.酒糟发酵制取甘油的研究[J].沈阳化工学院学报,2000,14(2):158-160.
[15] 董晋军,郑璞,孙志浩,等.利用甘蔗糖蜜半连续发酵生产琥珀酸[J].化工学报,2008,59(6):1 490-1 495.
[16] 董晋军,郑璞,倪晔,等.菊芋原料同步糖化发酵生产丁二酸[J].食品与生物技术学报,2008,27(5):78-82.
[17] 孔德城,郑璞,董晋军,等.碱处理秸秆同步糖化发酵生产丁二酸[J].食品与发酵工业,2011,37(10):1-5
[18] 刘璇,郑璞,倪晔,等.基因改组技术选育耐酸性琥珀酸放线杆菌[J].微生物学通报,2009,36(11):1 676-1 681.
[19] 张丽英.饲料分析及饲料质量检测技术[M].北京:北京农业大学出版社,2007.70.
[20] Miller G L.Use of dinitrosalicylic acid regent for determination of reducing sugar[J]. Analytical Chemistry,1959,31(3):426-428.
[21] 刘宇鹏,郑璞,孙志浩.采用离子排斥色谱法分析发酵液中的琥珀酸等代谢产物[J].工业微生物,2007,37(5):1-5.

