3种拟青霉发酵三七及其产物检测*
武阳阳,虞泓,葛锋,陈自宏,曾文波
1(昆明理工大学生命科学与技术学院,云南 昆明,650500)2(云南大学中草药生物资源研究所云百草实验室,云南昆明,650091)
三七[Panax notoginseng(Burk)F.H.Chen]为五加科人参属多年生草本植物,是我国传统的药用植物[1]。三 七 总 皂 苷 (panax notoginseng saponins,PNS)是三七的主要有效成分,在耐缺氧、抗衰老和提高机体免疫力等方面的药理作用显著,且总皂苷和部分单体皂苷在血液系统、心脑血管系统以及抗炎、抗肿瘤等方面均有较好活性[2]。研究表明,植物中天然的人参皂苷含量低,且分子结构不是最佳的活性状态,通过生物转化减少皂苷结构中的糖基数目,可将天然皂苷中含量较高的Rg1、Rb1、Rb2、Re转化为稀有皂苷(如Rd、Rh1、C-K等),可提高其疗效和生理活性[3-6]。稀有人参皂苷在治疗心脑血管疾病、抗肿瘤方面表现出较好的药理活性,如人参皂苷Rd可以促进T细胞的增殖,提高天然杀伤细胞的活性,对心脑血管、神经系统和免疫系统等作用独特,可提高机体的免疫力,有可能成为治疗脑卒中的新型临床治疗药物,是一种很有前景的候选药物[7-8]。但人参皂苷Rd在植物内的含量很低,且结构复杂,难以化学合成[9]。因此,获得大量高纯度的人参皂苷Rd具有重大的科研意义和应用价值。稀有皂苷可通过生物转化法获得,因其效率高、无污染,具有较好的应用前景。
目前,微生物发酵三七在国内外已经得到了极大的关注与发展。大型药食兼用菌与西洋参进行共培养,可将人参皂苷Rb1等转化为Rd和C-K,得到稀有皂苷[10]。李国红等采用枯草芽抱杆菌对三七根进行发酵,从发酵产物中分离得到新的人参皂苷RH4[11]。采用莫勒接霉(Zygorhynchus moelleri)和灰绿犁头霉(Absidia glauca)可将Rb1专一的转化为Rd[12]。拟青霉 (Paecilomyces bainier sp.229)可将Rb1大量转化为 Rd,进一步转化为 C-K[13]。
冬虫夏草是我国名贵的药食用真菌,其主要活性成分有虫草素、甘露醇、腺苷及微量元素等,具有免疫调节、抗肿瘤、抗炎症、降血糖和延缓衰老等多方面的作用[14-16],但天然的冬虫夏草目前已濒临灭绝。从冬虫夏草中分离出的蝙蝠蛾拟青霉、蛹虫草分离出的蛹草拟青霉和蝉花中分离出的蝉拟青霉,通过人工培养获得的菌丝体在功效成分、药理作用以及临床疗效方面与冬虫夏草相似,为药食两用真菌[17]。目前,在虫草菌种的培养条件优化及其菌丝体功效成分的检测和药理作用方面已有不少的研究,但有关与三七共培养的研究还鲜见报道。本研究采用蝙蝠蛾拟青霉、蛹草拟青霉和蝉拟青霉分别固体发酵三七,旨在探讨虫草真菌这一重要微生物是否能转化三七中的皂苷成分,以期利用药食兼用虫草真菌发酵三七获得稀有皂苷,并合成腺苷、虫草素和甘露醇等虫草的功效成分,实现一次发酵过程同时获得虫草和三七的药用成分。
1 材料与方法
1.1 材料
1.1.1 实验材料
菌株蝙蝠蛾拟青霉 PHEP-2、蛹草拟青霉PMILSM5和蝉拟青霉PCICYL1-3,均保存于云南大学生命科学学院云百草实验室。
1.1.2 试剂
三七皂苷R1、人参皂苷Re和人参皂苷Rb1,购于中国药品生物制品检定所;人参皂苷Rh1、人参皂苷Rg1、人参皂苷 Rd、人参皂苷 F1、人参皂苷 F2、人参皂苷Rg3和人参皂苷C-K,购于南方标准物质网;乙腈、甲醇均为色谱纯,其余试剂均为分析纯。
1.1.3 仪器
高效液相色谱仪(戴安ULTIMATE 3000 LPG-3400A四元梯度泵,WPS-3000SL自动进样器,PDA-3000二极管阵列检测器,TCC-3000柱温箱,美国戴安仪器公司);Waters Symmetry C18色谱柱(250 mm×4.6 μm,5 μm,100A,美国 Waters 公司);紫外可见分光光度计(T6系列,北京普析通用仪器有限责任公司);DHG-9203A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司)。
1.2 实验方法
1.2.1 培养基
(1)斜面培养基:洋芋粉20 g/L,蔗糖20 g/L,琼脂18 g/L,蛋白胨 10 g/L,自然 pH,121℃灭菌 30 min。
(2)种子培养基:葡萄糖20 g/L,蛋白胨10 g/L,酵母粉10 g/L,KH2PO41 g/L,MgSO40.5 g/L。自然pH,121℃灭菌30 min。
(3)发酵培养基:精确称取5 g过60目筛的三七粉于100 mL三角瓶,加入0.1 mL无机盐(10 g/L KH2PO4,5 g/L MgSO4),加入去离子水,使最终培养基中基质含水量为60%。自然 pH,121℃灭菌30 min。
1.2.2 培养方法
(1)将菌株蝙蝠蛾拟青霉、蛹草拟青霉和蝉拟青霉分别接入斜面培养基中,于26℃恒温培养培养5 d。
(2)将已培养好的斜面菌种接入种子培养基中,于恒温振荡培养箱中26℃、150 r/min条件下培养5 d,备用。
(3)将发酵好的种子液以5%接种量接入发酵培养基中,于恒温培养箱中26℃,至菌丝长满培养基即成固体发酵物。以灭菌后的原药材为空白对照。
1.2.3 发酵产物的检测
1.2.3.1 发酵产物皂苷的HPLC测定
至菌丝长满培养基将发酵产物烘干,粉碎。取0.1 g,3 mL 70%甲醇溶解,0.45 μm 微孔滤膜过滤,上柱检测。
色谱流动相:乙腈-水梯度洗脱(0~30 min,20∶80;30~60 min,20~45:80~55;60~78 min,45~75:55 ~25;78 ~80 min,75 ~100∶25 ~0;80 min,20∶80);进样量10 μL;流速1 mL/min;
检测波长:203 nm;柱温:30℃。
1.2.3.2 虫草素和腺苷的HPLC测定
精确称取蝙蝠蛾拟青霉、蛹草拟青霉蝉拟青霉的发酵产物0.1 g,于3 mL 20%甲醇溶解,超声90 min,0.45 μm微孔滤膜滤过,进行HPLC检测。
色谱流动相:甲醇∶水梯度洗脱=15∶85;进样量10 μL;流速1 mL/min;检测波长260 nm;柱温:30℃。
1.2.3.3 甘露醇的测定
按比色法[17]测发酵产物的甘露醇含量。
2 结果与分析
2.1 发酵产物的收率
3种拟青霉在发酵培养基中生长状况良好,发酵周期20 d。将其发酵产物烘干至恒重,粉碎,计算发酵产物的收率(产物收率 =产物质量 /5 g×100%),见表1。
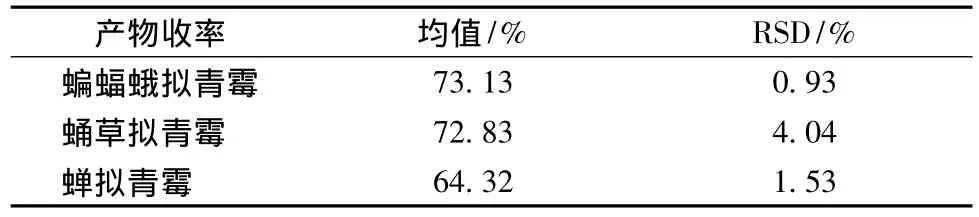
表1 发酵产物的收率(n=3)Table 1 The residue of fermentation productions
蝙蝠蛾拟青霉、蛹草拟青霉和蝉拟青霉均能很好的利用三七中提供的营养物质作为其生长所需,发酵周期为20 d,其发酵产物收率都在70%左右。
2.2 发酵产物皂苷的HPLC分析
经HPLC检测发酵产物有效成分,表明蝙蝠蛾拟青霉和蛹草拟青霉能够高产人参皂苷Rd,而蝉拟青霉则无明显变化,其固体发酵三七的皂苷HPLC色谱图见图1。
皂苷产量对发酵底物的得率计算为:皂苷得率=每克产物中皂苷含量 ×产物收率。菌株蝙蝠蛾拟青霉、蛹草拟青霉和蝉拟青霉固体发酵三七的皂苷HPLC检测结果如表2。经过蝙蝠蛾拟青霉和蛹草拟青霉的发酵,Rd由原药材的6.17 mg/g,分别增加至25.08 mg/g和25.07 mg/g,增加了3.06倍;同时,小极性皂苷Rh1、F1、F2、Rg3和C-K也有所增加;而三七中主要的皂苷成分R1、Re和Rg1则出现不同程度的下降,Rb1由原药材的24.04 mg/g分别降至1.25 mg/g和4.24 mg/g。而经过蝉拟青霉的发酵,三七中主要的皂苷成分R1、Re、Rg1和Rb1都有不同程度的下降,同时小极性皂苷 Rh1、F1、Rd、F2、Rg3 和 C-K则有小幅度的增加,但无显著变化。
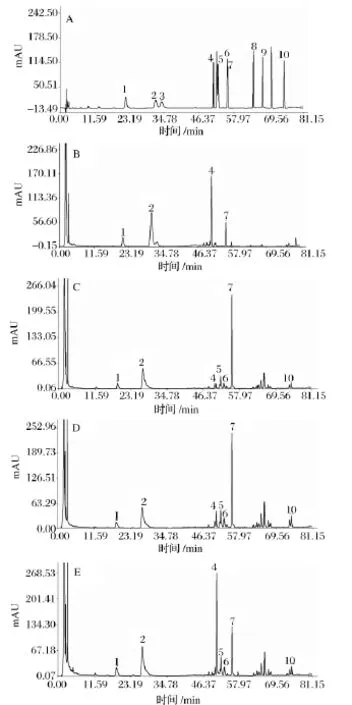
图1 标准品(A),原药材(B),蝙蝠蛾拟青霉转化三七皂苷(C),蛹草拟青霉转化三七皂苷(D),蝉拟青霉转化三七皂苷(E)的HPLC色谱图1-三七皂苷R1;2-人参皂苷Rg1;3-人参皂苷Re;4-人参皂苷Rb1;5-人参皂苷Rh1;6-人参皂苷F1;7-人参皂苷Rd;8-人参皂苷F2;9-人参皂苷Rg3;10-人参皂苷C-KFig.1 HPLC chromatograms of standard compounds(A),raw Panax notoginseng(B),ginsenoside of raw Panax notoginseng biotransformation with Paecilomyces hepiali Chen&Dai(C),ginsenoside of raw Panax notoginseng biotransformation with Paecilomyces militaris Liang(D),and ginsenoside of raw Panax notoginseng biotransformation with Paecilomyces cicadae Samson(E)
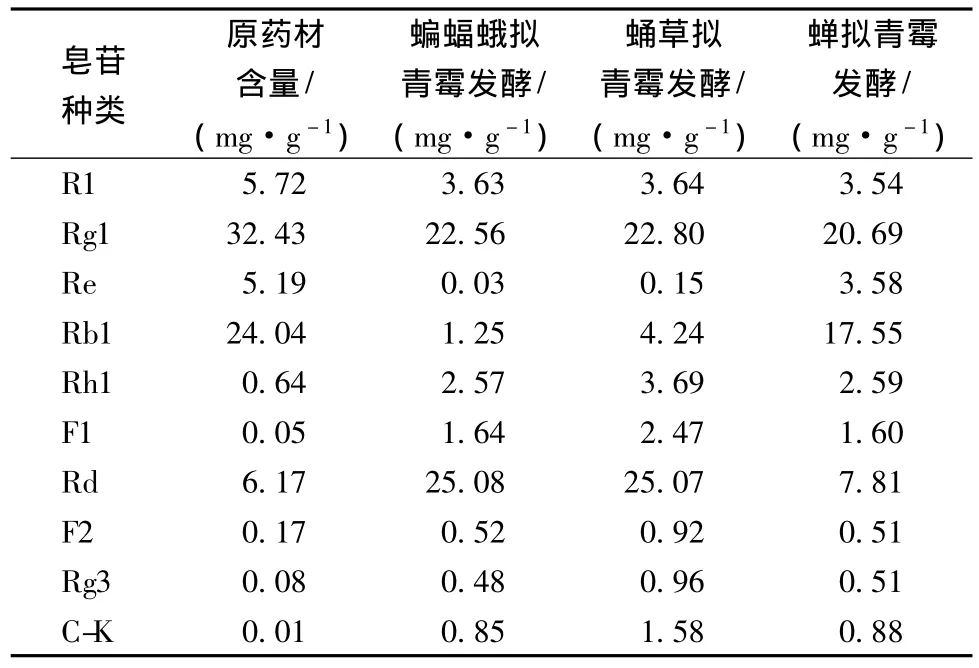
表2 3株拟青霉发酵三七的皂苷含量变化Table 2 The contents of Panax notoginseng saponins fermented by the three Paecilomyces fungi
由人参皂苷转化途径[19]可知,在发酵过程中蝙蝠蛾拟青霉和蛹草拟青霉或其生长过程中分泌的丰富酶系可能会水解人参皂苷Rb1的糖基从而转化为Rd。而蝉拟青霉可能没有相应的酶系,无法进行人参皂苷的转化。所选的蝙蝠蛾拟青霉和蛹草拟青霉能够有效地使三七中主要的大极性皂苷转化为小极性皂苷,且高产人参皂苷Rd。
2.3 发酵产物腺苷和虫草素的HPLC分析
蝙蝠蛾拟青霉、蛹草拟青霉和蝉拟青霉发酵产物的腺苷和虫草素HPLC色谱图见图2。
菌株蝙蝠蛾拟青霉、蛹草拟青霉和蝉拟青霉固体发酵三七的腺苷和虫草素HPLC检测结果如表3。经过蝙蝠蛾拟青霉的发酵,腺苷含量从原药材中的21.06 μg/g 增加到发酵产物中的 385.67 μg/g,不含虫草素;经蛹草拟青霉发酵,产物中腺苷达到167.43 μg/g,虫草素达到868.53 μg/g;而经蝉拟青霉的发酵,产物的腺苷达到222.07 μg/g,不含虫草素。
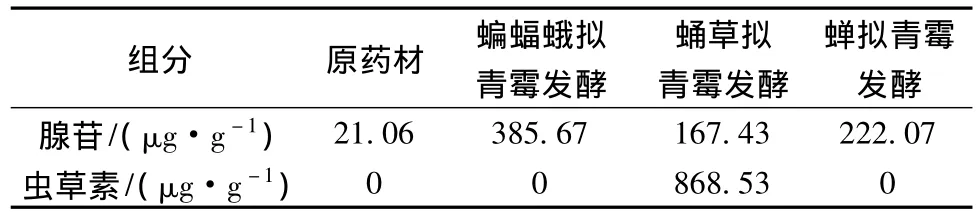
表3 3株拟青霉发酵三七的腺苷和虫草素含量变化Table 3 The contents of Panax notoginseng adenosine and cordycepin fermented by the three Paecilomyces fungi
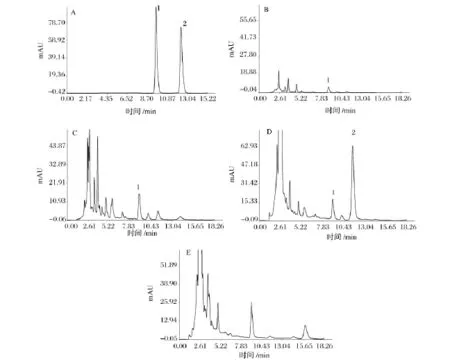
图2 标准品(A),原药材(B),蝙蝠蛾拟青霉发酵三七中腺苷和虫草素(C),蛹草拟青霉发酵三七中腺苷和虫草素(D),蝉拟青霉发酵三七中腺苷和虫草素(E)的HPLC色谱图Fig.2 HPLC chromatograms of standard compounds(A),raw Panax notoginseng(B),adenosine and cordycepin of raw Panax notoginseng fermentation with Paecilomyces hepiali Chen& Dai(C),adenosine and cordycepin of raw Panax notoginseng fermentation with Paecilomyces militaris Liang(D),and adenosine and cordycepin of raw Panax notoginseng fermentation with Paecilomyces cicadae Samson(E)
腺苷是虫草的主要活性成分,在改善心脑血液循环和防止心律失常等方面有明显的药理作用。蝙蝠蛾拟青霉、蛹草拟青霉和蝉拟青霉发酵产物的腺苷含量为 385.76 μg/g、167.43 μg/g 和 222.07 μg/g,介于夏文娟报道的不同产地冬虫夏草的腺苷含量(142.5 ~396.6 μg/g)之间[20],与野生冬虫夏草中腺苷含量相当。虫草素具有抗菌、抗病毒、抗肿瘤,以及抗疲劳、抗衰老,提高人体免疫力等多种功效显著的生物学活性,但在天然的虫草中一般含量都不高。蛹草拟青霉发酵产物的虫草素含量为868.53 μg/g,明显高于索菲娅等报道的4个不同产地的冬虫夏草(4.2 ~38.9 μg/g)[21]。由此可知,蝙蝠蛾拟青霉、蛹草拟青霉和蝉拟青霉能够利用三七中的营养物质发酵,从而有效地提高了腺苷和虫草素这两种虫草功效成分。
2.4 发酵产物甘露醇的含量测定
菌株蝙蝠蛾拟青霉、蛹草拟青霉和蝉拟青霉固体发酵三七的甘露醇检测结果如表4。
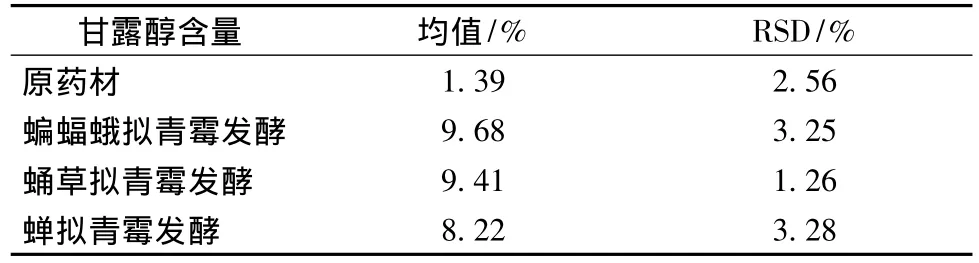
表4 3株拟青霉发酵三七的甘露醇含量变化(n=3)Table 4 The contents of Panax notoginseng mannito fermented by the three Paecilomyces fungi
经拟青霉的发酵,甘露醇含量从原药材的1.39%增加到了其产物中的9.68%、9.41%和8.22%,介于索菲娅等报道的4个不同产地冬虫夏草的甘露醇含量(7.85% ~12.03%)之间[22],同时也高于新药转正标准WS3-181(Z-60)-94(Z)发酵虫草菌粉的甘露醇要求。说明所选的蝙蝠蛾拟青霉、蛹草拟青霉和蝉拟青霉都能发酵三七从而产生甘露醇,且与野生的冬虫夏草中的甘露醇含量相当。
3 讨论
微生物发酵中药,是现代生物技术和中药研究的完美结合。微生物与中药共同发酵,可使微生物中丰富的酶系与中药中复杂的化学成分反应,产生中药不具有的成分或改变某些成分含量,或可使培养物兼有微生物和中药的功效成分[11],协同作用增强药效,使人体可以吸收较完全,提高了治疗和保健功效,从而可能为新药开发提供一种新的途径,是颇具发展潜力的研究领域。
本研究采用蝙蝠蛾拟青霉、蛹草拟青霉和蝉拟青霉在三七培养基上进行固体发酵,这3种拟青霉都能很好地利用三七中的营养物质进行生长,发酵周期为20 d,其发酵产物收率都在70%左右。通过对发酵产物的皂苷进行HPLC检测,蝙蝠蛾拟青霉和蛹草拟青霉的发酵产物中,Rb1由原药材的24.04 mg/g分别降至1.25 mg/g和4.24 mg/g,Rd由原药材的6.17 mg/g分别增加至25.08 mg/g和25.07 mg/g,增加了3倍。而Rb1和Rd具有相同的糖苷配基,其结构差异仅在C20位上的糖基。Rb1可在葡萄糖苷酶的作用下,断裂C20位上的末端糖苷键,脱去1分子葡萄糖,形成人参皂苷Rd[23],如图3。由于Rd在西洋参中含0.1% ~0.2%,人参中含0.2% ~0.3%,三七中含0.5% ~0.7%[24],在植物原药材中含量较低,但 Rd可能成为治疗脑中风的新型药物,具有独特的药理作用,因此筛选出可以高产人参皂苷Rd的菌种,优化合适的工业生产条件,对于大规模工业生产稀有人参皂苷以及临床的应用具有重要意义。目前,已经从蝙蝠蛾拟青霉和蛹草拟青霉中克隆出β-葡萄糖苷酶基因,正在进行该酶的酵母真核表达系统的构建。
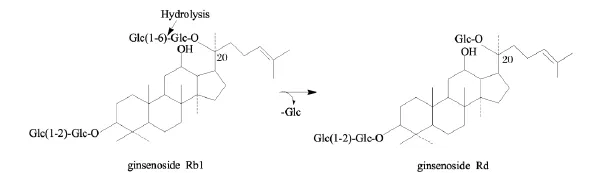
图3 人参皂苷Rb1到Rd的转化途径Fig.3 The transformation pathway of ginsenoside Rb1 into ginsenoside Rd
与此同时,三七中的糖类、氨基酸、脂质、蛋白质和微量元素等也为蝙蝠蛾拟青霉、蛹草拟青霉和蝉拟青霉的菌丝体生长提供了C源、N源和生长因子等营养物质,合成了腺苷、虫草素和甘露醇这3种虫草的功效成分。其发酵产物的腺苷含量和甘露醇含量与天然冬虫夏草中相当,而蛹草拟青霉发酵产物中的虫草素含量为868.53 μg/g,要远高于天然冬虫夏草中的虫草素含量(4.2 ~38.9 μg/g)。
本研究使用3种拟青霉对三七原药材进行固体发酵,其中蝙蝠蛾拟青霉和蛹草拟青霉在转化三七中皂苷的同时合成腺苷、虫草素和甘露醇这三种虫草功效成分,一次发酵过程同时获得虫草和三七有效成分。采用药用真菌以三七原药材为底物进行发酵,三七与真菌构成完整的发酵体系,三七为虫草菌丝体的生长提供营养物质,使其合成虫草的相关功效成分,而虫草真菌所产生的糖苷酶又可对皂苷进行结构修饰,水解其侧链上的糖基,把原药材中含量高的皂苷转化为含量低、活性高的稀有皂苷,改善了药材中活性化合物的生物利用度,发酵产物兼具三七和药用真菌的双重功效,为新药开发提供新的思路。
[1] 冯陆冰,潘西芬,孙泽玲.三七的药理作用研究进展[J].中国药师,2008,11(10):584-589.
[2] 张玉军.三七中皂苷的药理研究进展[J].广西医学,2009,4(31):589-591.
[3] 赵方允,陈自宏,虞泓,等.微生物转化人参皂苷的研究[J].中国医药生物技术,2010,5(3):216-219.
[4] Sung-Ryong K O,Kang-Ju Chol,Kei Suzukl,et al.Enzymatic preparation of Ginsenosides Rg2,Rh1,and F1[J].Chemical and Pharmaceutical Bulletin,2003,51(4):404-408.
[5] W Zhou,Q Yan,J Y Li,et al.Biotransformation of Panax notoginseng saponins into ginsenoside compound K production by Paecilomyces bainier sp.229[J].Journal of Applied Microbiology,2008,104(3):699-706.
[6] 周超群,周珮.人参皂苷Rd的研究进展[J].中草药,2009,5(40):832-836.
[7] Berek L,Szabo D,Pitri I B,et al.Effects of naturally occurring glucosides,solasodine glucosides,ginsenosides and parishin derivatives on multidrug resistance of lymphoma cells and leuloeyte functions[J].In Vivo,2001,15(2):151-156.
[8] 李泰平.人参皂苷药理活性的研究进展[J].生物学教学,2003,28(4):34 -37.
[9] 周超群,史训龙,李继扬,等.人参皂苷Rd高产突变株Paecilomyces bainier sp229-7的生长特性和生物转化[J].复旦学报:医学版,2010,37(1):59-62.
[10] 付建国.人参皂苷微生物转化的研究[D].长春:吉林农业大学,2004.
[11] 李国红,沈月毛,王启方,等.发酵三七中的皂苷成分研究[J].中草药,2005,36(4):499-500.
[12] 张薇,孙晓东,张萍,等.专一转化人参二醇类皂苷Rb1为Rd的真菌菌株的筛选[J].菌物学报,2011,30(2):305-311.
[13] Yan Q,Zhou W,Shi X L,et al.Biotransformation pathways of ginsenoside Rb1 to compound K by β-glucosidases in fungus Paecilomyces Bainier sp.229[J].Process Biochemistry,2010,45(9):1 550-1 556.
[14] 傅岚,陈作红.虫草属真菌化学成分及药理作用研究进展.[J].生命科学研究,2004,8(1):1-7.
[15] 李绍平,季晖,李萍,等.冬虫夏草抗肿瘤作用研究进展[J].中草药,2001,32(4):373-375.
[16] Da-Qing Jin,Byung-Chul Park,Jae-Seong Lee,et a1.Mycelial extract of Cordyceps ophioglossoides Prevents neuronal cell death and amelioretes β-Amyloid peptide-induced memory deficits in rats[J].Biological and Pharmaceutical Bulletin,2004,27(7):126-129.
[17] 计红冰,邹峥嵘.虫草研究进展[J].农产食品科技,2008,2(2):45-52.
[18] 蔡友华,范文霞,刘学铭,等.比色法测定巴西虫草菌丝体中虫草酸的含量[J].现代食品科技,2008,24(1):76-79.
[19] 崔玉娜,张怡轩,赵余庆.利用生物转化法制备稀有人参皂苷的研究进展[J].中草药,2009,40(5):676-680.
[20] 夏文娟,曾晓英,袁海龙,等.不同产地冬虫夏草腺苷含量的测定[J].中国中药杂志,2001,26(8):540-542.
[21] 索菲娅,苏俊,姜彦成,等.新疆虫草与冬虫夏草中腺苷和虫草素的HPLC法测定比较[J].中国民族医药杂志,2008,3(3):65-67.
[22] 索菲娅,苏俊,姜彦成,等.新疆虫草与冬虫夏草中甘露醇、多糖和氨基酸的含量比较研究[J].新疆农业科学,2008,45(3):517-52.
[23] 弓晓杰.人参皂苷酶代谢产物化学修饰及其抗癌活性研究[D].长春:吉林农业大学,2004.
[24] Shi S,Lian-Wen Q,Guang-Jian D,et al.Red notoginseng:Higher ginsenoside content and stronger anticancer potential than Asian and American ginseng[J].Food Chemistry,2011,125(4):1 299-1 305.

