戊糖乳杆菌素pentocin LPEM818的初步纯化及特性研究*
于雷雷,王超,施波,马妙莲,段慧,张明
(安徽农业大学生命科学学院,安徽合肥,230036)
细菌素(bacteriocin)是一些细菌产生的抗菌多肽或蛋白[1],因其能被人类胃肠道分泌的蛋白酶降解,对人体无毒副作用,所以具有作为食品生物防腐剂的潜在应用价值,乳酸乳球菌素nisin在乳制品及罐头制品中已得到了广泛的应用[2]。戊糖乳杆菌 (Lactobacillus pentosus)[3]是公认的食品安全菌,因而对戊糖乳杆菌细菌素戊糖乳杆菌素进行了大量研究,有关戊糖乳杆菌素的报道最早见于1999年有关pentocin TV35b的分离纯化[4],我国在2004年首次报道了pentocin 31-1的分离纯化[5-9]。已报道的产细菌素戊糖乳杆菌有 L.pentosus TV35b[4]、L.pentosus 31 -1[5-9]、L.pentosus ST151BR[10]、L.pentosus B96[11]、L.pentosus ST712BZ[12]、L.pentosus S-PT84[13]、L.pentosus b240[14]、L.pentosus IG1[15]、L.pentosus[16]、L.pentosus C50-6[3]、L. pentosus 191 和 L. pentosus 204[17]等。
戊糖乳杆菌素多属于II类细菌素,分子量较小、热稳定性高、主要抑制革兰氏阳性菌[4],但pentocin C50-6还能抑制革兰氏阴性菌[3],在N-末端具有 IIa类细菌素的保守序列YGNGV,对单核细胞增生李斯特氏菌(Listeria monocytogenes)ATCC19115有较强的抑制作用[5]。L.pentosus B96和L.pentosus IG1所产的IIb类细菌素均由2个高度疏水、对热稳定的小分子肽组成,2个组分在抑菌功能上具有协同作用[11,15]。Pentocin C50-6 由于没有进行序列测定,仅根据分子量和抑菌谱的分析推测其可能属于抑菌谱较广的I类或II类细菌素[3],暂未发现属于IIc类、IId类、III类和IV类的戊糖乳杆菌素。细菌素的抑菌方式一般分为抑菌、杀菌不溶菌和杀菌且溶菌3种类型,研究表明现已报道的pentocin TV35b和pentocin 31-1对指示菌的的作用方式均为杀菌不溶菌[4-5]。戊糖乳杆菌素由于可耐受高温处理,且大部分在酸性或弱碱性条件下稳定[2-9],因而在食品领域具有广泛的应用前景。本文主要探讨了戊糖乳杆菌LPEM818细菌素的生物学特性以及对指示菌的作用方式等,以待为该细菌素的应用和进一步研究提供理论依据。
1 材料和方法
1.1 实验材料
1.1.1 菌株
产细菌素菌株:戊糖乳杆菌(Lactobacillus pentosus)LPEM818为安徽农业大学生命科学学院实验室筛选保藏;指示菌株见表2。
1.1.2 培养基
MRS培养基和 LB培养基[18]。
1.1.3 主要药品试剂
胃蛋白酶(BBI),木瓜蛋白酶(Sangon),脂肪酶(Sigma),过氧化氢酶(Sigma),凝乳蛋白酶(BBI),胰蛋白酶(BBI),蛋白酶K(Sigma),Sephadex G-25(GE Healthcare),BSA(BBI),Folin-酚试剂(Sangon),尿素(BBI),EDTA(BBI),SDS(BBI)等。
1.2 实验方法
1.2.1 Pentocin LPEM818的活性及效价的测定
采用牛津杯双层平板法[19]和双层平板二倍稀释法[20]。
1.2.2 蛋白质浓度的测定
Lowry 法[21]。
1.2.3 Pentocin LPEM818 的初步纯化[22]
接种6环菌株LPEM818于MRS培养基中,37℃培养14 h作为种子液。按4%的体积比将种子液接种于4 L MRS培养基中,37℃培养24 h。将发酵液离心,过滤(0.45 μm),上清液进行80% 硫酸铵沉淀,4℃过夜,离心取沉淀,重悬于 ddH2O中,用透析袋(500 u)透析脱盐,经氯化钡检测不含硫酸铵,收集透析液,测定其效价并冷冻干燥,得到 pentocin LPEM818干粉。将pentocin LPEM818干粉重悬于ddH2O,得到效价为1 060AU/mL的样品,取5 mL上Sephadex G-25(1.6 cm×100 cm)凝胶层析,流速为0.6 mL/min,流动相为ddH2O。收集各峰进行活性检测,确定其活性峰。
1.2.4 Pentocin LPEM818的生物学特性研究
1.2.4.1 pH值和热稳定性实验
样品用1 mol/L HCl和1 mol/L NaOH分别调pH值至 2.0、4.0、6.0、8.0、10.0 和 12.0,补加 ddH2O 使样品终体积相等,以ddH2O同比稀释的样品作为对照,每组设3个平行,37℃水浴6 h后,调 pH值至5.0,检测其抑菌活性。
样品分别进行 4、37、60、80、100 和 121℃水浴 15 min或30 min,以未经处理的样品为对照,每组设3个平行,冰浴10 min后检测其抑菌活性。
1.2.4.2 酶和有机溶剂敏感性实验
样品用1 mol/L HCl和1 mol/L NaOH分别调至各酶最适pH值,使各酶的最终浓度为5 mg/mL,以ddH2O同比稀释的酶和同比稀释的样品分别作为对照,每组设3个平行,37℃水浴8h,沸水浴10 min,检测抑菌活性。
样品分别加入1%体积比的 SDS、尿素、NaCl、EDTA、Triton X-100、吐温-80和乙腈,以 ddH2O 同比稀释的有机溶剂和同比稀释的样品分别作为对照,每组设3个平行,37℃水浴4h,检测抑菌活性。
1.2.4.3 抑菌谱的测定
采用牛津杯双层平板法,分别对供试G+菌株和G-菌株做抑菌实验。
1.2.4.4 作用方式的测定
将菌株533接种于LB培养基中,37℃培养14 h(OD600=2.89)作为种子液,按4%的体积比接种于LB培养基,分成两组,一组在8h后加入 pentocin LPEM818样品,另一组加等体积的无菌生理盐水作为对照,37℃培养26 h,每2 h取出5 mL,测定OD600,计算菌落数(CFU/mL),每次测3个平行。
1.2.4.5 生理曲线的测定
将菌株LPEM818的种子液按4%的体积比接种于MRS培养基中,37℃培养。每隔2 h取样,测定OD600,pH值和上清液抑菌活性,各设3个平行。
2 结果与分析
2.1 Pentocin LPEM818的初步纯化
为了对pentocin LPEM818进行初步纯化,本实验以80%硫酸铵沉淀样品为材料,进行了Sephadex G-25(1.6 cm×100 cm)凝胶层析分析(图1)。上样量为5 mL,流速为0.6 mL/min,流动相为 ddH2O,收集各峰并测定活性。
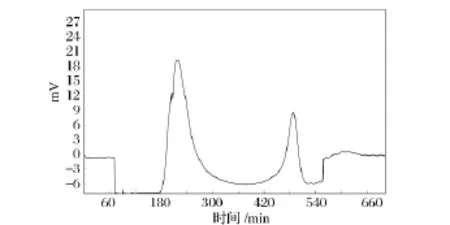
图1 Sephadex G-25层析图谱Fig.1 The chromatogram of G-25
经G-25凝胶层析后,样品有2个峰(图1),抑菌实验证实第2个峰为活性峰,而第1个峰无抑菌活性,为杂蛋白峰,达到了一定的分离效果。说明硫酸铵沉淀分离法用于初步分离该细菌素是可行的。经过硫酸铵沉淀和G-25层析分离纯化后,该细菌素的纯化倍数为11.09倍,回收率为6.4%(表1)。经Tricine-SDS-PAGE电泳后,出现多条蛋白质条带(结果未显示),分子质量在6.5~27 ku,说明该细菌素为小分子肽。可能由于样品上样量太少,导致未检测到有抑菌活性的条带;要获取单一条带,有待进一步优化分离纯化条件。
2.2 Pentocin LPEM818的pH值和热稳定性实验
对80%硫酸铵沉淀样品分别在不同的pH值条件下,37℃水浴6 h后,调pH值至5.0,检测抑菌活性,以获得该细菌素的pH稳定性范围。相同样品经不同的温度处理15 min或30 min,冰浴10 min,检测抑菌活性,以获得该细菌素的热稳定性范围。
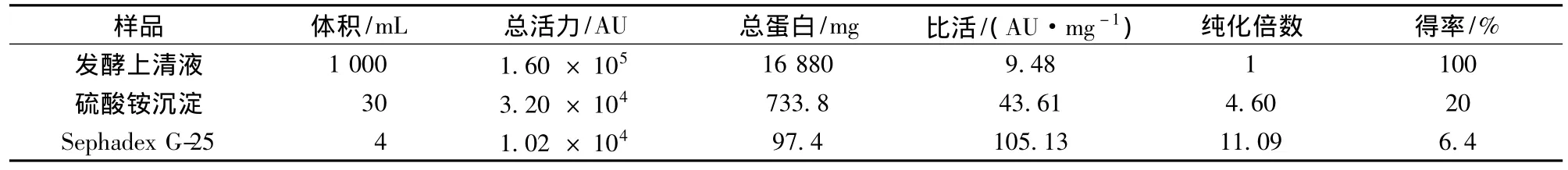
表1 Pentocin LPEM818的纯化表Table 1 Purification table for pentocin LPEM818
pH稳定性实验结果(图2)表明,样品在pH 4.0~6.0条件下抑菌活性最高,其保留值约为90%,在pH 2.0和8.0条件下抑菌活性仍保留在80%,当pH在10.0或12.0时抑菌活性完全丧失。因此,该细菌素具有较好的酸和弱碱稳定性。热稳定性实验结果(图3)表明,样品经4~80℃处理后,抑菌活性保留在90%以上。经100℃处理30 min和121℃处理15 min后,抑菌活性保留在80%以上,而经121℃处理30 min后,其抑菌活性仍保留在66.98%。因此该细菌素是一种热稳定型的细菌素。
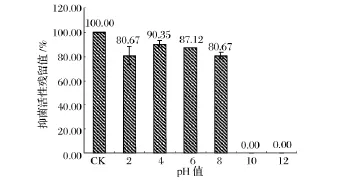
图2 不同pH对样品抑菌活性的影响Fig.2 The antibacterial activity of sampleat the different pH
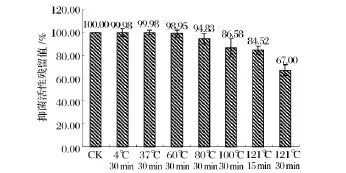
图3 不同温度对样品抑菌活性的影响Fig.3 The antibacterial activity of sample at the different temperature
2.3 Pentocin LPEM818对酶和有机溶剂的敏感性实验
对80%硫酸铵沉淀样品分别经不同的酶在37℃条件下处理8 h,沸水浴10 min,检测抑菌活性,以确定该细菌素的酶敏感性。相同样品经不同的有机溶剂在37℃条件下处理4 h,检测其抑菌活性,以确定该细菌素的有机溶剂敏感性。
对酶敏感性实验结果(图4)表明,样品经蛋白酶K和胰蛋白酶处理后抑菌活性完全丧失,所以对其敏感;样品经凝乳蛋白酶处理后抑菌活性下降15%,所以对其较敏感;样品经脂蛋白酶、胃蛋白酶、木瓜蛋白酶处理后抑菌活性基本不变,所以对其不敏感,因此该细菌素为蛋白类抑菌物质。对有机溶剂敏感性实验结果(图5)表明,样品经尿素处理后抑菌活性下降14%,所以对其较敏感;样品经 Triton X-100、NaCl、吐温-80和乙腈处理后抑菌活性不变,所以对其不敏感;该细菌素与SDS或EDTA共同作用时,抑菌效果明显好于单一作用,因此二者具有协同抑菌作用。
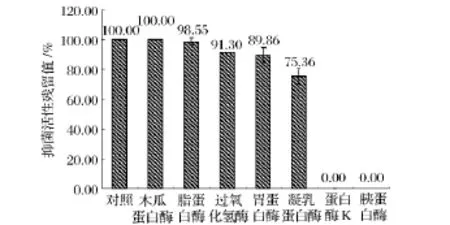
图4 不同酶对样品抑菌活性的影响Fig.4 The antibacterial activity of sample at the different enzymes
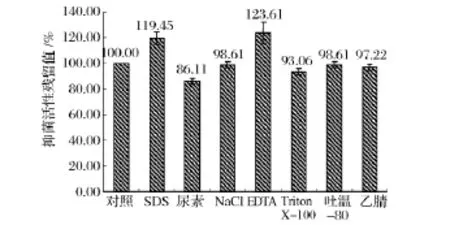
图5 不同有机溶剂对样品抑菌活性的影响Fig.5 The antibacterial activity of sample at the different organic solvent
2.4 Pentocin LPEM818抑菌谱的测定
用80%硫酸铵沉淀样品分别对供试的G+菌株和G-菌株做抑菌实验(表2),测定抑菌圈直径,以确定该细菌素抑菌谱。

表2 Pentocin LPEM818的抑菌谱Table 2 Antibacterial spectrum of pentocin LPEM818
硫酸铵沉淀样品的抑菌谱测定结果(表2)表明,pentocin LPEM818对供试的G-菌株变形杆菌、鸡白痢沙门氏菌、绿脓杆菌和G+菌株单核细胞增生李斯特氏菌、金黄色葡萄球菌、藤黄微球菌、四联球菌的抑制作用明显;对粪肠球菌、发酵乳杆菌、保加利亚乳杆菌、短乳杆菌等近源乳酸菌也有较好的抑制作用。
2.5 作用方式的测定
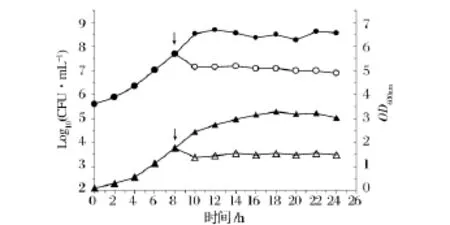
图6 Pentocin LPEM818对S.pullorum533的作用方式Fig.6 The effect of pentocin LPEM818 on the growth of S.pullorum 533
将接种过菌株533的LB培养基置于37℃培养,每隔2 h取样,测定其OD600值,监测菌体浓度的变化,同时测定CFU监测活菌数量,获得菌体的生长情况(图6),以确定该细菌素对指示菌的作用方式。
对菌株533作用方式的研究(图6)表明,菌体在12 h后进入生长稳定期。实验组菌株533的活菌数在10 h,从1×108降至1×107,随后趋势略有下降。说明细菌素在短时间内杀死了大量指示菌,该细菌素对指示菌的作用方式为杀菌。而对照组活菌数则呈持续上升趋势,10h后保持稳定;实验组菌株533的OD600在10 h后基本保持恒定,说明该细菌素对指示菌无溶菌现象;而对照组OD600一直呈上升趋势,直至16 h后稳定。因此,该细菌素对指示菌的作用方式仅为杀菌。
2.6 生理曲线的测定
将接种过菌株 LPEM818的 MRS培养基置于37℃培养,每隔2 h取样,测定OD600值,pH值和上清液抑菌活性,以测定该菌株的生理曲线。
菌株LPEM818生理曲线的测定结果(图7)表明,菌株LPEM818置于37℃培养,6 h进入对数中期,16 h进入稳定期,此时OD600值最大,22 h进入衰亡期。发酵上清液的pH值从6.24降至4.50,18 h后保持恒定。在对数期中期开始产生细菌素,且在稳定期后期产量达到最大值,此时抑菌活性达到最高,随后保持稳定,整个过程受pH的影响较小。
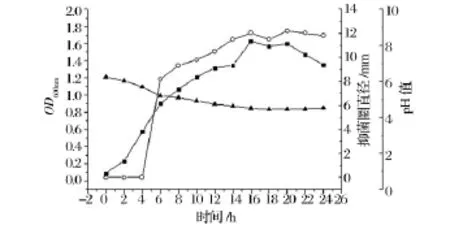
图7 L.pentosus LPEM818的生理曲线Fig.7 Production of pentocin LPEM818 during growth of L.pentosus LPEM818
3 讨论与结论
3.1 Pentocin LPEM818的初步纯化
细菌素的分离纯化与其特性研究密切相关。细菌素的初步分离方法有盐析法、有机溶剂沉淀法和pH吸附法等,进一步纯化方法有凝胶过滤层析、离子交换层析、疏水相互作用层析和反相高效液相色谱等。本研究采用硫酸铵沉淀和Sephadex G-25凝胶层析对pentocin LPEM818进行了初步纯化,最终纯化倍数为11.09倍,但回收率仅为6.4%,说明纯化过程中目的蛋白损失较大。今后应继续对pentocin LPEM818的分离纯化条件进行优化,为将来的精细纯化及应用奠定基础,但是根据其目的蛋白峰,确定了硫酸铵沉淀法样品用于生物学特性研究的可行性。
3.2 Pentocin LPEM818的作用方式
细菌素通常对敏感菌株的作用方式表现为3种类型:抑菌、杀菌不溶菌和杀菌且溶菌。本研究在S.pullorum 533的菌悬液中加入80%硫酸铵沉淀样品后,在短时间内对S.pullorum 533的活菌数产生了有效的抑制作用,并且在加入该细菌素后OD600无明显变化,因此该细菌素对S.pullorum 533的作用方式仅为杀菌。具有与本实验结果相同作用方式的细菌素有 bacTN635[23]和 plantaricin MG[24],其中 bacTN635的指示菌活菌数下降了6个单位,而OD600无明显变化;plantaricin MG的指示菌活菌数下降了96.3%,而OD600也无明显变化。而 plantaricin TF711[25]的指示菌活菌数在3h内下降了1.3个单位,随后有所上升,9h后保持稳定,其作用方式为抑菌。所以pentocin LPEM818比bacTN635或plantaricin MG的抑菌效果稍差,但优于plantaricin TF711。
3.3 Pentocin LPEM818的生物学特性
细菌素的生物学特性决定其潜在的应用价值。Pentocin LPEM818在pH 2.0~8.0条件下稳定,具有酸和弱碱稳定性的特点,与enterocin LR/6在pH 2.0-8.0条件下抑菌活性保留80%[26]基本相同,但其热稳定性不及pentocin LPEM818。Pentocin LPEM818在121℃处理30 min仍保留67%的抑菌活性,具有较好的热稳定性。具有相似特性的pentocin 31-1在100℃处理 15 min只保留 50%的抑菌活性[7]。pentocin LPEM818热稳定性明显优于pentocin 31-1。pentocin LPEM818对酶的敏感性的特点与Pediococcus pentosaceus CFR SIII所产的细菌素相似,仅对胰蛋白酶和蛋白酶K敏感[27],但其pH稳定性范围为3.0~5.0明显差于本细菌素。对吐温-80、NaCl、乙腈和 Triton X-100不敏感,对尿素敏感的特点与sakacin LSJ618[28]相一致,进一步表明了该细菌素具有蛋白属性。EDTA或 SDS本身对S.pullorum 533具有抑制作用,pentocin LPEM818与SDS或EDTA共同作用时,抑菌效果明显好于单一作用,因此二者有协同抑菌作用[28-30]。在实验条件下,菌株 LPEM818在对数中期开始产生细菌素,在稳定期后期产量达到最大值,随后保持稳定,产细菌素过程受环境pH的影响较小。该细菌素对供试的大部分G+菌株和G-菌株均具有较强抑制作用,其抑菌谱广,对多数致病菌和食品腐败菌抑菌作用明显,特别是对Listeria monocytogenes ATCC19115和G-菌株较强的抑制作用,所以其具有作为食品生物防腐剂的潜在应用价值。
[1] 郭兴华.益生乳酸细菌:分子生物学及生物技术[M].北京:科学出版社,2008.
[2] 吕燕妮,李平兰,孙成虎,等.戊糖乳杆菌31-1菌株所产细菌素的理化及生物学特性[J].中国农业大学学报,2006,11(1):39-43.
[3] 刘书亮,敖灵,周佳,等.戊糖乳杆菌素 C50-6的纯化及特性研究[J].食品与发酵工业,2010,36(5):36-40.
[4] Okkers D J,Dicks L M,Silvester M,et al.Characterization of pentocin TV35b,a bacteriocin-like peptide isolated from Lactobacillus pentosus with a fungistatic effect on Candida albicans[J].Journal of Applied Microbiology,1999,87(5):726-734.
[5] Zhang J,Liu G,Shang N,et al.Purification and partial amino acid sequence of pentocin 31-1,an anti-listeria bacteriocin produced by Lactobacillus pentosus 31-1[J].Journal of Food Protection,2009,72(12):2 524-2 529.
[6] Liu G R,Griffiths M W,Shang N,et al.Applicability of bacteriocinogenic Lactobacillus pentosus 31-1 as a novel functional starter culture or coculture for fermented sausage manufacture[J].Journal of Food Protection,2010,73(2):292-298.
[7] Liu G R,Lv Y,Li P L,et al.Pentocin 31-1,an anti-Listeria bacteriocin produced by Lactobacillus pentosus 31-1 isolated from Xuan-Wei Ham,a traditional China fermented meat product[J].Food Control,2008,19(4):353 -359.
[8] Zhang J L,Liu G R,Li P L,et al.Pentocin 31-1,a novel meat-borne bacteriocin and its application as biopreservative in chill-stored tray-packaged pork meat[J].Food Control,2010,21(2):198 -202.
[9] Zhou K,Zhou W,Li P,et al.Mode of action of pentocin 31-1:An antilisteria bacteriocin produced by Lactobacillus pentosus from Chinese traditional ham[J].Food Control,2008,19(8):817-822.
[10] Todorov S D,Dicks L M T.Effect of medium components on bacteriocin production by Lactobacillus pentosus ST151BR,a strain isolated from beer produced by the fermentation of maize,barley and soy flour[J].World Journal of Microbiology& Biotechnology,2004,20(6):643-650.
[11] Delgado A,Brito D,Peres C,et al.Bacteriocin production by Lactobacillus pentosus B96 can be expressed as a function of temperature and NaCl concentration[J].Food Microbiol,2005,22(6):521 -528.
[12] Todorov S D,Dicks L M T.Bacteriocin production by Lactobacillus pentosus ST712BZ isolated from boza[J].Brazilian Journal of Microbiology,2007,38(1):166 -172.
[13] Izumo T,Izumi F,Nakagawa I,et al.Influence of Lactobacillus pentosus S-PT84 ingestion on the mucosal immunity of healthy and salmonella typhimurium-infected mice[J].Bioscience and Microflora,2011,30(2):27-35.
[14] Kotani Y,Shinkai S,Okamatsu H,et al.Oral intake of Lactobacillus pentosus strain b240 accelerates salivary immunoglobulin A secretion in the elderly:A randomized,placebo-controlled,double-blind trial[J].Immunity and Ageing,2010(7):11.
[15] Maldonado-Barragan A,Caballero-Guerrero B,Lucena-Padros H,et al.Genome sequence of Lactobacillus pentosus IG1,a strain isolated from Spanish-style green olive fermentations[J].Journal of Bacteriology,2011,193(19):5 605.
[16] Nieto-Lozano J,Reguera-Useros J,Pelaez-Martinez M,et al.Bacteriocinogenic activity from starter cultures used in Spanish meat industry[J].Meat Science,2002,62(2):237-243.
[17] Con A H,Gokalp H Y.Production of bacteriocin-like metabolites by lactic acid cultures isolated from sucuk samples[J].Meat Science,2000,55(1):89 -96.
[18] 张刚.乳酸细菌:基础,技术和应用[M].北京:化学工业出版社,2007.
[19] 张艾青,刘书亮,敖灵.产广谱细菌素乳酸菌的筛选和鉴定[J].微生物学通报,2007,34(4):753-756.
[20] 方佳琪,竺德强,柯芳芳,等.pH吸附法纯化乳酸乳球菌素 Lacticin LLC518[J].食品与发酵工业,2011,37(10):52-56.
[21] 汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2000:42-91.
[22] Todorov S D,Rachman C,Fourrier A,et al.Characterization of a bacteriocin produced by Lactobacillus sakei R1333 isolated from smoked salmon[J].Anaerobe,2011,17(1):23-31.
[23] Smaoui S,Elleuch L,Bejar W,et al.Inhibition of fungi and gram-negative bacteria by bacteriocin BacTN635 produced by Lactobacillus plantarum sp.TN635[J].Applied Biochemistry and Biotechnology,2010,162(4):1 132-1 146.
[24] Gong H S,Meng X C,Wang H.Plantaricin MG active against Gram-negative bacteria produced by Lactobacillus plantarum KLDS1.0391 isolated from“Jiaoke”,a traditional fermented cream from China[J].Food Control,2010,21(1):89-96.
[25] Hernandez D,Cardell E,Zarate V.Antimicrobial activity of lactic acid bacteria isolated from Tenerife cheese:ini-tial characterization of plantaricin TF711,a bacteriocinlike substance produced by Lactobacillus plantarum TF711[J].Journal of Applied Microbiology,2005,99(1):77-84.
[26] Kumar M,Tiwari S K,Srivastava S.Purification and characterization of enterocin LR/6,a bacteriocin from Enterococcus faecium LR/6[J].Applied Biochemistry and Biotechnology,2010,160(1):40-49.
[27] Halami P M,Badarinath V,Manjulata Devi S,et al.Partial characterization of heat-stable,antilisterial and cell lytic bacteriocin of Pediococcus pentosaceus CFR SIII isolated from a vegetable source[J].Annals of Microbiology,2011,61:1-8.
[28] Jiang J,Shi B,Zhu D,et al.Characterization of a novel bacteriocin produced by Lactobacillus sakei LSJ618 isolated from traditional Chinese fermented radish[J].Food Control,2012,23(2):338 -344.
[29] Kopermsub P,Mayen V,Warin C.Potential use of niosomes for encapsulation of nisin and EDTA and their antibacterial activity enhancement[J].Food Research International,2011,44(2):605-612.
[30] Parente E,Giglio M A,Ricciardi A,et al.The combined effect of nisin,leucocin F10,pH,NaCl and EDTA on the survival of Listeria monocytogenes in broth[J].International Journal of Food Microbiology,1998,40:65-75.

