D-半乳糖对大鼠骨髓间充质干细胞衰老的影响
颜冰希 ,余姗姗,冯 晓,吴冬玲,蔡昕筱,周倩沁,何晓敏,陈爱嫩,张大勇
(1.浙江大学城市学院医学院,浙江 杭州 310015;2.杭州市第二人民医院,浙江 杭州 310015)
干细胞具有自我更新及多向分化能力,对机体稳态的维持和器官损伤的修复具有重要作用[1]。但干细胞和体内其他细胞一样,也会衰老,衰老干细胞增殖及分化能力减弱[2-3]。MSCs(mesenchymal stem cells,MSCs)可分化为中胚层的各种细胞且经诱导能向神经外胚层分化,是临床细胞移植重要的种子细胞来源[4-5],但MSCs 也存在衰老现象,老年MSCs 移植治疗效果不佳,延缓MSCs 衰老是其研究热点之一[6-7]。我们前期研究提示,老年MSCs 数量少,活力低,体外培养困难[8],因此,构建稳定的MSCs 衰老模型,体外模拟MSCs 衰老对MSCs 衰老研究具有重要意义。D-半乳糖(Dgalactose,D-gal)是一种生理性营养成分,在细胞内通过醛糖还原酶的代谢可转化为半乳糖醇,半乳糖醇不能在细胞内代谢,产生后即在细胞内堆积,提高细胞氧化应激压力[9]。研究表明,D-gal 在动物模型(大鼠、小鼠和果蝇)上具有显著的致衰老作用,而且有复制方法简单、耗时短等优点,已作为致老剂被广泛应用[10-12]。但D-gal 对干细胞衰老的研究还较少,尤其是其对干细胞衰老的影响机制尚不清楚,这些均限制了D-gal 在干细胞衰老研究领域中的应用。本试验采用不同浓度D-gal 培养MSCs,观察其对MSCs 衰老、增殖、存活和氧化应激水平的影响,探讨不同浓度D-gal 诱导MSCs 衰老过程的作用及其机理,以期明确体外构建MSCs衰老实验模型的最适D-gal 浓度,为探讨干细胞衰老提供重要的实验数据。
1 材料和方法
1.1 实验动物 7 日龄Spragus Dawley(SD)乳鼠由浙江省医学科学院提供(动物合格证号:SCXK(浙)2008-0033)。
1.2 主要试剂 DMEM(美国Hyclone 公司),胎牛血清(FBS,杭州四季青生物工程有限公司),PBS 液,HBSS 液(美国Hyclone 公司),胰蛋白酶(美国Hyclone 公司),β-半乳糖苷酶检测试剂盒(南通碧云天生物技术有限公司),AO/EB 染色液(南京凯基生物技术公司),黄嘌呤氧化酶测试盒(南京建成生物工程研究所)。主要的抗体:p21、p16 一抗和HRP-标记的鼠及兔二抗购自Santa Cruz 公司,p53 和β-actin 一抗购自BD 生物科技公司。
1.3 SD 大鼠MSCs 体外培养 拉颈处死SD乳鼠(7 日龄),剪去腹壁,用碘酒、75%乙醇擦拭后肢皮毛,取出乳鼠双侧股骨和胫骨,清除周围的肌肉和韧带,并用HBSS 液清洗3次,切除骨两端的干骺端,暴露骨髓腔,用含有8%肝钠素(500 IU/ml)的PBS 液冲洗骨髓腔,收集冲洗液,离心(1000 r/min,8 min)。用含15%FBS、584 mg/L 谷氨酰胺、105 IU/L 青霉素和100 mg/L 链霉素的DMEM 培养液混悬沉淀细胞。以5×105个/ml 的细胞密度均匀接种到25 ml 的培养瓶中,在37℃和5% CO2培养箱中培养,48 h 后换液除去悬浮细胞,以后每3 d 换液1次,待细胞生长至80%融合时进行传代。后续试验均选用3~4 代的MSCs。
1.4 实验处理 在1.3 的基础上,各组MSCs吸去原培养液后,经PBS 液清洗3 遍,并进行不同的试验处理:①对照组,不含D-gal 的DMEM 培养液。②诱导组:用含1 g/L、10 g/L、50 g/L D-gal 的DMEM 培养液中培养MSCs。每组MSCs 取自6 只SD 乳鼠,各组均培养48 h后进行后续检测。
1.5 各组MSCs 衰老检测(衰老相关β-半乳糖苷酶染色法) MSCs 接种到培养皿中的盖玻片上,当细胞生长至80%融合时,随机分为4组(处理方法见1.4),之后PBS 液清洗3次,4%多聚甲醛固定5 min 后,用酸性液(pH 6.0)清洗细胞2次。加入适量的衰老相关β-半乳糖苷酶(senescence-associated β-galactosidase,SA-β-gal)染色液,37℃下孵育12 h。在相差显微镜下随机选择3个视野,计数每100个细胞中阳性细胞的数目,每组实验重复5次。
1.6 各组MSCs 存活能力检测(AO/EB 染色法) 将MSCs 接种到培养皿中的盖玻片上,当细胞生长至80%融合时,各组进行相应处理(方法同上),之后用PBS 清洗3次,加入AO/EB 染料30 min,混合均匀,PBS 清洗3次。荧光显微镜下,可见4 种细胞形态:①活细胞(VN),核染色质着绿色并呈正常结构;②早期凋亡细胞(VA),核染色质着绿色呈固缩状或圆珠状;③晚期凋亡细胞(NVA),核染色质为橘红色并呈固缩状或圆珠状;④死亡细胞(NVN),核染色质着橘红色并呈正常结构。细胞凋亡率由以下公式计算:细胞凋亡率=(VA+NVA)/(VN+NVN+VA +NVA)×100%,每组实验重复5次。
1.7 各组MSCs 增殖检测 取对数生长期MSCs 制成细胞悬液,调整细胞浓度至3×104/ml,将细胞悬液接种于96 孔板中,每孔接种0.1 ml。各组分别培养1、2、3、4、5、6 和7 d(期间每3d 换液1次),每天培养结束后各孔加入5 mg/ml 的MTT 孵育4 h,然后弃去孔内液体,每孔加入150μl 的DMSO,震荡10 min 后,酶标仪上读取波长为570 nm 的吸光度值,绘制细胞增殖曲线。每组设5个复孔。
1.8 各组MSCs 内氧化应激水平检测 总SOD(T-SOD)活力的测定采用黄嘌呤氧化酶法,MDA 的测定采用硫代巴比妥酸法。各组细胞培养结束后,消化细胞,超声破碎收集细胞裂解液,后续具体步骤按照试剂盒说明书进行操作。
1.9 Western blot 法检测细胞内p53,p21 和p16 表达 各组细胞处理结束后,RIPA 裂解液提取经处理的细胞总蛋白,冰浴30min 裂解混匀、4℃12 000 r/min 离心30 min 后,BCA 法测定总蛋白,SDS-PAGE 凝胶电泳后,转膜到PVDF膜上,5%脱脂奶粉封闭1 h 后,p53,p21 和p16或β-actin 一抗(1∶500~1∶1000 稀释)4℃孵育过夜,TPBS 洗膜,结合辣根过氧化物酶标记的二抗(1∶5000 稀释),TPBS 洗膜,采用ECL 化学发光法检测蛋白的表达。
1.10 统计学分析 采用SPSS 11.5 统计软件处理数据,结果用均数±标准差表示,各组间的差别采用单因素方差分析进行比较。首先采用F 检验进行方差齐性检验,P >0.05 认为方差齐,而后两两比较采用q 检验,当P<0.05 时表示差异具有显著性。
2 试验结果
2.1 衰老相关β-半乳糖苷酶染色结果 衰老相关β-半乳糖苷酶染色显示,在对照组中仅见少量细胞呈β-半乳糖苷酶染色阳性,而1 g/L D-gal、10 g/L D-gal、50 g/L D-gal 这3组β-半乳糖苷酶阳性细胞体积变大,形态扁平,10 g/L D-gal、50 g/L D-gal 两组阳性细胞数较多(图1A)。细胞计数结果表明,对照组β-半乳糖苷酶阳性细胞数目为(20.8±4.9)个/100 细胞,1 g/l D-gal、10 g/l D-gal、50 g/l D-gal 诱导组β-半乳糖苷酶阳性细胞数目依次为为(27.6±6.0)、(59.6±10.0)、(69.8±11.8)个/100 细胞,其中10 g/l D-gal、50 g/l D-gal组较对照组明显升高,差异具有统计学意义(P<0.01,n=5),说明在上述两组浓度下D-gal 可促进MSCs衰老(图1B)。
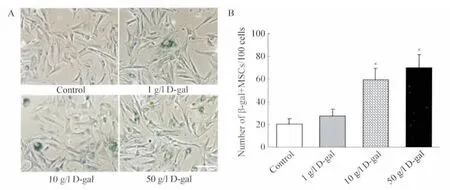
图1 D-gal 促进MSCs 衰老Fig.1 Effects of D-gal on MSCs aging
2.2 Western blot 法检测衰老相关蛋白表达结果 为进一步明确D-gal 对MSCs 衰老的作用,我们检测了D-gal 对衰老相关蛋白p53,p21 和p16 表达的影响。结果显示,随D-gal 处理浓度增高,MSCs 内p53、p21 和p16 表达逐渐增加(图2)。
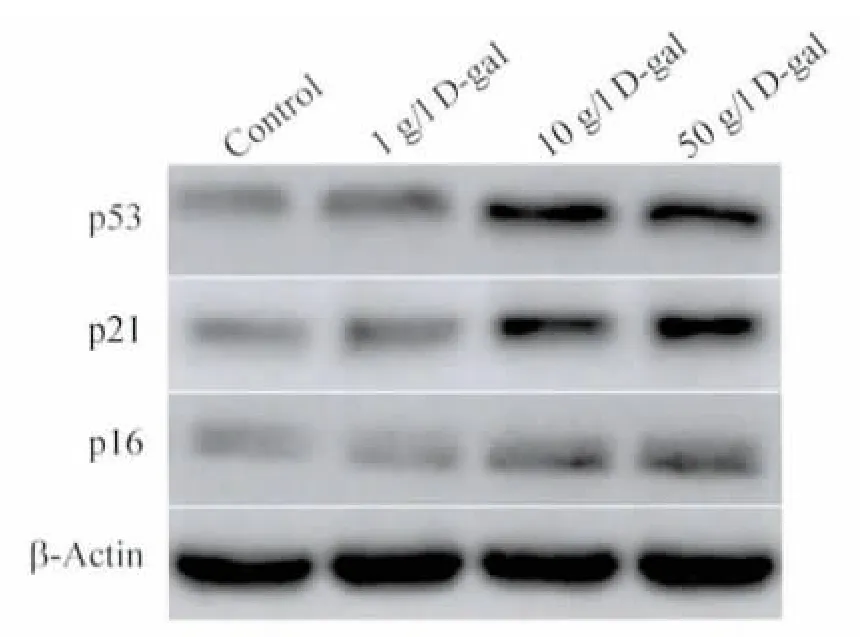
图2 D-gal 促进MSCs 内p53、p21 和p16 表达Fig.2 D-gal can increase the p53,p21 and p16 expression in MSCs
2.3 AO/EB 双染检测MSCs 凋亡结果 AO/EB 双染结果显示,对照组细胞形态正常,未出现明显的细胞凋亡情况,1 g/L 和10 g/L D-gal组MSCs 仅有少量细胞表现出凋亡细胞的形态学表现,凋亡细胞出现细胞形态皱缩、染色体聚集、细胞质和细胞核内出现红染等表现,大部分细胞形态正常;而50 g/L D-gal组的MSCs 出现明显的凋亡和坏死变化(图3A)。凋亡率计数结果显示,1 g、10 g、50 g/L D-gal 诱导组细胞的凋亡 率 依次 为19.7%±4.6%、24.6%±8.5%、51.2%±9.9%,其中50 g/L D-gal组与对照组(11.9%±3.0%)的差异具有统计学意义(P<0.01),提示50 g/L D-gal 可以明显导致MSCs 凋亡、坏死(图3B)。
2.4 MTT 法检测MSCs 增殖结果 MTT 法检测MSCs 的增殖能力,结果表明培养第5~7天,10 g/L、50 g/L D-gal 诱导组的吸光度值较对照组降低,差异具有统计学意义(P<0.05),说明上述两组的细胞增殖能力较对照组有下降,表明D-gal 处理可抑制MSCs 的增殖能力(图4)。
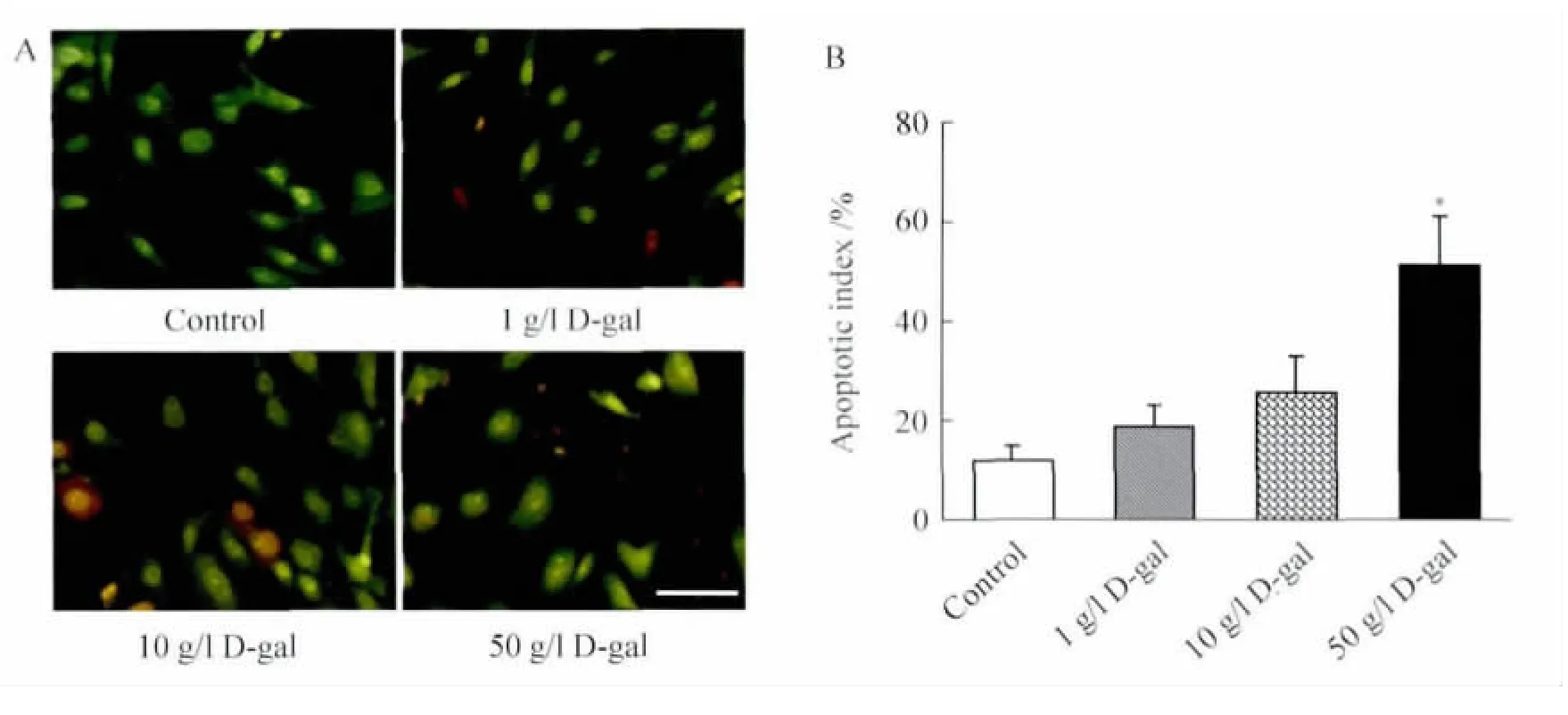
图3 高浓度D-gal 可诱导MSCs 凋亡Fig.3 High-concentration D-gal can induce MSCs apoptosis
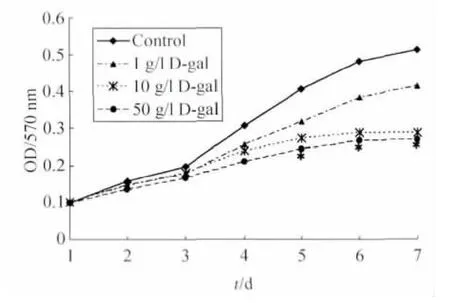
图4 D-gal 抑制MSCs 增殖Fig.4 D-gal can inhibit the proliferation of MSCs
2.5 D-gal 对MSCs 内氧化水平影响检测结果对照组SOD 活力为(35.1±7.2)U/mgprot,1、10、50 g/L D-gal 诱导组SOD 活力分别为(28.3±5.8)、(14.6±3.7)、(11.6±2.8)U/mgprot,检测结果表明SOD 活力随D-gal 浓度增高而逐渐降低;其中,10、50 g/L D-gal组的SOD 较对照组明显减少,具有统计学意义(P<0.01,图5A)。对照组MDA 含 量为(8.7±2.5)mmol/mgprot,1、10、50 g/L D-gal 诱导组的MDA 含 量 为(14.6±4.4)、(27.5±5.4)、(29.9±6.2)mmol/mgprot,结果说明MDA 活力随D-gal 浓度增高而逐渐升高,其中10 g/L、50 g/L D-gal组的MDA 与对照组的差别有统计学意义(P<0.01,n=5)。这些结果提示D-gal 可以促使MSCs 内氧化应激水平升高(图5B)。
3 讨论
当前,干细胞移植已成为临床治疗疾病的重要手段,研究表明,MSCs 在机体稳态维持和损伤修复中发挥重要作用,并已被广泛应用于干细胞移植治疗中[5]。然而,MSCs 也存在衰老现象,事实证明老年个体接受干细胞治疗的效果普遍不如年轻个体,严重影响了其移植疗效[6]。因此,延缓MSCs 衰老已成为干细胞衰老研究的热点,但目前,老年MSCs 由于其数量少,活性低,体外培养具有一定难度,严重影响了MSCs 的衰老研究进展。因此,体外人为构建稳定可靠的MSCs 衰老模型,具有重要的基础研究意义。
D-gal 诱导的衰老动物模型是目前国内常用的衰老诱导模型,具有复制方法简单、耗时短等优点,现已广泛用于个体衰老的机制以及延缓衰老药物筛选等研究中,但其在体外诱导细胞衰老中的研究仍较少,邢玉芝等研究了D-gal对MSCs 衰老的影响[13],但未能明确D-gal 对MSCs 衰老相关蛋白表达及其存活能力的影响,这些都是细胞衰老鉴定的重要指标,同时D-gal诱导细胞衰老的作用机制也不明确。本实验通过检测不同浓度D-gal 诱导MSCs 衰老后,其衰老相关蛋白表达及其增殖、凋亡情况的改变,确定D-gal 诱导MSCs 衰老的最适浓度,并初步探讨D-gal 抑制细胞衰老的可能机理,为MSCs 衰老研究提供良好的体外模型。
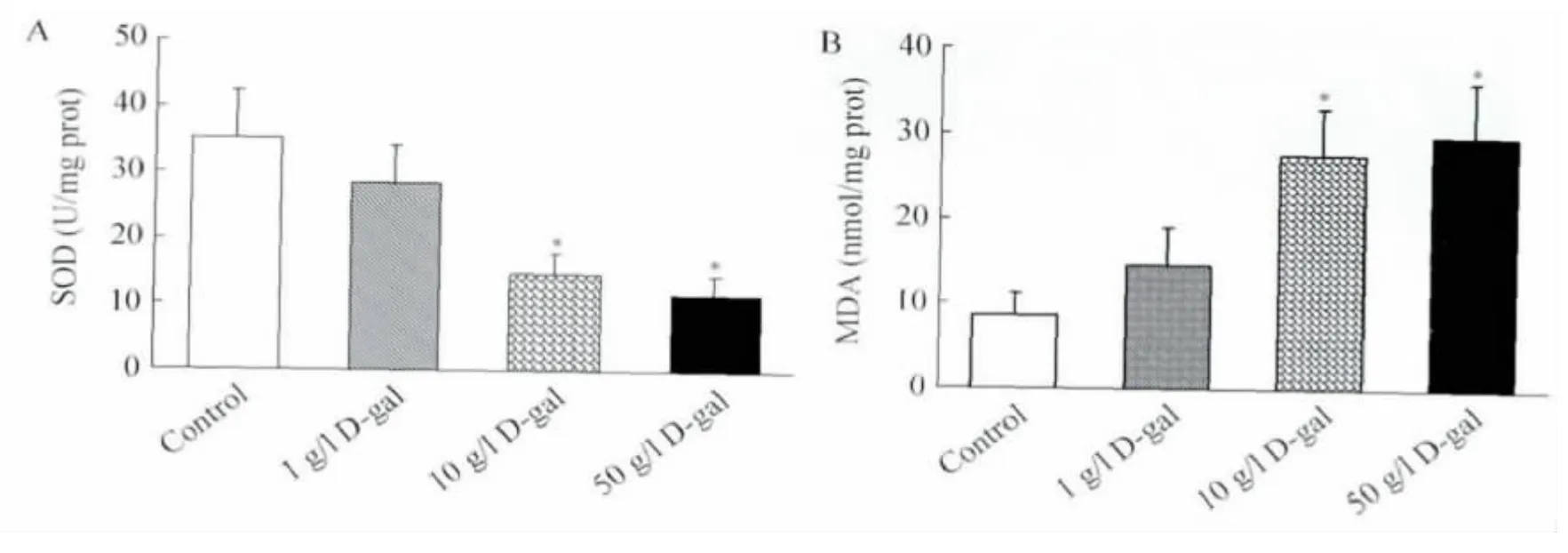
图5 SOD、MDA 含量检测结果Fig.5 Effects of D-gal on SOD/MDA
3.1 不同浓度D-gal 对MSCs 衰老和凋亡的影响 本实验β-半乳糖苷酶染色结果显示,D-gal诱导下,10 g/L、50 g/L D-gal 诱导组的阳性细胞数目显著高于对照组(P<0.01),并呈现体积变大、形态扁平等衰老形态,且随D-gal 处理浓度提高,细胞内衰老相关蛋白p53,p21 和p16 表达逐渐增加,表明D-gal 体外诱导细胞衰老的作用依然存在,但低浓度(1 g/L组)作用不明显。在AO/EB 双染法结果表明,低浓度D-gal 可对MSCs 凋亡无明显影响;而高浓度Dgal(50 g/L)可诱导50%以上的MSCs 发生晚期凋亡或坏死,对细胞造成了很强损伤,不利于构建稳定的细胞衰老模型。邢玉芝等[13]也从MTT 检测中发现,8 g/L 的D-gal 处理MSCs,能够导致其增殖能力降低;而随着浓度的增加,16 g/L 的D-gal 处理后细胞呈负增长。因此,我们认为,10 g/L D-gal 具有良好的MSCs 衰老诱导作用,且可抑制细胞正常的增殖和存活能力;但50 g/L 浓度下,D-gal 的细胞损伤作用明显增强,故10 g/L 是D-gal 进行诱导MSCs 衰老的合适浓度。
3.2 D-gal 诱导MSCs 衰老的作用机制 细胞衰老的同时,常伴随着细胞内活性氧成分的增多[14],我们前期研究也表面氧化应激水平升高是促进MSCs 衰老的重要原因[7]。SOD 是重要的抗氧化酶,可以清除细胞中过多的氧自由基,其活力可反映出细胞的抗衰老能力;如果SOD活力下降,多余的自由基就作用于脂质发生过氧化反应,产生大量的MDA,会引起蛋白质、核酸等生命大分子的交联聚合,具有细胞毒性。MDA 含量能证明细胞内过氧化物质的水平。本研究结果显示,D-gal 可使细胞内SOD 的活力下降,而MDA 含量升高,且与浓度成正相关。由此我们推测,D-gal 可能通过氧化应激作用提高细胞的过氧化水平来促进细胞衰老,从而抑制其增殖分化,促进细胞内氧化应激水平升高可能是D-gal 在体外促进细胞衰老的作用机制之一。
综上,我们采用D-gal 诱导MSCs 细胞形态、数量和增殖能力的改变,结果提示,D-gal 体外构建MSCs 衰老模型的合适浓度是10 g/L,并揭示促进细胞内氧化应激水平升高可能是D-gal 诱导细胞衰老的作用机制,为进一步研究MSCs 衰老及其机理提供了可靠且有价值的实验数据。
[1]MOHANTY S T,CAIRNEY C J,CHANTRY A D,et al.A small molecule modulator of prion protein increases human mesenchymal stem cell lifespan,ex vivo expansion,and engraftment to bone marrow in NOD/SCID mice[J].Stem Cells,2012,30:1134-1143.
[2]ESTRADA J C,TORRES Y,BENGURIA A,et al.Human mesenchymal stem cell-replicative senescence and oxidative stress are closely linked to aneuploidy[J].Cell Death & Disease,2013,4:e691.
[3]RAMOS F J,KAEBERLEIN M.Ageing:A healthy diet for stem cells [J].Nature,2012,486:477-478.
[4]REINDERS M E,DE FIJTER J W,ROELOFS H,et al.Autologous bone marrow-derived mesenchymal stromal cells for the treatment of allograft rejection after renal transplantation:results of a phase I study[J].Stem Cells Translational Medicine,2013,2:107-111.
[5]SADAN O,MELAMED E,OFFEN D.Bone-marrowderived mesenchymal stem cell therapy for neurodegenerative diseases [J].Expert Opinion on Biological Therapy,2009,9:1487-1497.
[6]KRETLOW J D,JIN Y Q,LIU W,et al.Donor age and cell passage affects differentiation potential of murine bone marrow-derived stem cells[J].BMC Cell Biology,2008,9:60.
[7]ZHANG D Y,PAN Y,ZHANG C,et al.Wnt/betacatenin signaling induces the aging of mesenchymal stem cells through promoting the ROS production[J].Molecular and Cellular Biochemistry,2013,374:13-20.
[8]ZHANG D Y,WANG H J,TAN Y Z.Wnt/betacatenin signaling induces the aging of mesenchymal stem cells through the DNA damage response and the p53/p21 pathway [J].PloS One,2011,6:e21397.
[9]SONG X,BAO M,LI D,et al.Advanced glycation in D-galactose induced mouse aging model [J].Mechanisms of Ageing and Development,1999,108:239-251.
[10]WANG Hui,ZHANG Shuhua,GUO Aimin,et al(王 晖,张淑华,郭爱民,等).Effects of almond on D-gal-induced aging rats [J].Journal of Hygiene Research(卫生研究),2004,33:222-224.(in Chinese)
[11]MA Yanhui,LIU Anjun,ZHANG Guorong,et al(马艳弘,刘安军,张国蓉,等).Effect of selenoarginine on cellular immunological function in Dgal aging mice[J].Chinese Journal of Cellular and Molecular Immunology(细胞与分子免疫学杂志),2007,23:1126-1129.(in Chinese)
[12]CUI X,WANG L,ZUO P,et al.D-galactose-caused life shortening in Drosophila melanogaster and Musca domestica is associated with oxidative stress[J].Biogerontology,2004,5:317-325.
[13]XING Yuzhi,YANG Linglin,LIN Hong,et al(邢玉芝,杨 玲麟,林洪,等).Study on cell senescence induced by D-galactose in cultured rat mesenchymal stem cells[J].Chinese Journal of Reparative and Reconstructive Surgery(中国修复重建外科杂志),2006,20(4):475-479.(in Chinese)
[14]PAGE M M,ROBB E L,SALWAY K D,et al.Mitochondrial redox metabolism:aging,longevity and dietary effects [J].Mechanisms of Ageing and Development,2010,131:242-252.

