抑制STAT3在胶质瘤细胞中的表达导致细胞凋亡*
过七根
(九江学院生命科学学院 江西九江 332000)
脑胶质瘤(Gliolma)是颅内最常见的恶性肿瘤,起源于脑组织中的神经胶质细胞,约占成人颅内肿瘤的35.2~61%,其中恶性胶质瘤约占43.6%[1]。脑胶质瘤发病率和恶性程度都很高,且常规的手术治疗和化疗、放疗相结合的方法都难以彻底治愈。近年来随着分子生物学研究的不断深入,利用基因治疗胶质瘤的研究已成为必然趋势和发展方向,目前应用最多的包括抑癌基因、细胞周期调控子以及生长因子等[1]。
Stat3蛋白异常激活与多种恶性肿瘤发生、发展密切相关。目前已有学者以Stat3为靶点进行肿瘤治疗研究,取得了初步结果,但有关Stat3的详细作用机制尚未明确,有待于进一步深入研究。本试验采用RNAi的方法,发现胶质瘤细胞中Stat3的低表达会导致细胞凋亡,表明Stat3蛋白在胶质瘤细胞正常生长中起到重要作用,抑制该蛋白在细胞中的表达会导致细胞凋亡。这将为体内研究Stat3对胶质瘤的作用及作用机制,并为脑胶质瘤这一颅内恶性肿瘤的基因治疗提供一种新的思路。
1 材料与方法
1.1 细胞株
人脑恶性脑胶质瘤细胞株SHG44,购自中国科学院上海细胞所。
1.2 主要试剂
DMEM (Gibco),FBS (Gibco),SilenCircleTMRNAi Transcription Kit(美国绿阳生物技术公司),LipofectamineTM2000 (Invitrogen),Stat3多克隆抗体(Santa Cruz),二抗辣根酶标记山羊抗兔IgG(Santa Cruz)。
1.3胶质瘤细胞株SHG44的培养和免疫组织化学鉴定
细胞用含10% FBS的DMEM于37℃、50 mL/L CO2饱和湿度下常规培养,2~3d传代一次。染色前1d将细胞种植到0.1(W/V)Poly-L-Lysine包被的玻片上,染色当天取出待染细胞,用PBS液洗去残余培养液,4%(m/m)多聚甲醛固定20min[1]。PBS液洗2次,每隔10min 1次;10 %(v/v)正常山羊血清封闭1h;PBS液洗3次;Stat3多克隆抗体(1∶300的体积比,用0.1 mM PBS稀释)4℃过夜,PBS液洗3次;加二抗辣根酶标记山羊抗兔IgG(1∶100的体积比,用0.1mM PBS稀释)32℃孵育1 h,PBS液洗3次;加液体AEC酶显色,常光下观察。
1.4 shRNA表达载体的构建
根据Stat3基因的全长序列,按照SilenCircleTMRNAi Transcription Kit方法设计转录shRNA的对应于Stat3基因的回文序列(各为53bp)[1],其上游引物5’-AAA AAG CAG CTG CAC CAG CTG TAC TTC AAG CAA GTA CAG CTG GTG CAG CTG CG-3’,下游引物5’-ACA CCG CAG CTG CAC CAG CTG TAC TTG CTT GAA GTA CAG CTG GTG CAG CTG CT-3’。引物在95 ℃退火后合成双链DNA(dsDNA),将dsDNA与线状SilenCircle 载体连接,经StuI鉴定连接成功后,用E.coli扩增并提取DNA[5]。
1.5胶质瘤细胞株SHG44的转染
由于胶质瘤细胞较难转染,将RNAi质粒与表达荧光的荧光质粒EGFP-N2进行共转来分析转染效率,RNAi质粒与荧光质粒EGFP-N2的转染比例为3∶1。用只转染EGFP-N2质粒的细胞做对照组来分析stat3基因表达变化对细胞凋亡的影响是否具有特异性,共转RNAi载体及EGFP-N2的细胞为实验组来分析stat3基因表达变化对细胞凋亡的影响。具体转染步骤按照LipofectamineTM2000kit进行,转染后的细胞在37℃,50mL/L CO2饱和湿度下常规培养24~96h,观察转染结果并进行基因阻断分析[1]。
1.6 TUNEL检测细胞的凋亡
转染3d后,用TdT介导的dUTP缺口末端标记技术(TUNEL)进行检测(原位细胞凋亡检测Kit, Santa Cruz Biotechnology)。检测当天,细胞涂片经空气干燥后用新制备的4%多聚甲醛溶液(溶于Ph7.4 PBS中)固定,室温30min。PBS洗片后,与阻断剂(0.3%H2O2甲醇溶液)室温孵育30min, PBS洗片,与通透液(0.1% Triton X-100溶于0.1%枸橼酸钠溶液中)在冰浴中孵育2min。PBS冲洗2次,擦干样品周围的水,滴加50uL的TUNEL反应混合液,在湿盒中37℃孵育60min。PBS冲洗3次后,至此样品可在荧光镜(Nikon)下分析结果,凋亡细胞可表达明显荧光。
1.7 细胞总RNA的提取及RT-PCR分析
将转染后的细胞分别按标准方法提取中RNA并反转成cDNA,Stat3 PCR引物设计为5’-GGG TCT GGC TAG ACA ATA TCA TCG-3’和5’-CAC TAC CTG GGT CGG CTT CG-3’以及作为内参的β-actin引物设计为5’-CCA AGG CCA ACC GCG AGA AGA TGA C-3’和5’-AGG GTA CAT GGT GGT GCC GCC AGA C-3’。Stat3 PCR产物大小为420bp, β-actin PCR产物大小为590 bp。PCR扩增条件为:①95℃1min;②30个循环 (95℃ 45s;55℃ 2min;72℃ 90s);③72℃ 10min。PCR产物用1%琼脂糖凝胶电泳检测。
2 结果与分析
2.1 Stat3在胶质瘤细胞中表达的鉴定和定位
Stat3蛋白为信号转导和转录激活蛋白,它能介导外接的信号分子被磷酸化从而进入核内调控基因的表达。用Stat3蛋白的特异性抗体对细胞进行染色,发现正常状态下生长的胶质瘤细胞系SHG44表达Stat3蛋白(见图1a)[1],并且在细胞核部位染色明显(见图1b)。表明Stat3蛋白在正常的SHG44细胞系中也是通过在核内调控基因的表达从而维持细胞的特性。
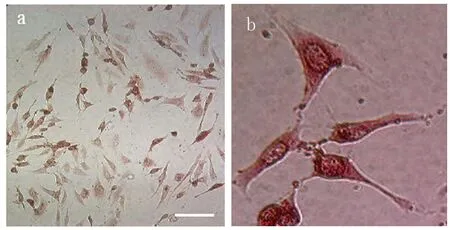
图1 a 经Stat3免疫反应的SHG44细胞(200×);b 经Stat3免疫反应, 细胞核部位染色明显的SHG44细胞(400×)
2.2 转染shRNA载体后细胞形态发生改变
转染48h后,发现转染有shRNA表达载体的细胞与对照组的细胞相比形态发生显著变化。经苏木素-伊红(HE)染色,常光下观察到对照组细胞呈原有的形态,细胞核染成均一蓝色,胞膜完整连续(见图2a),而转染后的细胞变圆、变小,细胞核固缩、碎裂,染成深蓝色或蓝黑色(见图2b)。用丫啶橙-溴化乙锭染色,荧光下观察正常细胞的细胞核DNA呈黄色或黄绿色均匀荧光,细胞质的RNA为橘黄色荧光(见图2c),而转染细胞的细胞核较小,核固缩呈致密浓染黄绿色,或呈半月形,甚至可见黄绿色碎片(见图2d),为凋亡早期的细胞症状。
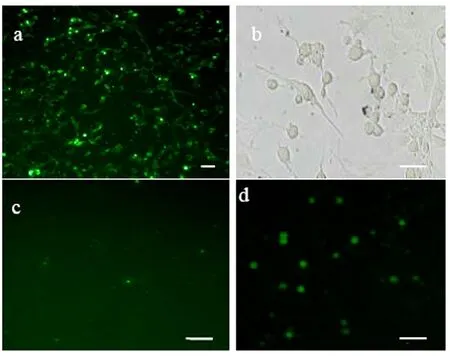
图2 a 48h后,经苏木素-伊红染色,常光下未转染有shRNA表达载体的对照组细胞(200×);b 48h后,经苏木素-伊红染色,常光下转染有shRNA表达载体的细胞(200×);c 48h后,经丫啶橙-溴化乙锭染色,荧光下未转染有shRNA表达载体的对照组细胞(200×);d 48h后,经丫啶橙-溴化乙锭染色,荧光下转染有shRNA表达载体的细胞(200×)
2.3 TUNEL检测转染shRNA载体的细胞
转染3d后,用TdT介导的dUTP缺口末端标记技术(TUNEL)进行检测,与对照组相比,荧光下观察凋亡细胞有明显荧光(见图3a,d),并且细胞凋亡数目明显比对照组增多(见图3c)。该研究结果表明,转染到胶质瘤细胞中的shRNA表达载体能够持续的表达shRNA,所产生的shRNA很快的被加工成siRNA,从而达到了持续抑制的效果,通过抑制Stat3在胶质瘤细胞中的表达,可导致了细胞的凋亡,并进一步表明Stat3蛋白在正常的SHG44细胞系中,是通过在核内调控基因的表达来维持细胞特性的。
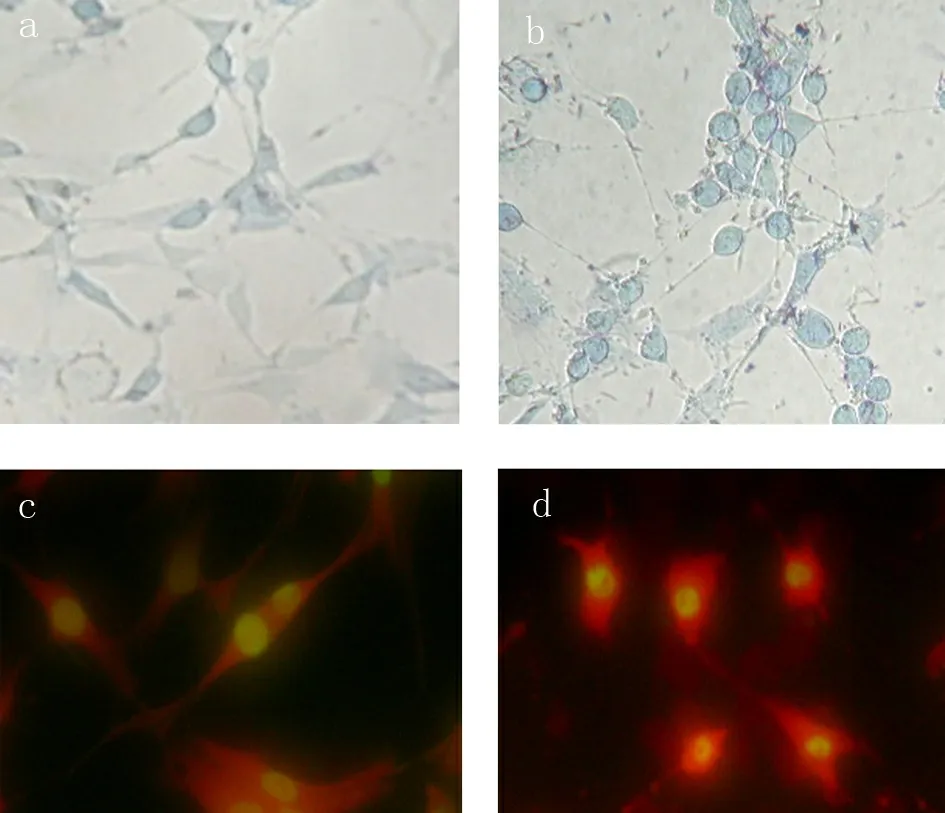
图3 用TUNEL技术检测后的SHG44细胞 a TUNEL作用下凋亡细胞荧光下显色;b 常光下的转染后细胞,细胞形态发生明显变化,有凋亡现象;d 转染shRNA载体的细胞比对照组 c 相比,凋亡细胞数量明显增多。
2.4 RT-PCR分析
培养5d后,用Trizol抽提总RNA并反转录成cDNA,然后用其作为模板,用Stat3特异性的引物进行PCR反应。对照组中Stat3的mRNA的表达量明显大于实验组中Stat3的mRNA表达量(见图4)[1]。结果表明,实验组中Stat3基因的表达被RNA干扰载体有效抑制。因此,Stat3蛋白对维持胶质瘤细胞的正常生长有重要作用,抑制Stat3蛋白的表达会引起胶质瘤细胞的凋亡。在实验组和对照组中,都用β-actin作为阳性对照。
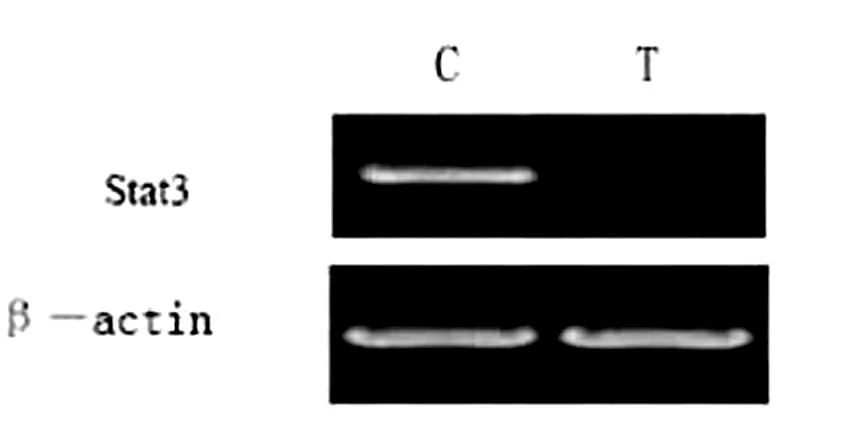
图4 转染5d后Stat3的mRNA表达量。C为对照组细胞的表达量,T为转染细胞的表达量。β-actin为阳性对照3讨论
脑胶质瘤作为一种常见的颅内恶性肿瘤,目前传统的治疗方法并不能彻底将其治愈。近年来的基因治疗是以胶质瘤中的特异基因为靶点进行研究,以确定基因的具体作用并针对性进行研究。Rahaman S等发现Stat3在神经胶质瘤及胶质瘤细胞系中有表达。由于Stat3蛋白作为信号转导和转录激活蛋白,它能介导外接的信号分子被磷酸化从而进入核内调控基因的表达。用Stat3的特异性抗体进行检测,可知胶质瘤细胞中表达Stat3蛋白并在细胞核部位染色明显。目前已有学者以Stat3为靶点进行肿瘤治疗研究,取得了初步结果,但有关Stat3的详细作用机制尚未明确,有待于进一步深入研究。
为了进一步验证Stat3蛋白在胶质瘤中的具体作用,利用RNAi的方法构建了shRNA表达载体,并将其转染入胶质瘤细胞系SHG44中以抑制其在胶质瘤细胞中的表达,转染后发现细胞在形态和生物学特征方面都发生了明显的变化;用TUNEL标记可见细胞有凋亡特征;RT-PCR检测抑制后的Stat3在胶质瘤中表达量明显减少。
结果表明,胶质瘤细胞中Stat3的低表达会导致细胞的凋亡。由此推测,在脑胶质瘤中下调该基因的表达也将使肿瘤细胞凋亡。这将为体内研究Stat3对胶质瘤的作用及作用机制,并为脑胶质瘤这一颅内恶性肿瘤的基因治疗提供一种新的思路。
参考文献:
[1]段燕红,任雯雯,钱艳蓉,等.层连蛋白受体67LR在胶质瘤细胞增殖中作用的研究[J].西北农业学报,2008,17(4):52.

