毛梾种子低温层积过程中内源激素的变化及其与发芽的关系
李冬林,张亚楠,金雅琴,夏重立
(1.江苏省林业科学研究院,江苏 南京 211153;2.金陵科技学院园艺学院,江苏 南京 210038)
毛梾Cornus walteri为我国传统的木本油料植物,隶属山茱萸科梾木属Cornus。其自然分布于我国辽宁南部和华北、华东、中南、西北、西南等地区[1]。毛梾果实含油率高达31.8%~41.3%,出油率为25%~30%[2],其油脂不仅可供食用,还可用作机械和钟表的润滑油,也是制皂和油漆的好原料;其叶质地柔软,富含营养,制成叶粉,各种畜禽均可利用,是一种良好的木本饲料植物;木材坚硬、纹理细致,是一种良质木材,其叶和树皮可用以提取拷胶,还含有单宁物质,可用作染料;亦是绿化和固土树种和蜜源植物。
毛梾最常用的育苗方法是播种育苗,但是毛梾种实具有明显的休眠习性,种皮坚硬,未经处理的种子当年几乎不能发芽,这给生产中实生苗的培育带来了一定的难度,并成为毛梾天然更新和引种栽培的主要制约因子。近年来,有关梾木属种子破除休眠的方法已有研究报道[3-4],但相关机制尚不清楚。为此,对毛梾种子低温层积过程中各种内源激素的含量进行了测定,分析了内源激素与种子发芽的关系,以期为揭示毛梾种子休眠的内在机理、促进其引种与繁育而提供理论依据。
1 材料与方法
1.1 材料及处理
供试种实采集于江苏南京中山陵园。种实于2011年10月采集,经揉搓、脱肉、冲洗、晾干,获得纯净的种实5 kg。经测定,种实圆球型,内果皮浅肉红色,直径4.31~5.18 mm,百粒质量为 4.336 4~ 4.430 0 g。
试验于2011年10月至2012年5月在江苏省林业科学研究院实验室进行。种实经脱肉后采用混沙湿藏处理,将种实和湿沙(含水量40%~45%)按照1∶3的体积比混合后置于0~5 ℃的冷库中。湿沙为新鲜河沙,并经高温灭菌处理。2011年10月至2012年6月,每月中旬取样1次,重复3次,共取样7次。取样时将种实自湿沙中筛出,用自来水冲洗,并用吸水纸吸干水分,筛拣,获得纯净种实(含肉红色内果皮,以下称为种子)待测。
1.2 内源激素的测定
按照四分法从待测种实中取出部分样品,将硬果皮敲碎获得白色测试样品(含胚、胚乳及种皮)0.5~1.0 g。液氮速冻后,加入4 mL 的提取液(80%冷甲醇)冰浴研磨至匀浆,转入10 mL的试管中。摇匀后在4 ℃下放置4 h,3 500 r·min-1离心15 min,取上清液。沉淀中加1 mL的提取液,搅匀,置于4 ℃下再提取1 h,然后离心,合并上清液并记录体积,弃去残渣。上清液过C18 固相萃取柱纯化。测定方法采用酶联免疫法(ELISA)[5],所用试剂盒由中国农业大学农学院提供。所有样品均重复测定3次,取平均值。应用Excel作图并作统计分析。
1.3 发芽试验与结果测定
将筛拣后的部分纯净种实置于培养箱中作发芽试验。将种子均匀播种于盛有湿沙的容器盒中,每盒100粒。播种后覆沙2~3 ㎝,均匀淋水,保证沙床的平整和湿润,然后盖膜以保湿。沙床温度保持在25~30 ℃之间。重复试验3次。播种后每天观察种子发芽情况,以种子出土作为发芽标准,统计发芽势及发芽率。
1.4 数据处理
采用SAS612 进行数据统计与分析。采用方差分析方法估算不同处理间的差异显著性(α=0.05),试验结果均为平均值±标准差。
2 结果与分析
2.1 低温层积过程中种子内源激素含量的变化规律
2.1.1 IAA含量的变化规律
低温层积处理过程中毛梾种子IAA含量的变化规律不明显(图1)。未经层积处理的种子其IAA含量最高(81.861 ng·g-1),低温层积处理后的种子其IAA含量降低为81.861 ng·g-1,但层积一段时间(30 d)后其IAA含量开始下降,并于层积120 d时上升到极值(65.751 ng·g-1),但层积处理150 d后其IAA含量又降至试验期间的最低值(31.141 ng·g-1)。

图1 低温层积过程中毛梾种子IAA含量的变化Fig. 1 Change of IAA content in C. walteri seeds during cold stratification
2.1.2 ABA含量的变化规律
ABA含量变化明显,整个处理期间呈现出显著的下降趋势(如图2 A所示)。层积处理开始前,种子中的ABA含量最高(329.406 ng·g-1);层积处理后,随着处理时间的延长,ABA含量一直在下降,并在层积处理150 d后降到极值(235.933 ng·g-1),这时ABA的含量是层积处理开始前的0.716倍。尽管在层积处理末期(180 d后)ABA含量有所回升,但ABA含量的变化趋势是随着层积处理时间的延长而下降的。
2.1.3 GA1/3含量的变化规律
GA1/3含量的变化规律如图2 B所示。在层积处理初期(0~30 d)GA1/3含量缓慢增加,并在层积处理30 d时出现极值(5.734 ng·g-1)。但在层积处理30 d以后GA1/3含量又开始下降,这种下降的趋势一直持续到试验结束(180 d)。从GA1/3含量的总体变化趋势来看,尽管是下降的,但变化一直很平稳。
2.1.4 ZRs与iPAs含量的变化规律
有关文献[6]报道,细胞分裂素(CTK)具有促进细胞分裂、抑制器官老化、诱导花芽分化及延缓叶片衰老的作用。毛梾种子细胞分裂素ZRs含量的变化规律见图2 C。从总体趋势来看,其变化幅度很小。在层积处理开始前,毛梾种子中ZRS的含量为11.088 ng·g-1;层积90 d后,ZRS含量有所下降,并出现了低谷(10.019 ng·g-1),随后又开始小幅升高;在层积150 d后,ZRS的含量为11.001 ng·g-1,随后又出现小幅的下降。
iPAs含量的变幅相对较大(如图2 D所示)。在整个层积处理期内,出现了2次上升2次下降的变化过程,其变化曲线略呈“M”形。在层积处理开始时,iPAs含量(3.553 ng·g-1)为整个层积处理期内的最低值;随后开始上升,并于层积处理30 d后升至极值(5.937 ng·g-1),随后开始下降;层积处理90 d时,iPAs含量降为4.557 ng·g-1;层积处理120 d后,再次升至最大值(7.124 ng·g-1);随后开始降低,并一直持续到试验结束。

图2 低温层积过程中毛梾种子ABA、GA1/3、ZRs和iPAs含量的变化Fig. 2 Changes of ABA, GA1/3, ZRs and iPAs contents in C. walteri seeds during cold stratification
2.2 低温层积处理过程中毛梾种子中5种内源激素含量比值的变化规律
许多研究结果表明,不同植物激素对植物生理活动的影响不是孤立地发生作用的,而是既相互制约又相互促进的[7-8]。毛梾种子中IAA、GA1/3、ZRs、iPAs的平均值及其与ABA的比值见图3。
IAA/ABA的变化趋势与IAA含量的变化趋势基本相似(图3 A)。层积处理开始时IAA与ABA的比值最大,出现了最大比值(0.248),随后下降并出现低谷(0.141)。层积处理30 d后,IAA/ABA开始上升,一直延续到120 d,这时的比值增加到0.231,随后又重新出现了短时的下降趋势(处理后150 d,IAA/ABA为0.132)。相对而言,GA1/3/ABA比值在整个层积处理期内波动较小。层积处理初期GA1/3/ABA的比值很低(0.015 7),但随着层积处理时间的延长而迅速增加;在层积处理30 d时测得的GA1/3与ABA的比值为0.019 3;其后随着层积处理时间的延长其比值一直很平稳地变化着(如图3 B所示)。
ZRs/ABA比值的变化趋势如图3 C所示。由图3 C可知,在层积处理前期ZRs/ABA比值的变化平稳。低温层积处理120 d后,其比值开始增加,并于层积处理150 d后上升到极值(0.046 6)。而iPAs/ABA的变化趋势与iPAs含量的变化趋势类似,在整个试验处理期间出现了2次上升和2次下降的变化过程(图3 D)。在层积处理开始时,iPAs/ABA为0.010 8,此为整个处理期内的最低值;随后开始上升,层积处理30 d后升至0.020 0,随后开始下降,在层积处理90 d时,其比值降为0.016;在层积处理150 d后其比值又升为整个试验期间的最大值(0.027 8);随后又有所降低,并一直持续到试验结束。

图3 低温层积过程中毛梾种子中的IAA、GA1/3、ZRs、 iPAs和ABA比值的变化Fig. 3 Changes of ratios of IAA, GA1/3, ZRs, iPAs to ABA in C. walteri seeds during cold stratification
2.3 不同低温层积处理种子的各发芽指标值
发芽试验结果表明,不同层积处理时间对种子发芽率与发芽势均有显著影响(表1)。方差分析结果表明,不同层积处理时间下毛梾种子的发芽率与发芽势的差异均极显著(P<0.01)。未经层积处理的干藏种子其发芽率与发芽势均为0,说明干藏种子存在严重的发芽障碍。从表1中还可以看出,层积处理30 d后,毛梾种子的发芽率与发芽势均不足10%,可见,短期的沙藏层积处理尚不能解除种子的深休眠。随着层积处理时间的延长,种子的发芽率与发芽势均明显上升。低温层积处理120与150 d后种子发芽率与发芽势的变化均不显著,以层积处理180 d的发芽率与发芽势分别为41.34%和36.13%,均为最大值。经过层积处理的种子,种子休眠逐步被解除,其发芽率与发芽势均明显增加。可见,低温层积处理对解除毛梾种子的休眠十分奏效。

表1 不同层积处理时间种子各发芽指标值†Table 1 Germination indexes of seeds at different durations of stratification treatment
2.4 低温层积过程中毛梾种子内5种内源激素的含量及其比值与种子发芽率与发芽势的相关性
低温层积过程中毛梾种子中5种内源激素含量及其比值与种子各发芽指标的相关分析结果见表2。从表2中可以看出,IAA含量与IAA/ABA比值之间呈极显著的正相关(p<0.01),但与iPA含量、ZRS/ABA比值、iPA/ABA比值之间均呈负相关,但其相关性不显著(p>0.05);ABA含量与ZRS/ABA比值之间呈极显著的负相关(p<0.01),与iPA/ABA比值间呈显著的负相关(p<0.05);iPA含量与iPA/ABA比值之间呈极显著的正相关(p<0.01),iPA/ABA与ZRS/ABA两个比值间也呈显著的正相关(p<0.05)。这一结果说明,毛梾种子中各种激素间存在一定的相关性。
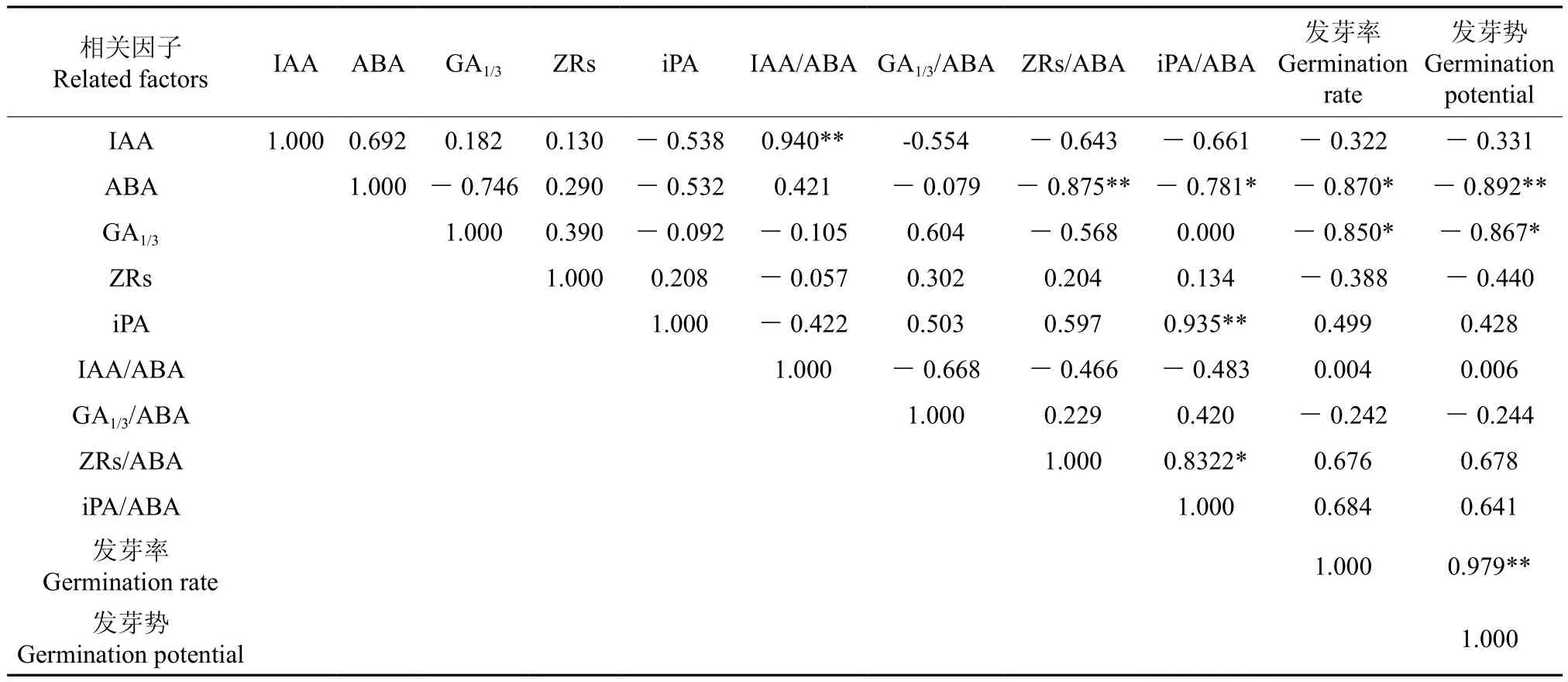
表2 5种内源激素含量及其比值与种子各发芽指标的相关性分析结果†Table 2 Relationship analysis of five kinds of endogenous hormones contents in seeds and their ratios and seeds germination indexes
从5种激素与种子各发芽指标的相关性来看,ABA含量与种子发芽率呈显著负相关(p<0.05),与发芽势呈极显著的负相关(p<0.01),其相关系数分别为0.870、0.892。GA1/3含量与种子发芽率、发芽势间均呈显著的负相关(p<0.05),其相关系数分别为0.850、0.867。这一分析结果说明,种子内ABA含量与GA1/3含量对种子发芽的影响最为明显。
3 结论与讨论
在许多物种中,内源激素ABA涉及种子休眠状态的诱导与维持[9-10],对种子内胚的发育、RNA和蛋白质合成都起到了非常重要的调节作用,被认为是控制种子休眠的主要因素[11],可能会降低胚的吸水能力和渗透势,阻碍胚根的伸长,抑制种子的萌发[12]。本研究结果表明,在整个低温层积处理过程中,毛梾种子内ABA含量随着时间的变化总体上是减少的,这与肉苁蓉Cistanche deserticola[13-14]、珙桐Davidia involucrata[15]、紫椴Tilia amurensis[16]、 青 钱 柳Cyclocarya paliurus[17]等深休眠植物种子的试验结果基本相似。随着低温层积处理时间的延长,休眠种子中的ABA含量下降,这也许是种子萌发前的启动信号,对于维持种子中内涵物的生理反应,逐渐解除休眠起到了关键作用。
有关IAA在解除种子休眠方面的作用有不同的研究报道。一种研究结果表明,在层积处理中,休眠种子中的IAA含量上升,这对休眠的解除起到了一定的促进作用。如Kochankov等人[18]认为,IAA参与了休眠调节;杨万霞等人[17]研究认为,青钱柳种子在层积处理中其IAA含量总体呈上升趋势,这对解除其休眠有利。另有一些研究结果表明,种子休眠与IAA含量的关系不大,过高的IAA含量甚至会起负面作用。如李金克等人[19]研究认为,高浓度的IAA对红松Pinus koraiensis种子发芽不利;高红兵等人[20]在对东北红豆杉Taxus cuspidata的研究中发现,种子层积过程中少量IAA的增加是由胚生长而引起的,IAA与其休眠和萌发的关系不大;黄丹等人[21]在研究美国桂花Osmanthus americanus时也发现,美国桂花种子在层积过程中其IAA含量的变化规律不明显。本文的研究结果表明,低温层积处理前期毛梾种子中的IAA含量是增加的,但其达到一定高度后又有所下降。因此认为,作为促进剂的IAA在解除毛梾种子休眠过程中起到了一定的作用,但其作用规律及机理尚待进一步研究。
目前的研究结果表明,用GA处理种子可有效促进种子的萌发[22]。洑香香等人[23]的研究结果表明,GA3浸泡结合层积处理可有效解除山茱萸Cornus officinalis种子休眠。王宁等人[24]的研究结果表明,用400 mg·L-1GA浸泡冬青Ilex purpurea种子48 h可显著提高GA、CTK和IAA含量,显著降低ABA含量,从而促进种子萌发。因此,林木种子的休眠与萌发可能取决于内源生长抑制剂和生长激素剂之间的平衡力。Wareing与 Saunders[25]研究认为,GA1/3通过与ABA和环境因子的复杂作用来调节休眠的释放和种子的萌发。但Bewley[26]认为,GA1/3并不参与对休眠本身的调控,而对促进和维持发芽起作用,能拮抗ABA。试验中发现,随着层积处理时间的延长,毛梾种子中的GA1/3与ABA含量间呈负相关性,尽管相关性不十分显著,但也表明了两者间存在一定的拮抗关系。而ZRs/ABA比值的变化基本上呈现出缓慢增加的趋势,因此认为,ZRs在打破毛梾种子休眠、促进种子萌发上起到了一定的作用,这种作用也可能是通过ABA和GA1/3的平衡和拮抗来调节控制的。
植物种子休眠及休眠的解除是十分复杂的生理现象,内源激素的变化及其相互关系是控制休眠的内因,而外部环境条件的变化是其外因[27]。低温层积处理目前仍是解除种子深休眠的主要手段。发芽试验结果表明,种子经过层积处理后,其发芽率与发芽势均明显上升,并随处理时间的延长而增加,而未经低温层积处理的种子其发芽率为0,说明低温层积处理对毛梾种子深休眠的解除效果十分明显。但是,对于不同植物的种子及不同的处理方式,以层积处理解除休眠所需的时间是不同的。例如银杏Ginkgo biloba因其存在生理休眠,需要低温层积处理90 d才能解除其休眠,而美国山核桃Caraya illinoensis则需要低温层积处理30~150 d才能顺利发芽[28]。本试验结果说明,低温层积120与150 d种子发芽率及发芽势的变化均不显著,而层积处理180 d后毛梾种子的发芽率与发芽势均明显上升,分别达到41.34%和36.13%。由此推断,要有效解除毛梾种子的深休眠,至少要低温层积处理150 d以上。本研究结果可为此类植物实生苗培育过程中的种子播种前的预处理提供参考依据。
[1] 《中国树木志》编辑委员会.中国树木志[M].第2卷.北京:中国林业出版社,1985:1686-1687.
[2] 柳 鎏,孙醉君.中国重要经济树种[M].南京:江苏科学技术出版社,1986:148-150.
[3] 康永祥,贠玉洁,赵宝鑫,等.毛梾种子萌发特性及幼苗生长规律研究[J].西北林学院学报,2012,27(3):62-67.
[4] 王晓光,李 蔚,刘先贵.光皮毛梾种子催芽技术研究[J].湖北林业科技,2007,(4):26-28.
[5] 李宗庭,周 燮.植物激素及其免疫检测技术[M].南京:江苏科学技术出版社,1996.
[6] 唐定台,徐民新,冯永红.石竹试管花的诱导及其影响因子的研究[J].园艺学报,1996,23(3):277-280.
[7] Khan A. Primary, preventive and permissive role of hormones in plant systems[J]. Bot Rev, 1975, 41:391-420.
[8] 曹帮华,蔡春菊.银杏种子后熟生理与内源激素变化的研究[J].林业科学,2006,42(2):32-37.
[9] Leubner-Metzger G. Functions and regulation of b-1,3-glucanase during seed germination, dormancy release and after-ripening[J].Seed Sci Res, 2003, 13:17-34.
[10] Nambara E, Marion Poll A. ABA action and interactions in seeds[J].Trends Plant Sci, 2003,8:213-217.
[11] 韩明玉,张满让,田玉命.植物激素对几种核果类种子休眠破除和幼苗生长的效应研究[J].西北植物学报, 2002, 22(6):1348-1354.
[12] 付婷婷,程红焱,宋松泉.种子休眠的研究进展[J].植物学报,2009, 44(5): 629-641.
[13] 陈庆亮,王华磊,王志芬,等.低温层积与外源GA3对肉苁蓉种子萌发及其内源GA和ABA含量的影响[J].植物生理学通讯,2009,45(3):270-272.
[14] 牛东玲,宋玉霞,郭生虎.肉苁蓉种子休眠与萌发特性的初步研究[J].种子,2006,25(2): 17-21.
[15] 雷泞菲,彭书明,牛 蓓.珍稀濒危植物珙桐种子休眠萌发过程中内源激素的变化[J].广西植物,2009,29(1):66-69.
[16] 杨立学,王海南,张 琳.低温层积过程中紫椴种子内源激素含量的变化[J].经济林研究,2012,30(2):15-18.
[17] 杨万霞,方升佐.青钱柳种子综合处理过程中内源激素的动态变化[J].南京林业大学学报:自然科学版, 2008, 32(5):85-88.
[18] Kochanko V G, Gitzesik M, Chojnowsk M,et al.Effect of temperature, growth regulators and other chemicals onEchinacea purpurea(L) Moench seed germination and seedling survival[J].Seed Sci & Technol, 1998,26: 547 - 554.
[19] 李金克,金幼菊,陈华君,等.红松种子层积催芽处理和萌发过程中内源GA和IAA含量的变化[J].河北林果研究, 1997,12(3):203-208.
[20] 高红兵,昊榜华,孙振良.东北红豆杉层积过程中内源生长素和脱落酸含量的变化[J].吉林林学院学报, 1998, 14(4):187-189.
[21] 黄 丹,许岳香,胡海波.美国桂花种子低温层积过程中内源激素的动态变化[J].林业科技开发,2010,24(1):53-56.
[22] 余朝霞,黄雪群. GA对林木种子萌发的调控研究进展[J].浙江林业科技,2003,23(1):73-77.
[23] 洑香香,周晓东,刘红娜.山茱萸种子休眠机理与解除方法初探[J].中南林业科技大学学报,2013,33(4):7-13.
[24] 王 宁,梅海军,袁美丽,等.赤霉素浸种和变温层积过程对冬青种子激素含量的影响[J].河南农业大学学报, 2010, 44(5)524-527.
[25] Wareing PF, Saunders PF. Hormones and dormancy[J]. Annu Rev Plant Physiol, 2003, 22:261-288.
[26] Bewley JD. Seed germination and dormancy[J]. Plant Cell, 1997,9:1055-1066.
[27] 王友凤,马祥庆.林木种子萌发的生理生态学机理研究进展[J].世界林业研究,2007,20(4):19-23.
[28] 管康林.树木种子休眠性状的研究综述[J].浙江林学院学报,1986,3(2):99-109.

