聚合物纳米微球分离纯化棘白霉素B母核方法研究
冷 凤,孔 鹏,谢新宇,邓佩佩,宋 盼,李 梅,李 敏,孟雅娟
(微生物药物国家工程研究中心 河北省工业微生物代谢工程技术研究中心华北制药集团新药研究开发有限责任公司,河北 石家庄 050015)
近年来,广谱抗生素的滥用及实体器官移植手术的广泛开展,导致了免疫抑制剂的大量使用,放化疗和对免疫系统更具有侵害性的医疗方法的应用,造成真菌感染人群显著增加。棘白霉素类抗真菌药物是以真菌细胞壁为作用靶点,非竞争性地抑制细胞壁β-1,3-D-葡聚糖合成,使细胞周期停滞,细胞壁完全性破坏,从而导致真菌细胞溶解死亡。而哺乳动物缺乏该合成酶,故棘白霉素类药物对真菌细胞有较高的特异性,对人体正常细胞影响较小[1]。
阿尼芬净(anidulafungin)是第三代棘白霉素类半合成抗真菌类药物,是两性霉素B的衍生物,由美国礼来制药公司研发,2006年12月在美国上市[2]。棘白霉素B(echinocandin B)是棘白霉素系列中的重要类型,通过脱酰基酶将棘白霉素B的酰基侧链切掉,生成棘白霉素B母核(echinocandin B nucleus),再接上活性酯侧链生成阿尼芬净。
棘白霉素B母核为浅黄色粉末,在水、二甲基亚砜中易溶,在甲醇、乙醇中微溶,在氯仿中极微溶,在丙酮中不溶。分子式为C34H51N7O15,分子量为797.81。Boeck等[3]利用制备色谱技术分离出高纯度的棘白霉素B母核,但处理量小,无法实现产业化生产。目前国内有关棘白霉素B母核分离纯化的报道较少。
聚合物纳米微球是由苯乙烯/二乙烯基苯类聚合而成的高分子聚合物,多为树脂,在化工及制药行业中应用广泛。聚合物纳米微球已成为提取分离纯化工艺中不可缺少的分离介质之一。王慧娟等[4]采用聚合物纳米微球分离莽草酸;李宁等[5]采用聚合物纳米微球分离格尔德霉素;林毅等[6]采用聚合物纳米微球制备高纯度的达托霉素。作者采用聚合物纳米微球对棘白霉素B母核粗提物进行层析纯化,并对层析条件进行了优化。该纯化方法简单、易行、稳定,层析介质可反复多次使用,为该产品的产业化开发提供一定的理论基础。
1 实验
1.1 材料、试剂与仪器
棘白霉素B母核粗提物(含量80%),自制;Uni PS 30、Uni PSN 30、NM 100型聚合物纳米微球,苏州纳微科技有限公司。
乙腈(色谱纯),美国Merck公司;冰乙酸、无水乙醇,北京化工厂。
中压层析系统(C-601泵,C-615控制器,C-660收集器,C-635检测器),瑞士Buchi公司;LA-2010A型高效液相色谱仪(CUV-VIS检测器,Easy3000工作站),日本岛津公司。
1.2 色谱条件
色谱柱:Hypersil ODS C18(4.6 mm×250 mm,5 μm);流动相:乙腈∶水∶三氟乙酸=4∶96∶0.02;流速:1.0 mL·min-1;柱温:40 ℃;检测波长:210 nm;进样量:10 μL。
1.3 聚合物纳米微球的筛选
取100 g聚合物纳米微球用1 mol·L-1的NaOH溶液浸泡2 h,纯化水洗至中性,湿法装柱(Φ∶H=1∶9,S=5.31 cm2),纯化水平衡系统。取1 g棘白霉素B母核粗提物用纯化水溶解,上样,然后分别用1%、3%、5%(体积分数,下同)乙醇洗脱,洗脱流速10 mL·min-1,收集洗脱液,每管20 mL。HPLC检测洗脱液色谱纯度,将主峰色谱纯度(峰面积归一法,下同)≥98%的洗脱液合并,计算洗脱收率。洗脱液冷冻干燥后,得到棘白霉素B母核。
1.4 洗脱液乙醇体积分数的选择
取1 g棘白霉素B母核粗提物用纯化水溶解,上样于Uni PS 30型聚合物纳米微球层析柱,分别用1%、3%、5%的乙醇洗脱,洗脱流速10 mL·min-1,收集洗脱液,每管20 mL。HPLC检测洗脱液色谱纯度,将主峰色谱纯度≥98%的洗脱液合并,计算洗脱收率。
1.5 洗脱流速的选择
取1 g棘白霉素B母核粗提物用纯化水溶解,上样于Uni PS 30型聚合物纳米微球层析柱,用3%乙醇洗脱,分别以6 mL·min-1、8 mL·min-1、10 mL·min-1、12 mL·min-1、14 mL·min-1、16 mL·min-1的流速进行洗脱,收集洗脱液,每管20 mL。HPLC检测洗脱液色谱纯度,将主峰色谱纯度≥98%的洗脱液合并,计算洗脱收率。
1.6 上样量的选择
分别取0.6 g、0.8 g、1.0 g、1.2 g、1.4 g棘白霉素B母核粗提物用纯化水溶解,上样于Uni PS 30型聚合物纳米微球层析柱,用3%乙醇洗脱,流速12 mL·min-1,收集洗脱液,每管20 mL。HPLC检测洗脱液色谱纯度,将主峰色谱纯度≥98%的洗脱液合并,计算洗脱收率。
2 结果与讨论
2.1 聚合物纳米微球型号的确定
以不同型号的聚合物纳米微球为层析介质,分别用1%、3%、5%的乙醇洗脱,洗脱收率见图1。
由图1可知,Uni PS 30型聚合物纳米微球层析介质对棘白霉素B母核的分离效果优于其它两种层析介质。因此,选择Uni PS 30型聚合物纳米微球作为层析介质。
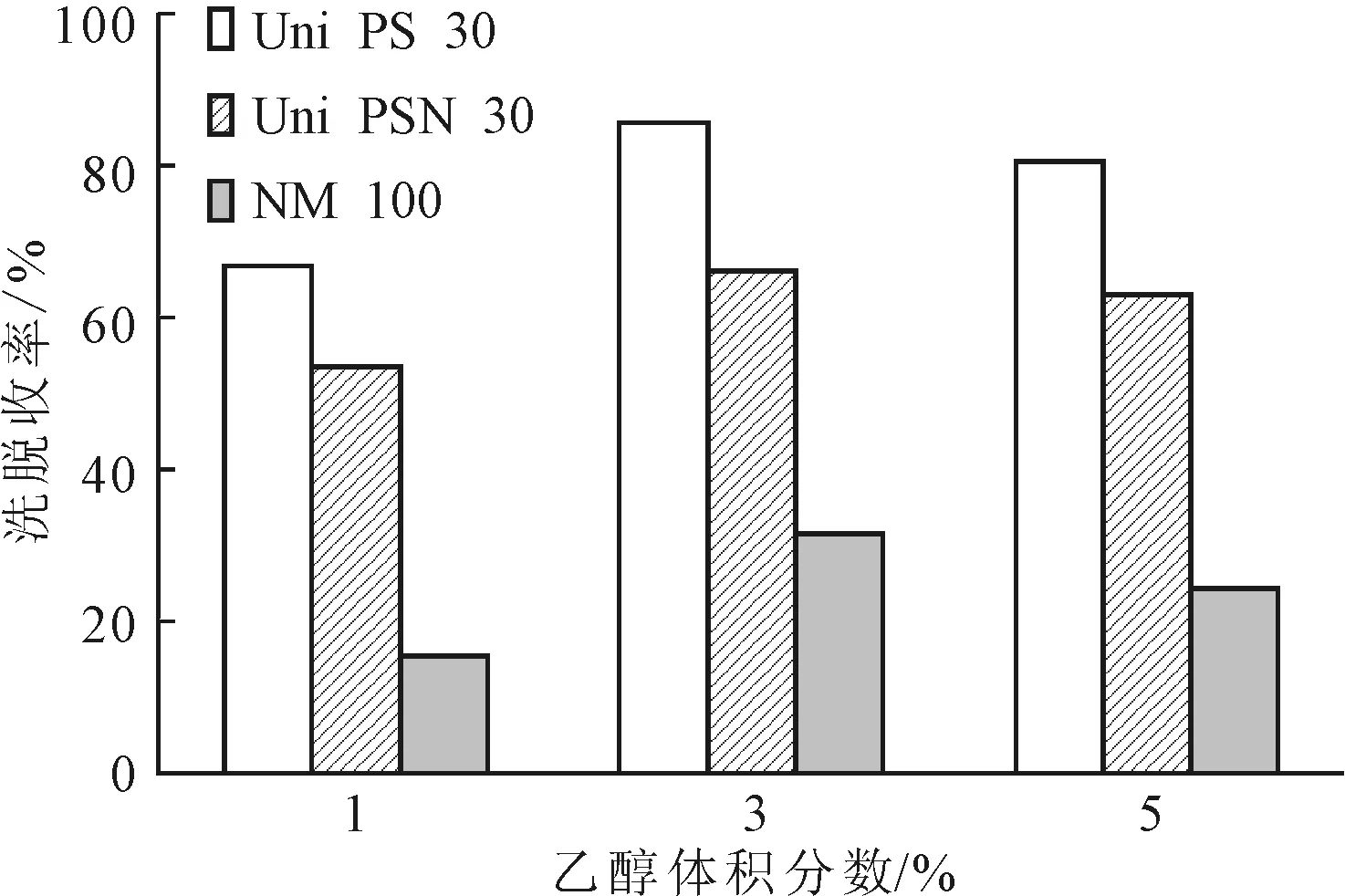
图1 不同型号聚合物纳米微球对棘白霉素B母核的洗脱收率
2.2 洗脱液乙醇体积分数的确定
以Uni PS 30型聚合物纳米微球为层析介质,分别采用1%、3%、5%的乙醇进行洗脱,洗脱液体积和洗脱收率见表1。
表1不同体积分数的乙醇洗脱时洗脱液体积和洗脱收率
Tab.1Theelutionvolumeandyieldofdifferentvolumefractionsofethanol

乙醇体积分数/%上样量/g洗脱液体积/mL洗脱收率/%1163066 83145085 75126080 3
由表1可知:用1%乙醇洗脱时,洗脱液体积大,洗脱过程拖尾且洗脱收率低;用5%乙醇洗脱时,洗脱液体积小,洗脱速度过快,层析柱分离度低,主峰与杂质之间不能有效分离,洗脱收率较低;用3%乙醇洗脱时,洗脱液体积适中,层析柱分离度较高,分离效果较好,洗脱收率高,洗脱液中棘白霉素B母核色谱纯度较高。因此,确定洗脱液乙醇体积分数为3%。
2.3 洗脱流速的确定
以Uni PS 30型聚合物纳米微球为层析介质,用3%乙醇在不同洗脱流速下洗脱,洗脱收率见图2。
由图2可知,同样条件下,洗脱流速不同,洗脱收率差异较大。洗脱流速较低(6 mL·min-1)时,分离时间过长,洗脱收率较低;洗脱流速过快(16 mL·min-1)时,主峰与杂质之间不能充分分离,洗脱收率较低;当洗脱流速为8~12 mL·min-1时,洗脱收率较高,均达到85%以上。考虑单次实验时间,确定洗脱流速为12 mL·min-1。

图2 不同洗脱流速下的洗脱收率
2.4 上样量的确定
以Uni PS 30型聚合物纳米微球为层析介质,用3%乙醇洗脱,流速为12 mL·min-1,采用不同的上样量时的洗脱收率见图3。
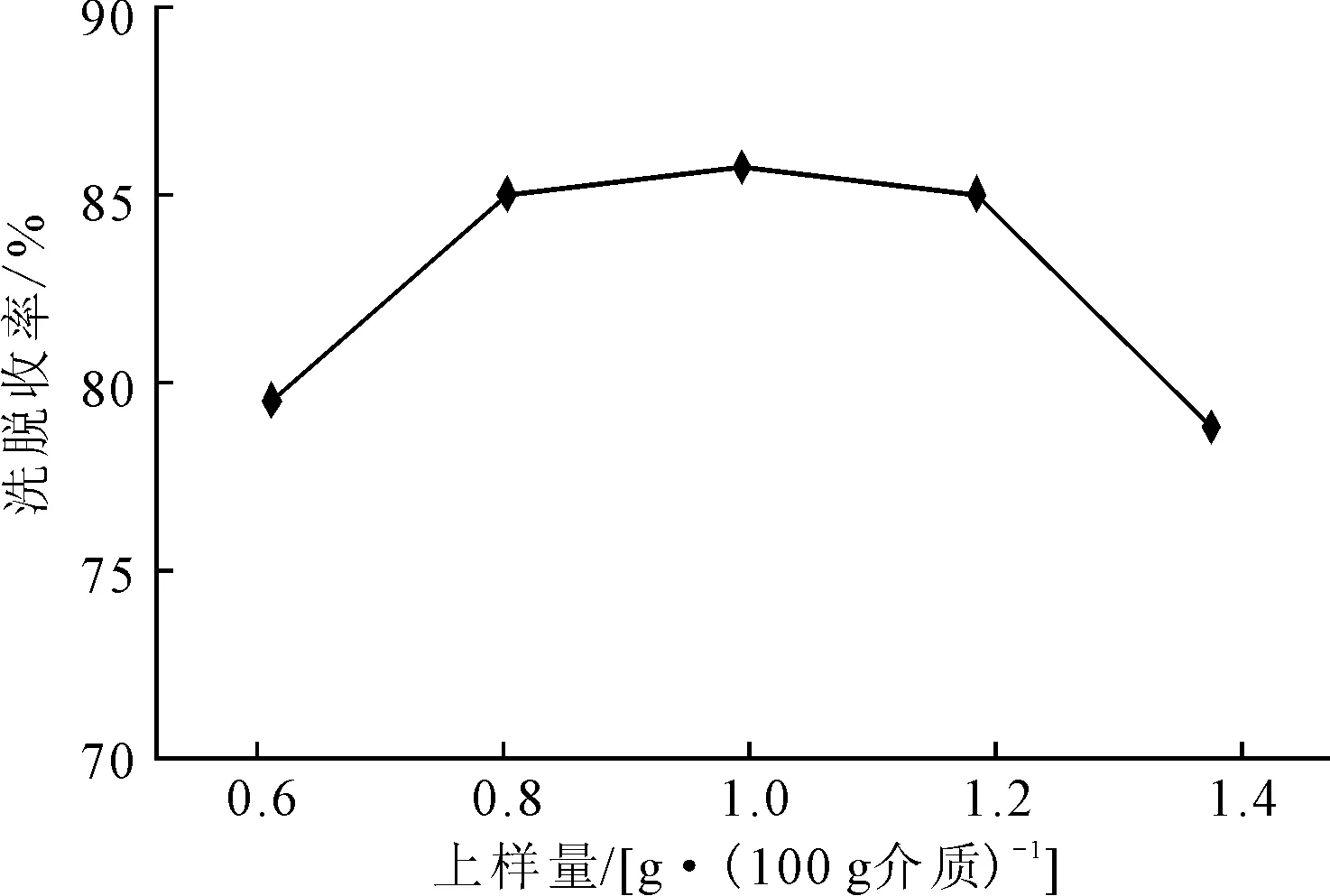
图3 不同上样量下的洗脱收率
由图3可知,同样条件下,上样量过低时,样品分散严重,洗脱体积较大,不易收集到高纯度的洗脱液,洗脱收率较低;上样量过大时,主峰与杂质峰重叠,造成洗脱液纯度显著下降,洗脱收率也较低。在保证分离度的前提下,选择上样量为0.8~1.2 g·(100 g介质)-1时,洗脱收率较高,均达到85%以上。考虑单次实验处理量,上样量选择1.2 g·(100 g介质)-1为宜。
3 结论
以聚合物纳米微球为层析介质分离纯化棘白霉素B母核。结果表明,以Uni PS 30型聚合物纳米微球为层析介质、上样量1.2 g·(100 g介质)-1、以3%乙醇为洗脱液、流速12 mL·min-1时,得到纯度大于98%的棘白霉素B母核,总收率大于85%。该分离纯化方法简便、快捷可行,为该产品产业化开发提供一定理论基础。
参考文献:
[1]李岷,沈永年,吕桂霞,等.棘白菌素类抗真菌药[J].中国真菌学杂志,2009,4(4):249-257.
[2]谢新宇.新型抗真菌药阿尼芬净的研究进展[J].河北化工,2011,34(5):33-34.
[3]BOECK L D,FUKUDA D S,ABBOTT B J,et al.Deacylation of echinocandin B byActinoplanesutahensis[J].J Antibiot,1989,42(3):382-388.
[4]王慧娟,杨宁.聚合物纳米微球分离纯化莽草酸方法研究[J].河南科技,2014,12(1):58-60.
[5]李宁,张雪霞,李晓露,等.聚合物纳米微球分离纯化格尔德霉素方法研究[J].化学与生物工程,2011,28(7):74-77.
[6]林毅,张雪霞,李宁,等.聚合物纳米微球分离纯化达托霉素方法研究[J].中国抗生素杂志,2013,38(8):588-592.

