替米沙坦抑制大鼠非酒精性脂肪肝纤维化
李 欣,金爱花,黄 媛,李成浩,金海燕
(延边大学 附属医院 消化内科,吉林 延吉 133000)
研究论文
替米沙坦抑制大鼠非酒精性脂肪肝纤维化
李 欣,金爱花,黄 媛,李成浩,金海燕*
(延边大学 附属医院 消化内科,吉林 延吉 133000)
目的探讨替米沙坦(Tel)对大鼠非酒精性脂肪肝纤维化(NAFLF)的抑制作用。方法60只Wistar大鼠随机均分为6个组,对照组用含胆碱的氨基酸(CSAA)饲料喂养,添加0(CSAA组)或2.5 mg/(kg BW)(CDAA治疗组)的Tel;剩余4组用胆碱缺乏的氨基酸(CDAA)饲料喂养复制非酒精性脂肪肝纤维化模型,分别添加0 (CDAA组)、0.5 (低)、1.0 (中)和2.5 mg/(kg BW) (高浓度组)的Tel,共10周。常规方法检测血清生化指标。免疫组化法观察肝组织α-平滑肌激动蛋白(α-SMA)和转化生长因子-β1(TGF-β1)的表达;实时定量PCR法测定肝组织Ⅰ型前胶原、金属基质蛋白酶(MMPs)及其抑制物(TIMPs)的表达。结果CDAA组血浆中透明质酸,碱性磷酸酶,γ-谷氨酰转肽酶和总胆红素均高于CDAA添加Tel组(Plt;0.05 或Plt;0.01);肝组织α-SMA 和TGFβ1定量分析表明,CDAA组表达明显高于CDAA添加Tel组(均Plt;0.01)。CDAA组的Ⅰ型前胶原表达明显高于CDAA添加Tel组(Plt;0.01),且随着Tel剂量的增加,表达逐渐减少;同时MMP- 13表达上升(Plt;0.01),而MMP- 2及9和TIMP- 1及2的表达下降(Plt;0.01);Tel控制CDAA喂养大鼠的体质量增加。结论替米沙坦可通过抑制肝星状细胞的活化而阻止NAFLF的形成,有望成为控制非酒精性脂肪肝病发展的很有前景的药物。
替米沙坦;肝纤维化;肝星状细胞;非酒精性脂肪肝病
目前,非酒精性脂肪肝病(non-alcoholic fatty liver disease, NAFLD)在发达国家已成为慢性肝病的主要病因,做为一种进展性与代谢相关的肝病,包括了单纯性脂肪肝、非酒精性脂肪肝炎(non-alcoholic steatohepatitis, NASH)、非酒精性脂肪肝纤维化(non-alcoholic fatty liver fibrosis, NAFLF)、肝硬化和肝癌[1- 2]。肾素-血管紧张素系统(renin-angiotensin system, RAS)在肝纤维化发展中起重要作用, 其中血管紧张素Ⅱ是主要作用因子[3],它可作用于血管紧张素Ⅱ的Ⅰ型受体(angiotensinⅡ type 1 receptor, AT1)而发挥作用。众所周知,肝星状细胞(hepatic stellate cell, HSC)是肝纤维化形成的关键细胞[4],HSC可表达AT1[5]。NASH的病理并不十分清楚,但在大多数情况下与胰岛素抵抗相关[6]。替米沙坦(telmisatan, Tel)是AT1拮抗剂,可作为选择性的过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor, PPAR γ)激动剂,起到胰岛素增敏作用[7]。本研究通过胆碱缺乏的氨基酸(choline-deficient L-amino acid-defined, CDAA)饲料诱导NASH模型[8],探讨Tel对NASH相关性肝纤维化形成的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物:清洁级雄性Wistar大鼠,6周龄,体质量140 ~150 g[延边大学医学部实验动物中心提供,合格证号SCXK (吉) 2011- 0007 ] 饲养温度23 ℃±2 ℃;湿度50%±20%;12 h光照和黑夜循环,水和食物均为随意摄取。
1.1.2 动物饲料:CDAA饲料和含胆碱的氨基酸 (choline- supplemented L-amino acid-defined, CSAA) 饲料购于南通特洛菲饲料科技有限公司。替米沙坦(江苏万邦制药),研磨成粉末后与CDAA和CSAA饲料均匀混合,最终达到每只大鼠进食Tel的量为0.5、1.0和2.5 mg/(kg BW)。
1.1.3 主要试剂:大鼠透明质酸 (hyaluronic acid, HA) ELISA试剂盒(上海凯博生物),偶氮卡红(Azan)染色试剂盒(American MasterTech公司),免疫组化ABC试剂盒(Vector Laboratories公司),α-平滑肌激动蛋白(α-smooth muscle actin, α-SMA)抗体(Dako公司),转化生长因子β1(transforming growth factor-β1,TGF-β1)抗体(Santa Cruz公司),总RNA提取试剂盒(Qiagen公司),cDNA合成用AMV反转录试剂(Roche公司)。
1.2 方法
1.2.1 实验动物模型分组:大鼠以普通饲料喂养1周后,随机均分为6组。两组用CSAA饲料喂养,添加不同浓度的Tel,最终达到每只大鼠进食Tel的量分别为0(CSAA组)和2.5 mg/(kg BW) (CSAA治疗组);模型组以CDAA饲料喂养,添加不同浓度的Tel,最终达到每只大鼠进食Tel的量分别为0(CDAA组)、0.5 (低)、1.0 (中)和2.5 mg/(kg BW) (高浓度组)。实验周期为10周,为使各组大鼠的进食量相等,在饲料完全消耗后添加新的饲料。10周末,所有大鼠禁食12 h后,水合氯醛(250 mg/Kg)麻醉下称取体质量后,经腹主动脉采血,常规制备血清;再取出肝脏并称取质量,留取肝右叶组织,制备病理组织和免疫组织化学标本,部分于-80 ℃冻存。
1.2.2 检测血清纤维化及肝功能指标:按试剂盒要求用ELISA方法检测HA;生化法检测总胆汁酸(to-tal bile acid, TBA),碱性磷酸酶(alkaline phosphatase, ALP),γ-谷氨酰转肽酶(γ-gluamyl transpeptidase, γ-GTP),丙氨酸转氨酶(alanine aminotransferase, ALT)和总胆红素(total bilirubin, TBIL)。
1.2.3 免疫组化法检测:α-SMA和TGF-β1经甲醛固定的石蜡包埋的肝脏标本,切成5 μm厚用于Azan stain和免疫组化。Azan染色按试剂盒说明操作,测定细胞外基质(extracellular matrix, ECM)沉积的表达。免疫组化按既往的抗生物素蛋白-生物素-过氧化物酶复合物法[9],使用Vectastain ABC试剂盒,α-SMA抗体稀释为1∶250,TGF-β1抗体稀释为1∶100。定量分析使用了Motic Med 6.0数码医学图像分析系统(xiamen motic software engineering Co., LTD)。
1.2.4 实时定量PCR法检测Ⅰ型前胶原、纤维降解基因和促纤维化基因:冻存的肝组织总RNA提取和cDNA合成分别使用了相应的试剂盒,按照如前[9]的检测方法,测定了Ⅰ型前胶原(type Ⅰ procollagen)、金属基质蛋白酶(matrix metalloproteinases, MMPs)、金属蛋白酶组织抑制物(tissue inhibitor of metalloproteinases, TIMPs)信使RNA(messenger RNA, mRNA)的量,引物如前所示[10]。
1.3 统计学分析
采用SPSS17.0统计软件对实验结果进行分析,计量资料以均数±标准差(x±s)表示,用t检验进行统计学分析。
2 结果
2.1 各组大鼠体质量和肝脏质量
CDAA添加Tel后大鼠体质量随着Tel浓度的增加而减少,与CDAA组比较Plt;0.05或Plt;0.01。另一方面,CDAA添加Tel后大鼠的肝脏质量均较CDAA组大鼠的减轻(表1)。

表1 各组大鼠的体质量及肝质量
*Plt;0.05,**Plt;0.01 compared with CSAA group;#Plt;0.05,##Plt;0.01 compared with CDAA group.
2.2 各组大鼠的肝脏血清生化学结果
喂食CDAA同时添加不同剂量的Tel,血浆中HA含量均低于CDAA组,各组随着Tel浓度的增加HA含量逐渐减少,且均高于CSAA组。血清TBA, ALP,γ-GTP和TBIL也显示了相似的结果。而血清ALT水平在CDAA添加Tel后,各组均高于CDAA组,且随着Tel浓度的增加而上升,但在CSAA组和CSAA治疗组之间无差异(表2)。
2.3 各组大鼠肝纤维化程度
CDAA组显示了明显的纤维化,添加了不同剂量的Tel后,肝纤维化程度逐渐减轻,图像分析结果表明,添加Tel后各组纤维阳性面积与CDAA组比较均减少(Plt;0.01)(图1)。
2.4 肝组织α-SMA和TGFβ1的表达
Alpha-SMA在CDAA组的肝脏中明显表达,并主要沿着纤维地带分布。α-SMA阳性面积在添加了Tel组明显少于CDAA组。定量分析显示,添加Tel组的α-SMA阳性面积与CDAA组比较均减少(Plt;0.01)(图2)。TGFβ1阳性所见主要分布于纤维隔膜区域,图像分析表明CDAA组明显高于Tel添加组(均Plt;0.01)(图3)。
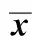
表2 各组大鼠血清中的HA、TBA、ALP、ALT、r-GT及Tbil水平Table 2 The lever of HA, TBA, ALP, ALT, r-GT and Tbil in serum of each group rats(±s,n=10)
*Plt;0.01 compared with CSAA group;#Plt;0.05,##Plt;0.01 compared with CDAA group.
2.5 肝组织纤维化基因的表达
CDAA组的Ⅰ型前胶原的mRNA明显高于Tel添加组,且随着Tel的剂量的增加,其表达逐渐减少,同时MMP- 13的表达上升;添加Tel后,肝组织表达MMP- 2和9以及它们的抑制物TIMP- 1和2均同时下降(图4)。上述各项指标在CSAA组和CSAA治疗组之间无任何差异,且均与CDAA组和Tel添加组之间存在显著差异,故数据未逐一列出。
3 讨论
NASH的发病机理尚不十分清楚,喂食CDAA饲料的大鼠,能发展为脂肪肝、 肝硬化和肝细胞癌,大鼠喂食CDAA饲料后1周可发展为脂肪肝,第4周开始出现肝纤维化,此后分别从第12周和第30周进展为肝硬化或肝细胞癌[11]。本研究的主要目的是观察Tel对CDAA饲料诱导的肝纤维化形成的影响,因此设计了喂食CDAA饲料10周,这一肝纤维化基本形成阶段进行研究。文献报道表明,PPAR γ在调节碳水化合物和脂质代谢中起重要作用,PPAR γ的配体能提高胰岛素敏感性[12],它的全配体,常常伴随液体潴留、体质量增加和浮肿[7]。而Tel不同,它是作为PPAR γ的部分配体。从本研究中可以看出,Tel的用量与临床上口服量相一致时,即可作为PPAR γ的一种选择性调节剂,还可作为AT1的拮抗剂,在进食量绝对相等的情况下,Tel控制了CDAA引起的大鼠体质量的增加,这一结果与其他研究报道一致[13]。同样,由于Tel可控制CDAA引起的肝脏中脂肪的沉积,故添加Tel后肝脏质量比CDAA组的轻。因此,Tel比起其他的血管紧张素受体的拮抗剂更适合治疗NASH相关的肝纤维化。
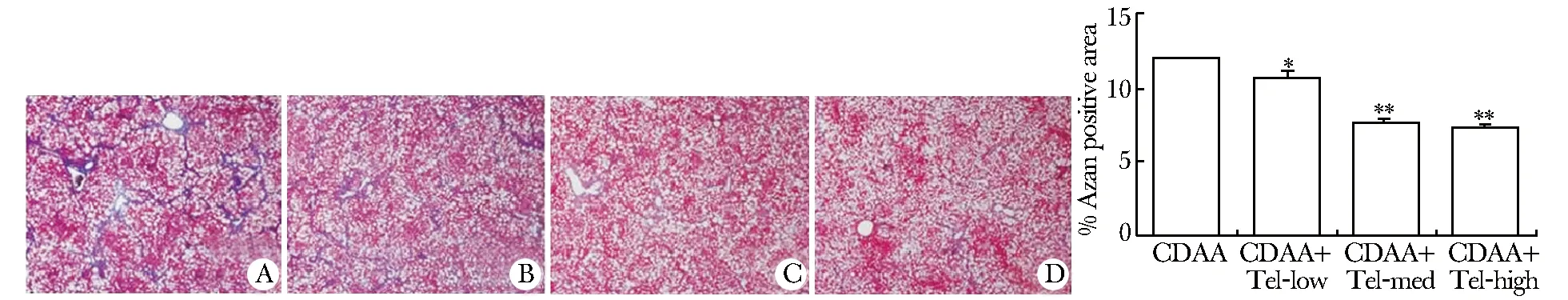
A.CDAA; B.CDAA+Tel+low; C.CDAA+Tel+med;D.CDAA+Tel-high;*Plt;0.05,**Plt;0.01 compared with CDAA group
图1Azan染色检测大鼠肝脏纤维化程度
Fig1ExtentofECMwasdetectedbyAzanstain(×40)

A.CDAA; B.CDAA+Tel+low; C.CDAA+Tel+med;D.CDAA+Tel-high; *Plt;0.01 compared with CDAA group

A.CDAA; B.CDAA+Tel+low; C.CDAA+Tel+med;D.CDAA+Tel-high; *Plt;0.01 compared with CDAA group
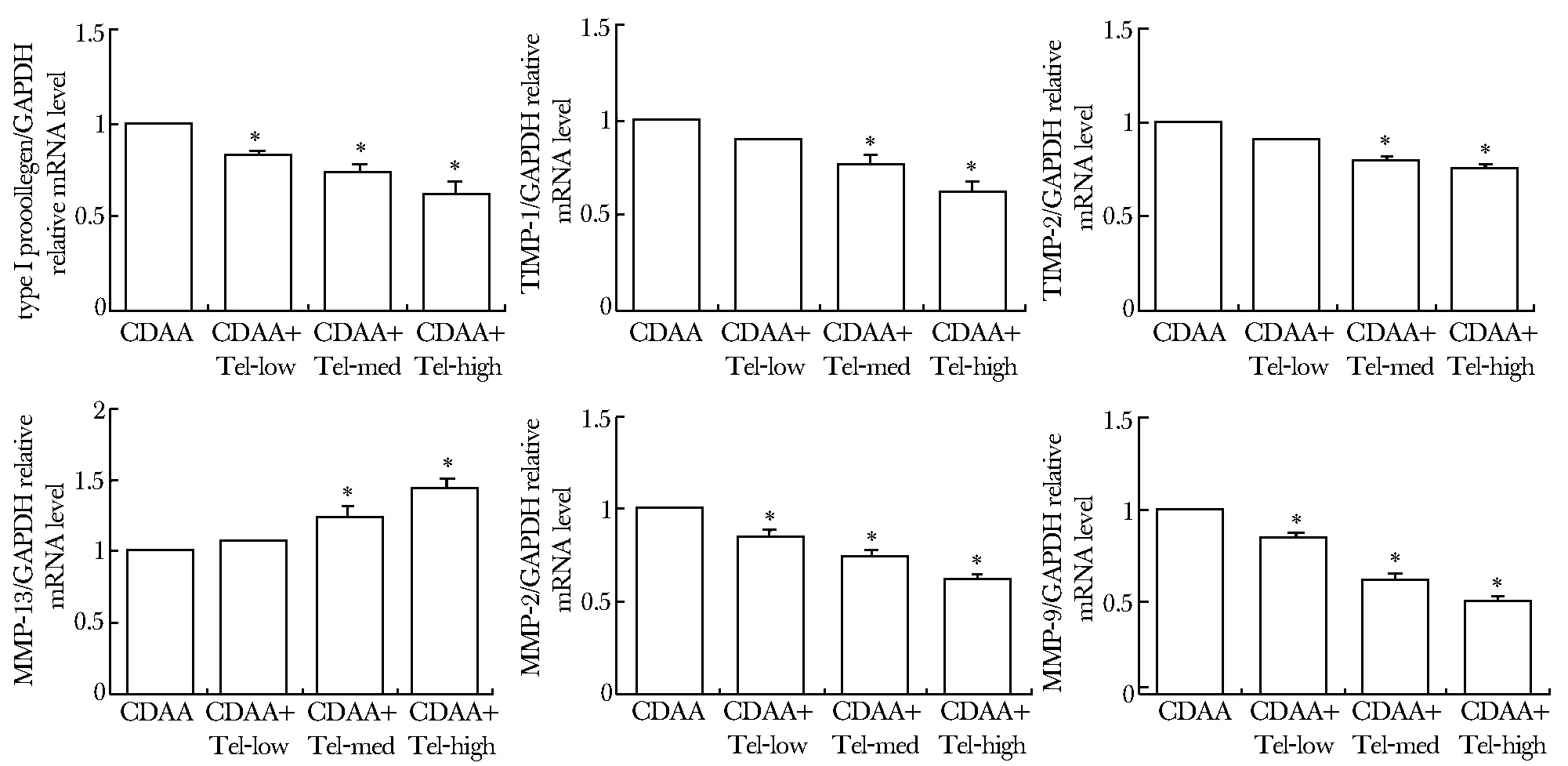
*Plt;0.01 compared with CDAA group图4 Real-time PCR检测肝组织中纤维化形成基因和纤维化降解基因的mRNA水平Fig 4 The mRNA expression level of fibrogensis and fibrolysis genes in each group was detected by real-time PCR
血清HA、TBA和ALP水平与肝纤维化程度相平行, 本研究结果说明,添加Tel组的肝纤维化程度降低了。CDAA添加Tel后血清ALT水平高于CDAA组,说明添加Tel组的大鼠肝组织中尚存较多的肝细胞,而CDAA组的大鼠已经发展成了严重的肝纤维化,残留的肝细胞数量明显减少。CSAA组与CSAA治疗组之间ALT水平无差异,证明Tel对大鼠肝细胞无损伤作用。
添加Tel的大鼠肝脏组织表达ECM的量明显少于CDAA组,进一步证实了Tel可抑制CDAA诱导的大鼠肝纤维化的形成。HSC通过活化在肝纤维化形成中起重要作用[4],α-SMA是HSC活化的金标准,添加Tel后大鼠肝组织对其表达明显减少,说明了Tel可通过抑制HSC的活化控制肝纤维化形成。TGF β1在RAS相关的肝纤维化发展中起重要作用,Ⅰ型胶原是肝纤维化时ECM的最主要成分,而TGF β1是促进HSC活化而产生胶原的最强因子。添加Tel后大鼠肝组织表达Ⅰ型胶原和TGF β1的量明显下降。已知肝纤维化可被MMPs降解,而MMPs的活性又可被它们的抑制物TIMPs所抵抗[14]。本研究中,添加Tel后肝脏表达MMP- 13 增加,MMP- 13是降解ECM的主要因子;另一方面,添加Tel后肝脏表达MMP- 2,9 和TIMP- 1,2的量比CDAA组减少,说明它们的表达与肝纤维化的程度相平行,这与其他文献报道一致[15]。
NAFLD是一种代谢综合征,Tel主要用于控制血压,它同时能控制患者的体质量,并且对NAFLD相关的肝纤维化的发生有预防作用,是一种有前景的治疗NAFLD药物。
[1] Argo CK, Caldwell SH. Epidemiology and natural history of non-alcoholic steatohepatitis [J]. Clin Liver Dis, 2009, 13:511- 531.
[2] Starley BQ, Calcagno CJ, Harrison SA. Nonalcoholic fatty liver disease and hepatocellular carcinoma: a weighty connection [J]. Hepatology, 2010, 51:1820- 1832.
[3] Bataller R, Gabele E, Parsons CJ,etal. Systemic infusion of angiotensinⅡexacerbates liver fibrosis in bile duct-ligated rats[J]. Hepatology, 2005, 41:1046- 1055.
[4] Puche JE, Saiman Y, Friedman SL. Hepatic stellate cells and liver fibrosis [J]. Compr Physiol, 2013,3:1473- 1492.
[5] Zhang Y, Yang X, Wu P,etal. Expression of angiotensin II type 1 receptor in rat hepatic stellate cells and its effects on cell growth and collagen production [J]. Horm Res, 2003, 60:105- 110.
[6] Marchesini G, Brizi M, Morselli-Labate AM,etal. Association of nonalcoholic fatty liver disease with insulin resistance [J]. Am J Med, 1999, 107:450- 455.
[7] Benson SC, Pershadsingh HA, Ho CI,etal. Identification of telmisartan as a unique angiotensinⅡreceptor antagonist with selective PPAR gamma-modulating activity [J]. Hypertension, 2004, 43:993- 1002.
[8] Nanji AA. Animal models of nonalcoholic fatty liver disease and steatohepatitis [J]. Clin Liver Dis, 2004, 8:559- 574.
[9] Jin H, Sakaida I, Tsuchiya M,etal. Herbal medicine Rhei rhizome prevents liver fibrosis in rat liver cirrhosis induced by a choline-deficient L-amino acid-defined diet[J]. Life Sci, 2005, 76:2805- 2816.
[10] Jin H, Terai S, Sakaida I. The iron chelator deferoxamine causes activated hepatic stellate cells to become quiescent and to undergo apoptosis [J]. J Gastroenterol, 2007, 42:475- 484.
[11] Sakaida I, Kubota M, Kayano K,etal. Prevention of fibrosis reduces enzyme-altered lesions in the rat liver [J]. Carcinogenesis, 1994, 15:2201- 2206.
[12] Picard F, Auwerx J. PPAR (gamma) and glucose homeostasis [J]. Annu Rev Nutr, 2002, 22:167- 197.
[13] Sugimoto K, Qi NR, Kazdova L,etal. Telmisartan but not valsartan increases caloric expenditure and protects against weight gain and hepatic steatosis [J]. Hypertension, 2006,47:1003- 1009.
[14] Benyon RC, Hovell CJ, Da Gaca M,etal. Progelatinase A is produced and activated by rat hepatic stellate cells and promotes their proliferation [J]. Hepatology, 1999, 30:977- 986.
[15] Kossakowska AE, Hinek A, Edwards DR,etal. Altered balance between matrix metalloproteinases and their inhibitors in experimental biliary fibrosis [J]. Am J Pathol, 1998, 153:1895- 1902.
Inhibitory effect of telmisartan on non-alcoholic fatty liver fibrosis in rats
LI Xin, JIN Ai-hua, HUANG Yuan, LI Cheng-hao, JIN Hai-yan*
(Dept. of Gastroenterology and Hepatology, the Affiliated Hospital of Yanbian University, Yanji 133000, China)
ObjectiveTo study the inhibited effect of telmisartan (Tel) on non-alcoholic fatty liver fibrosis (NLFLF) in rats.MethodsSixty Wistar rats were randomly and equally divided into 6 groups. Two groups of them supplied with choline-supplemented L-amino acid-defined diet(CSAA): CSAA group fed with CSAA diet only, CSAA treatment group fed with CSAA diet and supplemented with Tel of 2.5 mg/(kg BW·d)(CSAA+Tel-high). The residual four groups fed with choline-deficient L-amino acid-defined (CDAA) diet and supplemented with Tel of 0(CDAA), 0.5 (CDAA+Tel-low), 1.0(CDAA+Tel-med) and 2.5(CDAA+Tel-high) mg/(kg BW·d). The total experimental period was 10 weeks. Serum biological parameters were routinely determined. Expression of α-smooth muscle actin (α-SMA) and transforming growth factor-β1 (TGF-β1) in liver tissue were determined by immunohistochemistry, and pathological changes in liver tissues were detected by Azan staining. The
messenger RNA (mRNA) expressions of type I procollagen, matrix metalloproteinases (MMPs) and tissue inhibitor of metalloproteinase (TIMPs) were evaluated using real-time quantitative PCR.ResultsThe levels of hyaluronic acid, alkaline phosphatase, γ-gluamyl transpeptidase and total bilirubin in serum of CDAA group were all higher than those of CDAA diet supplemented with Tel (Plt;0.05 orPlt;0.01). The quantity of α-SMA and TGF-β1 was higher in CDAA rats compared with Tel treated rats(Plt;0.01). The mRNA of type I procollagen was higher than that of the Tel treated rats(Plt;0.01), and that decreasing as the dose of Tel increasing; on the same time, the expression of MMP13 increased, while the expression of MMP2,9 and TIMP1,2 decreased. Tel also controlled the body weight gain of CDAA diet rats.ConclusionsTel suppresses NLFLF in rats through inhibiting HSCs activation, it may become a promising medicine to control non-alcoholic fatty liver disease.
telmisartan; liver fibrosis; hepatic stellate cell; non-alcoholic fatty liver disease
2014- 02- 07
2014- 04- 21
国家自然科学基金(81160059);吉林省科技厅项目(200905210);吉林省教育厅“十二五”科学技术研究项目(201208)
*通信作者(correspondingauthor):jinhyyj@msn.com
1001-6325(2014)10-1321-06
R 575
A

